山楂荷叶复合固体饮料的制备工艺优化 及功能性成分含量测定
余婷婷,张 显,郏文青,张 娇,魏 屹,*
(1.西南交通大学生命科学与工程学院,四川成都 610031; 2.泸州百草堂健康产品有限公司,四川泸州 646000)
高脂血症(HLP)又称高脂蛋白血症或血脂异常,与高血压、高血糖并称“三高”,是中老年常见病及多发病[1],其所引起的动脉粥样硬化是造成冠心病、高血压和脑血管疾病的主要原因[2]。目前,国内外对高脂血症主要采用药物治疗,但药物都有不同程度的毒副作用,且高脂血症发病率逐年增高,发病年龄也趋向年轻化,因此,开发降脂保健食品,变治病为防病,有着重要的社会意义[3]。
卫生部认定的药食两用药材名录中,有许多具有降低血脂的作用,如山楂、荷叶、银杏叶、绞股蓝、葛根、昆布、三七等,均可作为保健食品或其原料进行开发,但目前并未充分开发利用,且已开发的许多降脂保健食品并无质控标准或质控标准单一[4-5]。当前市面上的保健食品仍以胶囊、片剂、口服液为主流剂型[6],而固体饮料作为新兴的保健食品剂型,具有携带方便、保质期较长等优点,更适合中老年人携带及服用,有着巨大的市场潜力[7]。
本研究以药食两用的山楂、荷叶、莱菔子、昆布为主要原料,拟主要采用正交试验设计法,优选出经济、可行的提取工艺,按照一定比例复配成一种固体饮料。该饮料降脂作用的主要药效活性成分为黄酮类和生物碱类物质,其中,黄酮类物质为方中君药山楂、荷叶主含有,含量较高,降脂效果良好[8-11],是目前许多降脂保健食品的质控指标[12];而荷叶碱为方中君药荷叶所独有,化学性质较稳定,具有功效相关的调节血脂[13-15]、抗动脉粥样硬化[16]等作用,且含量测定方法较为成熟,因此,本文选择以总黄酮含量和荷叶碱含量作为功能性指标,并分别采用紫外分光光度法和高效液相色谱法,建立总黄酮及荷叶碱的含量测定方法,从而为本品的质量控制提供更加科学的依据。
1 材料与方法
1.1 材料与仪器
荷叶碱对照品(批号:CHB151013) 成都克洛玛生物科技有限公司;芦丁对照品(批号:10080-201408) 中国食品药品检定研究院;山楂、荷叶、莱菔子、昆布 市售,经西南交通大学生命科学与工程学院宋良科教授鉴定,分别为蔷薇科植物山里红CrataeguspinnatifidaBge.var.major N.E.Br.或山楂CrataeguspinnatifidaBge.的干燥成熟果实、睡莲科植物莲NelumbonuciferaGaertn.的干燥叶、十字花科植物萝卜RaphanussativusL.的干燥成熟种子和海带科植物海带(LaminariajaponicaAresch.)或翅藻科植物昆布(EchloniakuromeOkam.)的干燥叶状体;乙腈(色谱纯) 美国Sigma公司;其他试剂 均为国产分析纯。
Waters e2695高效液相色谱仪,Waters 2998二极管阵列检测器,Waters XbridgeTMC18色谱柱(4.6 mm×250 mm,5 μm) 沃特世(Waters)科技有限公司;UV-9000S紫外可见分光光度计 上海元析仪器有限公司;SHIMADZU AUY220分析天平 日本岛津公司;KQ-250DE 超声仪 昆山市超声仪器有限公司;DZF-6090真空干燥箱 上海精宏试验设备有限公司;DK-98-1电热恒温水浴锅 天津市泰斯特仪器有限公司;RE-52AA旋转蒸发器 上海亚荣生化仪器厂。
1.2 实验方法
1.2.1 复合固体饮料的制备工艺 根据药典关于药材用量规定[17]和保健食品原料管理办法[18],结合处方中各味药材的药理作用,即以山楂、荷叶为降脂君药,辅以莱菔子降气平喘消食之效以及昆布清热散结,利水消肿之功,配以卵磷脂矫色之用,参考合作企业生产实践预用量等得到复合固体饮料的配方质量比如下,山楂:荷叶提取物∶莱菔子提取物∶昆布∶卵磷脂=1∶1∶1∶3∶1。
根据药物有效成分的理化性质,结合临床需求、生产可行性及生产设备要求等因素,拟通过正交试验设计,对荷叶和莱菔子有效成分的提取工艺进行优化,其中,生物碱类较易溶于水,黄酮类成分较易溶于乙醇、甲醇等极性溶剂中,考虑食用安全性,分别选择水和乙醇为溶剂提取莱菔子和荷叶的有效成分,同时综合处方中其他药材性质、药理作用和保健食品剂型,设计制备工艺如下:
山楂药材粉碎过100目筛,得山楂粉末;荷叶以一定浓度乙醇溶液于一定温度下回流提取一定时间,得荷叶醇提液,经60 ℃减压浓缩成膏后,于真空度-0.09 MPa、温度60 ℃下减压干燥12 h,粉碎过100目筛,得荷叶黄酮提取物粉末;莱菔子以一定体积比的水为溶剂提取一定时间,得莱菔子水提液,经60 ℃减压浓缩成膏后,于真空度-0.09 MPa、温度60 ℃下减压干燥12 h,粉碎过100目筛,得莱菔子提取物粉末;昆布于80 ℃干蒸20 min后,粉碎过100目筛,得昆布粉末。将上述山楂粉末、荷叶黄酮提取物粉末、莱菔子提取物粉末、昆布粉末等按配方质量比混匀,过100目筛,即得复合固体饮料。
1.2.2 荷叶黄酮提取工艺正交试验设计 在参考相关文献单因素试验基础上[19-20],以综合评分为评价指标,固定提取次数2次,选定乙醇浓度(A),液料比(B)、提取时间(C)、提取温度(D)4因素,每个因素选定3个水平进行L9(34)正交试验,因素水平见表1。

表1 荷叶黄酮提取正交因素水平设计Table 1 Orthogonal factor and level of lotus leaf flavonoids extraction
1.2.3 莱菔子提取物制备正交试验设计 在参考相关文献单因素试验基础上[21-22],以水溶性生物碱的雷氏盐沉淀量及干膏得率为评价指标,选定提取次数(A)、液料比(B)、提取时间(C)3因素,每个因素选定3个水平进行L9(34)正交试验,因素水平见表2。

表2 莱菔子提取物制备正交因素水平设计Table 2 Orthogonal factors and levels of radish seed extraction
1.2.4 干膏得率测定方法 参考相关文献[23],按下式计算荷叶醇提液或菜菔子水提液干膏得率。
干膏得率(%)=(M1-M0)/m×100
式中,M1为干膏与蒸发皿总重(g);M0为空蒸发皿重量(g);m为提取药材质量(g)。
1.2.5 水溶性生物碱含量测定方法 参考相关文献[24],精密量取浓缩液5 mL,采用盐酸调节pH,约2~3左右即可,过滤除去沉淀,加入过量配制好的雷氏盐溶液,过滤,用少许水冲洗沉淀,放进烘箱里面,干燥至质量恒定,精密称定,按下式计算雷氏盐沉淀量。
雷氏盐沉淀量(mg/g)=(m-m0)×(V0/V)/W×1000
式中:m为沉淀与滤纸的总重量(g),m0为滤纸的重量(g),V为量取的浓缩液的体积(mL),V0为总浓缩液的体积(mL),W为称取的药材的质量(g)。
1.2.6 总黄酮含量测定方法 参考相关文献[25-26],绘制总黄酮标准曲线及测定含量。
1.2.6.1 标准曲线的绘制 取芦丁对照品适量,精密称定,加甲醇制成每1 mL含0.24 mg的溶液,即得芦丁对照品溶液。精密量取芦丁对照品溶液(0.24 mg/mL)0、2.0、4.0、6.0、8.0、10.0、12.0 mL,分别置于25 mL容量瓶中,各加水至12 mL,精密加入5% NaNO2溶液1.0 mL,摇匀,静置6 min,精密加入10% Al(NO3)3溶液1.0 mL,摇匀,静置6 min,加入4%NaOH溶液8.0 mL,用蒸馏水分别补足至刻度,摇匀放置10 min。置1 cm比色皿中,按紫外-可见分光光度法,以零管为空白,在510 nm波长处测定吸收度,平行测定3次,取平均值,以吸光度为纵坐标,浓度为横坐标,绘制标准曲线。
1.2.6.2 加样回收率试验 精密量取已知含量的样品溶液(20170608)1 mL,平行6份,依次精密加入芦丁对照品溶液(0.24 mg/mL)1 mL,按1.2.6.1项下条件测定吸光度值。
1.2.6.3 样品测定 称取复方固体饮料粉末约1.0 g,精密称定,置圆底烧瓶中,精密加入30倍量的70%乙醇,称定重量,置80 ℃水浴中回流提取1.5 h后,取出冷却,再称定重量,用70%乙醇补足减失的重量,摇匀,过滤,滤液转移至50 mL容量瓶中,加70%乙醇至刻度,摇匀。精密量取1 mL,置25 mL量瓶中,按1.2.6.1项下方法操作,测定吸光度值,计算,即得。总黄酮含量计算公式如下:
总黄酮含量(%)=C×V×D/W×100
式中,C为提取液中总黄酮浓度;V为提取液体积;D为稀释倍数;W为原料质量。
1.2.7 荷叶碱含量测定方法 参考相关文献[27-29],绘制荷叶碱标准曲线及测定含量。
1.2.7.1 色谱条件 色谱柱:Waters XbridgeTMC18(4.6 mm×250 mm,5 μm);流动相:乙腈-水-二乙胺-冰醋酸(27∶70.6∶1.6∶0.8);检测波长:270 nm;流速:1 mL/min。理论板数按荷叶碱峰计算应不低于2000。
1.2.7.2 溶液的制备 对照品溶液的制备:取荷叶碱对照品适量,精密称定,加甲醇制成浓度为60 μg/mL的荷叶碱对照品储备液及浓度为15 μg/mL的荷叶碱对照品溶液。
供试品溶液的制备:取复方固体饮料粉末约1.0 g,精密称定,置具塞锥形瓶中,精密加入甲醇50 mL,称定重量,超声(200 W,40 kHz)30 min后取出,冷却,再称定重量,用甲醇补足减失的重量,摇匀,过滤,精密量取续滤液5 mL,置10 mL量瓶中,加甲醇至刻度,摇匀,以0.45 μm滤膜滤过,即得。
阴性对照品溶液的制备:取1.0 g按处方比例及制备工艺制备的不含荷叶的阴性样品,按供试品的制备方法制成阴性对照品溶液。
1.2.7.3 阴性干扰考察 精密吸取阴性对照溶液、对照品溶液和供试品溶液各20 μL,按1.2.7.1色谱条件进行测定。
1.2.7.4 线性关系考察 精密量取1.2.7.2项下制备的荷叶碱对照品储备液(60 μg/mL)0.25、0.5、1、2、2.5、3、4 mL,分别定容至10 mL,得到浓度为1.5、3.0、6.0、12.0、15.0、18.0、24.0 μg/mL的荷叶碱标准品溶液,按1.2.7.1项下色谱条件进样,进样量为20 μL,记录色谱图。
1.2.7.5 加样回收率试验 取已知荷叶碱含量的复方固体饮料粉末6份,各约0.5 g,分别精密加入荷叶碱对照品储备液3.4 mL后,按1.2.7.2项下方法制备成6份供试品溶液,各取20 μL按1.2.7.1项下色谱条件进样测定,分别测定峰面积。
1.2.7.6 样品测定 分别取3批固体饮料样品,按1.2.7.2项下方法制备供试品溶液,按上述1.2.7.1项下色谱条件进样测定,进样20 μL,每批平行3份测定。
1.3 数据统计分析
采用SPSS 20.0统计软件进行数据的处理与分析。文中涉及的综合评分计算公式如下:
综合评分Z=(X/Xmax)×50+(Y/Ymax)×50
式中,X为总黄酮含量或雷氏盐沉淀量,Xmax为总黄酮含量或雷氏盐沉淀量的最大值;Y为干膏得率,Ymax为干膏得率最大值。各计为50分。
2 结果与分析
2.1 荷叶黄酮提取工艺正交试验结果
由表3的正交试验结果可知,4种因素对荷叶黄酮提取物综合评分的影响力大小顺序为D>A>B>C,即提取温度>乙醇浓度>液料比>提取时间,A2B3C3D3的综合评分最高,此时乙醇浓度为80%,液料比为60 mL/g,提取时间为2.5 h,提取温度80 ℃,在此条件下进行3次重复实验,得综合评分为98.41,总黄酮含量为7.68%,RSD=1.13%,干膏得率为23.58%,RSD=0.59%。由表4可知,4种因素中,乙醇浓度对荷叶黄酮提取物综合评分的影响显著(p<0.05),提取温度对对荷叶黄酮提取物综合评分的影响极显著(p<0.01),因此在实际操作中,需注意对此二因素的严格把控。
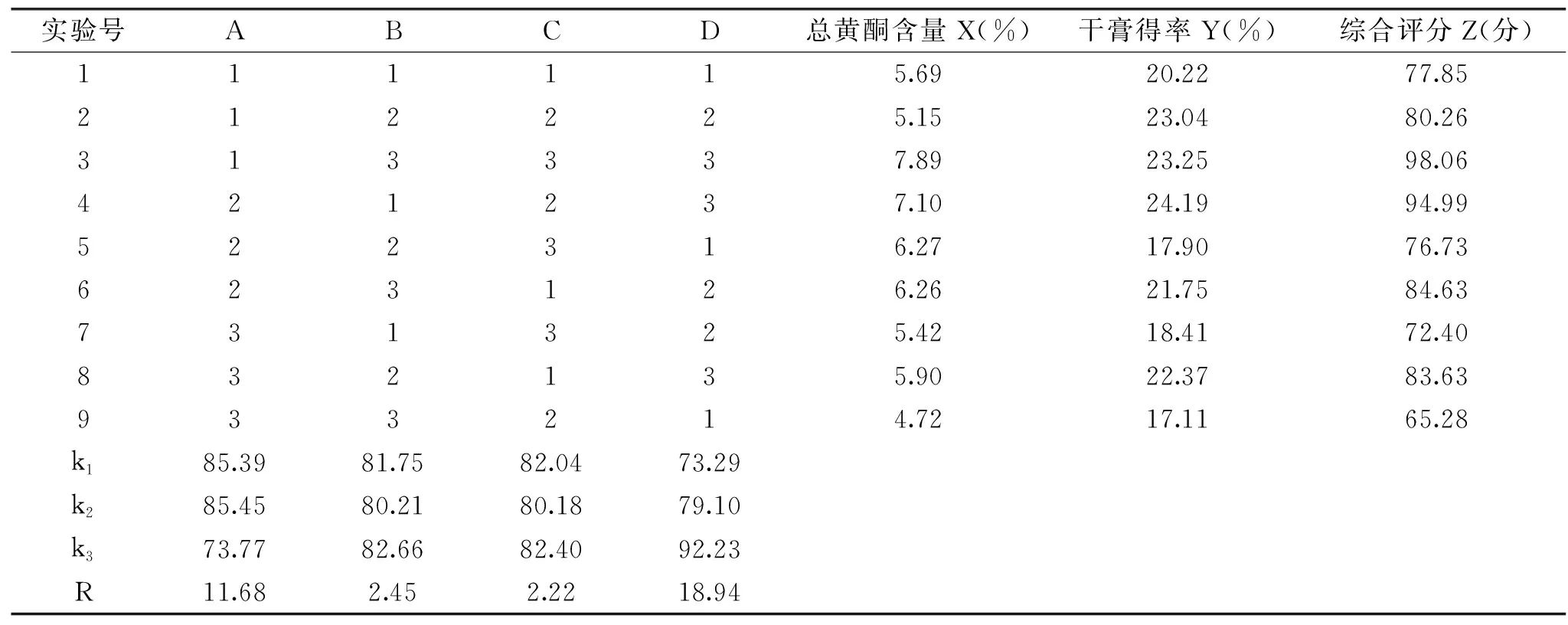
表3 荷叶黄酮提取工艺正交试验结果Table 3 Orthogonal test of lotus leaf flavonoids extraction process
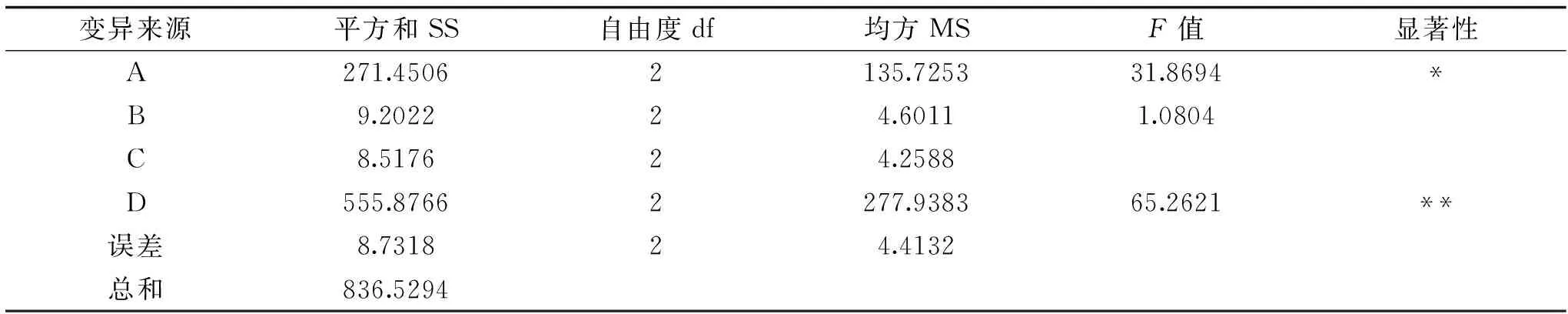
表4 荷叶黄酮提取工艺方差分析Table 4 Analysis of variance of lotus leaf flavonoids extraction process
2.2 莱菔子提取物制备正交试验
根据表5的正交试验结果可知,3因素对莱菔子提取物的综合评分的影响力大小顺序为A>B>C,即提取次数>液料比>提取时间,A3B2C3的综合评分最高,但根据表6的方差分析结果可知,此范围的液料比与提取时间对莱菔子提取物的综合评分无显著性影响,因此,结合实际情况,为提高提取效率,缩短提取时长,选取提取时间为2水平,选择最终工艺条件为A3B2C2,即提取次数为3,液料比为10 mL/g,提取时间为1.5 h,在此条件下,获得的莱菔子提取物的综合评分为98.82,莱菔子干膏得率为23.17%,RSD=0.86%,雷氏盐沉淀量为49.1018 mg/g,RSD=0.21%。

表5 莱菔子提取物制备正交试验结果Table 5 Orthogonal test results of radish seed extraction process

表6 莱菔子提取物制备方差分析Table 6 Analysis of variance of radish seed extraction process
2.3 总黄酮的含量测定结果
2.3.1 标准曲线 以芦丁质量浓度C(mg·mL-1)为横坐标,吸光度A为纵坐标,根据测定结果进行线性回归,得回归方程为:y=5.9702x-0.0046(r=0.9996),表明芦丁在0.0192~0.1152 mg/mL范围内与吸光度呈良好的线性关系。
2.3.2 加样回收率试验结果 计算得加样回收率值分别为99.87%、101.29%、98.13%、100.29%、102.38%、101.17%,平均值为100.53%,RSD值为1.45%,方法准确度良好。
2.3.3 总黄酮含量测定结果 由表7可得,3批固体饮料的总黄酮含量为6.18%~6.42%,均值为6.29%,通过与参考文献对比发现[25-26],所含总黄酮含量高于文献记录的其他降脂保健中成药和保健食品。

表7 复合固体饮料的总黄酮含量测定结果(n=3)Table 7 Results of contents determination of total flavonoids in solid beverage(n=3)
2.4 荷叶碱的含量测定结果
2.4.1 阴性干扰考察结果 供试品中荷叶碱色谱峰与相邻色谱峰达到了基线分离,理论塔板数按荷叶碱峰计算不低于2000,分离度>1.5,阴性无干扰。结果见图1。

图1 荷叶碱高效液相色谱图Fig.1 HPLC Chromatograms of nuciferine注:A.荷叶碱对照品;B.复合固体饮料样品;C.阴性对照。
2.4.2 线性关系考察结果 以荷叶碱对照品的峰面积为纵坐标,进样浓度为横坐标,得线性回归方程为y=98520x-6501.1,r=0.9999,表明荷叶碱在1.5~24.0 μg/mL的范围内呈良好的线性关系。
2.4.3 加样回收率试验结果 计算得加样回收率值为101.49%、99.26%、100.31%、101.06%、98.33%、100.53%,平均值为100.16%,RSD值为1.17 %,方法准确度良好。
2.4.4 荷叶碱含量测定结果 由表8可得,三批固体饮料的荷叶碱含量为1.58~1.66 mg/g,均值为1.63 mg/g,通过与参考文献对比发现[27-29],所含荷叶碱含量高于文献记录的其他降脂保健中成药和保健食品。

表8 复合固体饮料的荷叶碱含量测定结果(n=3)Table 8 Results of content determination of nuciferine in solid beverage(n=3)
3 结论
本研究通过正交试验得到荷叶和莱菔子的最佳提取工艺如下:荷叶的提取工艺为60倍80%乙醇于80 ℃下提取2次,每次2.5 h;莱菔子的提取工艺为10倍量水煎煮提取3次,每次1.5 h。经工艺验证,荷叶干膏得率为23.58%,荷叶黄酮含量为7.68%,莱菔子干膏得率为23.17%,水溶性生物碱雷氏盐沉淀量为49.1018 mg/g,提取效果较好,可为企业的实际生产提供科学依据。
本研究建立的功能性指标成分总黄酮和荷叶碱的含量测定方法,简便、准确、重复性好,可为产品的质量控制及评估提供相对全面的依据。本研究测定得到的三批样品的总黄酮含量均值为6.29%,荷叶碱含量均值为1.63 mg/g,总黄酮含量以及荷叶碱含量均高于文献记录的其他降脂保健中成药和保健食品,单从总黄酮和荷叶碱的含量角度来说,比市场上其他降血脂保健食品更具优势,有很好的后续研究意义,也为企业的规模生产提供研究基础。

