基于生长时间光谱法的大肠菌群快速检测仪器的设计
袁 琨,沈昊阳,贾东芬,冯 达
(1.中国计量大学 光学与电子科技学院,浙江 杭州 310018;2.杭州彩谱科技有限公司,浙江 杭州 310034;3.北京六角体科技发展有限公司,北京 101102)
大肠菌群因广泛存在于温血动物的粪便中和自然界中而被国际公认为检测医药[1]、环境[2]及水体检测[3-4]的安全性指示菌.目前多用滤膜法(MF)[5]和多管发酵法(MTF)进行检测.其中,MF法是检测大肠菌群的“金标准”[6].但是这两种方法需要在观察到阳性结果后进行验证测试,测量周期长,而且测量方法繁琐.在食品安全快速检测工作中,亟需一种快速检测的方法[7-8].
酶底物法(Enzyme substrate technique)采用大肠菌群细菌能产生β-半乳糖苷酶(β-D-galactosidase)分解ONPG(Ortho- nitrophenyl-β- D- galactopyranoside),使培养液在波长366 nm紫外光下产生荧光的原理,来判断水样中是否含有大肠菌群[9].陈灿映等研究了大肠菌群快速检测培养基,实现了培养18 h.即可对大肠菌群进行检测[10].生长时间光谱法是利用分光光度法和酶底物法相结合的一种快速检测方法.采用分光光度法直接测量,可以获得更短的检测时间.蔡尽忠等基于生长时间光谱法[11]实现对大肠菌群9 h即可得到检测结果,测量数值与菌落形成数的线性相关系数R2=0.997 6.
本文针对微生物快速检测的需求,基于生长时间光谱法设计了大肠菌群快速检测仪器.根据大肠菌群指数生长期与大肠菌群浓度的关系来计算大肠菌群初始浓度.以ONPG(邻硝基酚-β-D-半乳糖苷)为底物,研究了初始大肠菌群浓度与可见光波段特定波长处透过率测量值之间的关系,采用分光光度法对大肠菌群的生长时间进行检测.通过构建基于双积分球的测量光学结构,较低的平行样测量相对标准偏差,实现了更短测量时间.
1 生长时间光谱法的原理
当利用营养琼脂培养基对大肠菌群进行培养时,大肠菌群的数目会随着生长时间的增加而改变.大肠菌群的繁殖过程主要分为几个阶段,接种初期大肠菌群生长会进入一个停滞期.停滞一段时间后,大肠菌群开始繁殖,进入一个指数增长的时期.指数增长到一定程度,大肠菌群的菌落数目会进入一个稳定的时期,这个稳定期过后,大肠菌群由于自身的原因会进入衰亡阶段,如图1.大肠菌群细菌会产生β-半乳糖苷酶,这种酶分解ONPG使培养液呈黄色,所以溶液的颜色就成为了大肠菌群菌落形成数的指示标志[12].通过分光光度法对特定波长透过率的检测就能准确的指示大肠菌群的菌落数变化,大肠菌群的生长时间与透过率的变化如图2.

图1 大肠菌群生长时间曲线Figure 1 Total coliforms growth time curve

图2 大肠菌群的生长时间与透过率的关系Figure 2 Relationship between growth time and transmissibility of total coliforms
生长时间光谱法就是利用大肠菌群繁殖过程中的指数增长这一时期,大肠菌群到达稳定菌落数的时间与大肠菌群的初始浓度有关.由大肠菌群达到稳定期所消耗的生长时间和大肠菌群的初始浓度的特定关系进行相应的数学计算求出大肠菌群的初始浓度.透过率到达某一个固定透过率Tt所需要的时间t与大肠菌群的初始浓度相关.
在实际实验过程中,为了使检测时间缩短,需要使得Tt尽可能高.即分光光度测量结果在大肠菌群数量比较少时,透过率信号应能稳定体现菌群的菌落数量,需要保证多次测量的测量稳定性.传统的分光光度计多采用0/0测量几何条件,且光束直径较小.由于基于生长时间光谱法的大肠菌群快速检测中,在对大肠菌群进行培养时,菌群是在比色皿中随机位置出现的,菌群的位置和大小会造成分光光度计入射光线的散射,给测量稳定性带来较大影响,如图3.所以,在仪器测量光路设计中,应保证所有的透射光均应被探测器检测到,以增强测量的稳定性.
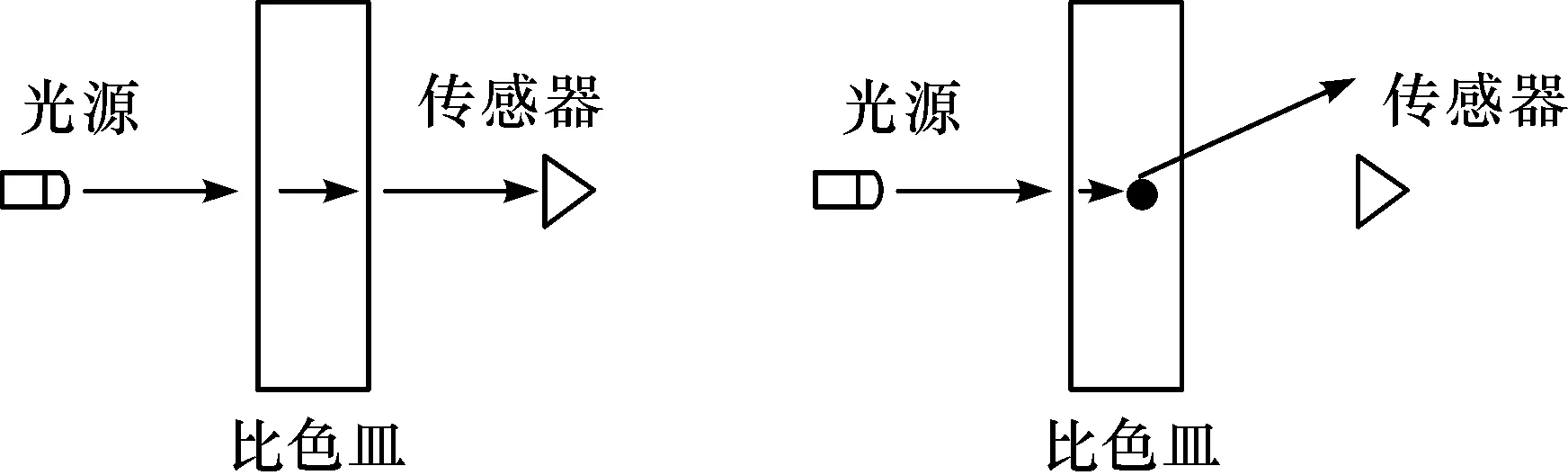
图3 分光光度法测量原理和散射现象Figure 3 Spectrophotometric measurement principle and scattering phenomenon
2 大肠菌群快速检测仪器设计
2.1 仪器光路结构的设计
为了增强测量稳定性,设计了基于双积分球结构的双光路测量光学结构,如图4.光路结构由光源、两个探测器和两个积分球构成.两个积分球的内表面均涂敷白色高反射漫反射涂料.光源发出来的光首先进入积分球A中,光线经过重复匀化后漫入射至比色皿,经过在比色皿中传输后从比色皿后表面出射,出射光在积分球B中进行匀化后,进入传感器.此外,为了保证测量结果不受光源波动影响,另外一个传感器B采用光纤对光源能量波动进行实时监测,取I=I1/I1,作为最终结果.
本设计中采用LED作为光源,以硅光电池作为检测元器件.从LED光源发出的可见光经积分球的匀光后照射到样品池中,样品的透射光在经过积分球匀光后会经过特定波长的滤光片,再由硅光电池收集透射光信号.这种光路结构保证了入射至比色皿表面的入射光是漫入射光,所有方向的出射光全部可以被传感器采集.这样就避免了由于大肠菌群在比色皿中分布不均匀对测量产生的影响.
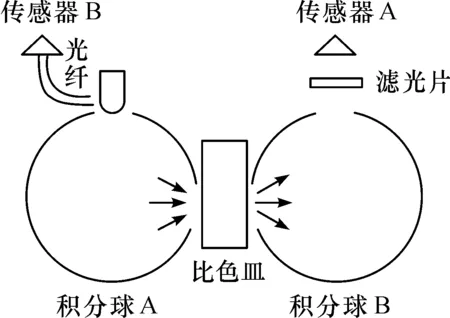
图4 双积分球光学测量结构Figure 4 Double-integrated sphereoptical measurement structure
2.2 测量波长选择实验
2.2.1 实验材料
大肠菌群菌株分离于生活污水,酶底物ONPG(邻硝基酚-β-D-半乳糖苷),ONPG培养基,琼脂培养基和乳糖发酵培养基.
2.2.2 制备菌悬液
将大肠菌群接种于琼脂培养基斜面上培养24 h,用接种环将菌体接种到0.9%生理盐水制成菌悬液,用0.9%生理盐水依次稀释,制备一系列浓度为10、102、103、104、105、106、107cfu/mL的大肠菌群样品溶液.
2.2.3 实验方法
将不同菌落数的大肠菌群样品溶液接种到ONPG培养基中,在37 ℃恒温培养下进行测试,每隔1 min测试一次溶液透过率,测试时长为5 h.使用波长范围为300~800 nm的分光光度计,每间隔1 nm对样品透过率进行测量.以460 nm,515 nm,525 nm,595 nm,625 nm的测量结果为例,如图5-9.

图5 波长460 nm下恒温37 ℃时8种不同菌落形成数的大肠菌群透过率随时间的变化曲线Figure 5 Curves of the transmissibility of coliforms in 8 different concentrations at a constant temperature of 37 ℃ at a wavelength of 460 nm over time

图6 波长515 nm下恒温37 ℃时8种不同菌落形成单位的大肠菌群透过率随时间的变化曲线Figure 6 Curves of the transmissibility of coliforms in 8 different concentrations at a constant temperature of 37 ℃ at a wavelength of 515 nm over time

图7 波长525 nm下恒温37 ℃时8种不同菌落形成单位的大肠菌群透过率随时间的变化曲线Figure 7 Curves of the transmissibility of coliforms in 8 different concentrations at a constant temperature of 37 ℃ at a wavelength of 525 nm over time
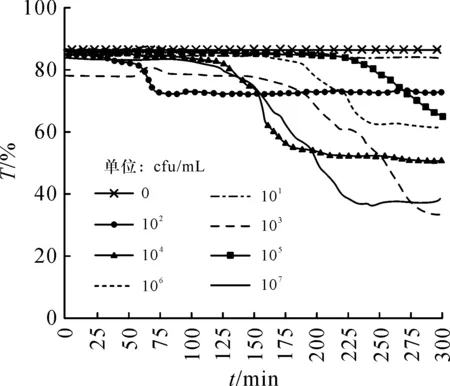
图8 波长595 nm下恒温37 ℃时8种不同菌落形成单位的大肠菌群透过率随时间的变化曲线Figure 8 Curves of the transmissibility of coliforms in 8 different concentrations at a constant temperature of 37 ℃ at a wavelength of 595 nm over time

图9 波长625 nm下恒温37 ℃时8种不同菌落形成单位的大肠菌群透过率随时间的变化曲线Figure 9 Curves of the transmissibility of coliforms in 8 different concentrations at a constant temperature of 37 ℃ at a wavelength of 625 nm over time
使用所有波长测量都难以对10 cfu/mL、102cfu/mL的大肠菌群样品溶液进行分辨,本测量方案的最低检出限应为102cfu/mL.
若不考虑10 cfu/mL、102cfu/mL的大肠菌群样品溶液检测数据,在波长625 nm下恒温37 ℃时8种不同菌落形成单位的大肠菌群透过率随时间的变化曲线中可以明显看出,样品菌落形成单位越大,透过率下降的越早,和理论分析相符.所以,可以采用波长625 nm作为分光光度测量波长.
3 大肠菌群生长时间模型的建立
基于生长时间光谱法的原理,需要建立大肠菌群的生长时间与大肠菌群的初始菌落数的数学模型.大肠菌群的生长时间通过样品透过率的变化进行测量,采用样品从实验开始时的初始透过率降低至初始透过率的70%时所需时间作为生长时间.
根据图9所示的波长625 nm下恒温37 ℃时8种不同菌落形成单位的大肠菌群透过率随时间的变化曲线,培养开始时的时刻为t0,同时记录此时样品透过率T0.开始每分钟对样品透过率进行一次测量,当测量透过率ΔT≤0.7×T0时,此时刻为t,取Δt=t-t0.具体数据如表1.

表1 大肠菌群初始菌落数与生长期时间的对应关系
生长时间t与大肠菌群特定菌落数Ct的关系可以描述为
Ct=C0×e-kΔt.
(1)
式(1)中C0为大肠菌群初始菌落数,Δt为指数生长期的时长即达到稳定时期的时间t与开始指数生长的时间t0的差值.
取对数表示关系式
lnC0=C0×e-kΔt.
(2)
对表1中的数据按照式(2)进行拟合,即可得到确定的大肠菌群初始菌落数与生长期时间的对应关系如式(3).从实验数据中可以发现,对大肠菌群100 cfu/mL的检测,只需要276 min的生长时间.
lnC0=17.68-0.048 37×Δt.
(3)
4 实验结果验证
4.1 多次测量平行样的相对标准偏差测试
制作102、103、104、105、106、107cfu/mL的大肠菌群样品溶液共6组,每组10个,通过实验测定每组溶液,每组结果的相对标准偏差如表2.

表2 不同浓度的相对标准偏差
4.2 实验结果与滤膜法测量结果的比对
选取20个水样,其中地表水10个,地下水10个,对每个水样同步采用本实验方案和滤膜法进行大肠菌群的检测.滤膜法的检测步骤参照《GB/T5750.12-2006生活饮用水标准检验方法微生物指标》中的要求[13].测量结果如图10,相关系数为0.979.

图10 滤膜法测量大肠菌群数目与本方案测量结果对比Figure 10 Comparison with the filter membrane method
5 结语
本文基于生长时间光谱法设计了大肠菌群快速检测仪器.采用分光光度法对大肠菌群的指数生长时间进行检测;通过实验确定了625 nm作为分光光度检测波长;设计采用了双积分球光路结构,提高了仪器对透过率的测量稳定性,采用样品从实验开始时的初始透过率降低至初始透过率的70%时所需时间作为生长时间,显著降低了检测所需时间,对大肠菌群100 cfu/mL的检测,只需要276 min.建立了大肠菌群的生长时间与大肠菌群的初始菌落数的数学模型.设计实验评价了本方案平行样相对标准偏差小于12.61%;与滤膜法进行比对,相关系数0.979.下一步工作计划把本方案应用于单增李斯特、沙门氏菌、志贺氏菌等其它检测应用中.

