结肠靶向给药系统机理研究进展
单安山,杨占一,何诗琪,李家维
(东北农业大学动物营养研究所,哈尔滨 150030)
结肠是机体重要消化器官,同时也是微生物菌群主要定植场所,结肠内容物中微生物含量可达109~1011个·g-1,占肠道微生态系统菌群总数85%~90%,微生物菌群在结肠构建庞大微生态系统外环境[1-3]。定植结肠的菌群通过分解难以被机体消化的大分子多糖发挥消化功能,结肠段微生物也对肠道及机体免疫功能调控发挥重要作用。Dodd等指出肠道菌群中C.芽孢杆菌可通过分解色氨酸合成重要中间产物吲哚丙酸(IPA),强化肠壁,增强肠内物质吸收[4]。Routy等通过敲除实验鼠PD-1受体,以肠道菌群为研究对象,发现实验鼠出现自身免疫性疾病[5]。近年,由于抗生素滥用等问题,结肠及肠道菌群研究受到关注,例如抗生素滥用导致相关性腹泻[6-8]、结肠炎症性肠道疾病(IBD)[9-11],艾滋病患者肠道菌群中含有较多大肠埃希氏菌和铜绿假胞杆菌,乳杆菌含量显著降低[12-13]。
目前口服药剂是治疗结肠疾病最常用给药方式,但传递多肽类药物,极易受消化道内胃酸或分泌蛋白酶降解而失活;同时药物到达结肠前被机体吸收进血液,难以提高病灶点药物浓度,治疗效果降低。因此口服药剂改进研究引起广泛关注。
1 口服结肠靶向给药系统优势和发展
为克服口服药剂治疗肠道疾病缺陷,一种新型口服药剂传递系统进入研究者视野——口服结肠靶向给药系统(Oral colon-specific target drug delivery system OCTDDS)。该系统主要通过药物修饰、包被等制剂学手段,避免药物口服后在胃肠道前段被直接吸收,在盲结部位裂解释药,达到局部治疗效果。作为第四代药物剂型,该系统可为多肽类口服药物提供技术支持,使肽类药物免受胃肠道内蛋白酶降解而失活[14-15],同时也通过提高靶向作用位点定向性提高靶向位点药物作用浓度,增强治疗效果,减少药物使用量和毒副作用。因此,该系统核心问题是靶向给药机理、选择药物载体和修饰载体材料。
目前在给药机理方面,该系统主要通过结肠段生理特点及定植在结肠部位的微生物释放酶实现靶向给药,如:①结肠pH 6.5~7.5,主要受食物结构和机体状况影响;②结肠段富含大量可分泌高分子材料降解酶微生物菌群;③结肠段蠕动速度慢,内容物在结肠滞留时间长;④结肠吸收大量水分,导致内容物固化,腔内压增大。根据这些生理特性,目前已提出pH依赖型、时间依赖型和压力控制型等基于结肠生理特性的传统型药物传递系统。另外,依据微生物菌群引发的被动靶向药物传递体系,例如依赖肠道微生物酶的酶触发型,前体药物型,酶降解聚合物包衣释药体系,以及将几种传递系统结合的复合型结肠靶向给药系统。在药物载体材料方面,选择敏感特异性强、释药过程稳定、无毒副作用的载体材料或载体材料化学修饰是目前该领域研究热点。
2 基于结肠生理特性的传统型药物传递系统
2.1 p H依赖型药物传递系统(p H-dependent OCTDDS,pHOCTDDS)
动物机体胃肠道pH由胃到小肠再到大肠不断升高,无食物消化期间,胃液pH 1~2,空肠、回肠部位pH约为6.5和7.5,至盲结肠段后,pH先降后升,结肠部位pH升至5.4,横结肠与降结肠部位pH由6.6升至7.0。依据胃肠道不同位段pH差异,李小芳等设计pHOCTDDS,针对目标药物分子结构,开展化学结构修饰或以pH敏感性材料对药物包被处理,酸性条件下控制药物在胃中及小肠中释放,在pH约7.0时,使载体材料与药物在结肠段发生化学键断裂或包被材料崩裂,释放药物,最终获得结肠靶向作用[16-17]。目前pHOCTDDS制备代表性药物见表1。
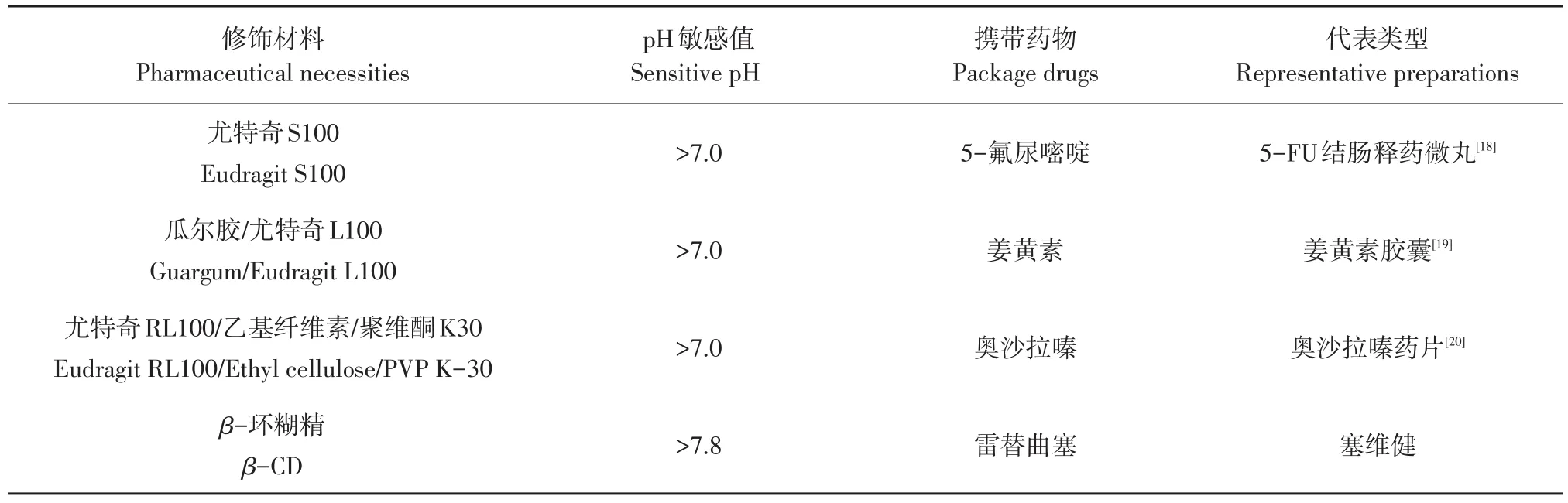
表1 p HOCTDDS主要类型和代表药物Table1 Main typeand representativedrug of p HOCTDDS
目前pH依赖性给药系统较常用载体材料为丙烯酸酯共聚物(Eudragit),这种共聚物可通过改变R基团获得不同pH敏感性[21]。例如pH依赖性肠包衣Eudragit S100基于纳米混悬液具有粒径小、表面积大特点,可有效提高药物通透性及药物溶出率。
程玲等将黄芩苷作为目标药物首先制成纳米混悬液,使用Eudragit S100对药物包被处理,pH>7时崩裂溶解,释放药物,为解决EudragitS100脆性和包衣膜玻璃化转变温度过高等问题,添加增塑剂TEC和滑石粉,减少纳米微粒之间黏结,发现在酸性条件人工胃液中2 h、小肠液中4 h后药物溶出率较低,而微碱性人工结肠液中,药物大量释放,证实其具有良好结肠靶向效果[22-23]。
人工合成聚合物类包衣材料影响机体免疫,多糖类物质对药物包衣制备应用广泛。Yang等使用藻酸盐和羧甲基壳聚糖制备一种在分子层面上具有网状互穿的水凝胶材料,pH=1.2时几乎无药物释放,当pH达到7.4时,药物释放量增加,使药物特异性作用于靶向位置[24]。那馨竹等将β-环糊精与雷替曲塞制作成片剂,药物安全通过胃和小肠段,最终在结肠处释放,与直接口服雷替曲塞药片相比,β-环糊精与雷替曲塞制片在结肠组织累计分布量提高6.3倍[25]。
近年,研究者通过先进仪器在分子层面对载体材料作形态改造,提高释药效果。为克服NaAlg水凝胶强度和稳定性差问题,吴称意等利用超声辅助通过自由基接枝聚合法制备pH敏感和多孔NaAlg-g-P(NVP-co-NHMAA)水凝胶,减少其在酸性环境中释放量(见图1)[26]。
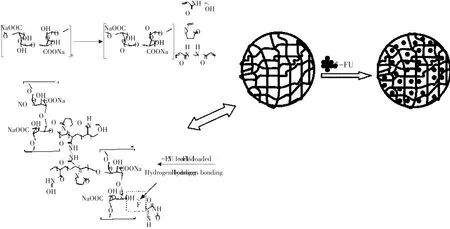
图1 NaAlg-g-p(NVP-co-NHMAA)负载5-FU制备和机理Fig.1 Synthesis schematic and 5-FU-loaded mechanism of NaAlg-g-p(NVP-co-NHMAA)
pHOCTDDS制备方法简单,成本低,易操作,但动物机体胃肠道出现病变或不良饮食结构均导致胃肠道pH波动,使包被药物pH依赖聚合材料提前崩裂,影响药物治疗效果,因此在临床使用中受限。
2.2 时间依赖型药物传递系统(Time-dependent OCTDDS,Td OCTDDS)
时间依赖型结肠靶向给药系统根据食物经口服后到达病灶段时间引导药物释放。一般情况下,胃排空时间15~180 min,而食糜在小肠中滞留时间3~4 h,时间依赖型时滞通常设定为5~6 h[27]。目前通常使用较难分解的难溶性包衣材料包被药物,控制包被材料比例和用量控制药物释放时间。
时间依赖型给药系统代表如表2所示,常用PEG6000和PEG4000包被目标药物。例如从植物中提取抗肿瘤药物冬凌草甲素,由于水溶性较差而限制临床应用。通过冬凌草甲素粉末压片,使用PEG6000和PEG4000难溶性材料制备冬凌草甲素滴丸,取一定乙基纤维素制备非渗透性囊体,最终达到结肠作用位点5~6 h释药时滞。
随着技术发展,对成熟时滞材料采取化学修饰,获得释药效果良好药物传递系统成为研究热点。例如将治疗溃疡性结肠炎的美沙拉嗪[28]以羟丙基纤维素和微晶纤维素包被,通过有机酸(酒石酸)诱导,依次包被隔离层、Eudragit-RS30D时滞层,制备有机酸诱导型TDCT,发现有机酸诱导型TDCT在常规时滞时间释药,具有特殊缓释作用效果,未经诱导包衣TDCT具有突释效果。
为寻找价格低廉、绿色环保载体材料,研究者日渐关注自然界广泛存在的多糖类物质。例如将羟乙酸钠和活性药物双氯芬酸纳制成药片内丸,使用传统Eudragit聚合物衍生物Eudragit RSPO外衣包被,获得时滞性药物载体系统。体外实验发现含有5%的Eudragit RSPO药物载体系统可保持5 h内不释药,时滞效果好[29]。
但该系统主要通过包被材料厚度控制药物释放,成本较高且机体间差异较大,摄入物在动物机体不同肠段滞留时间变化较大,药效及药物生物利用度受限。目前该系统主要通过与其他系统结合方式优化利用。
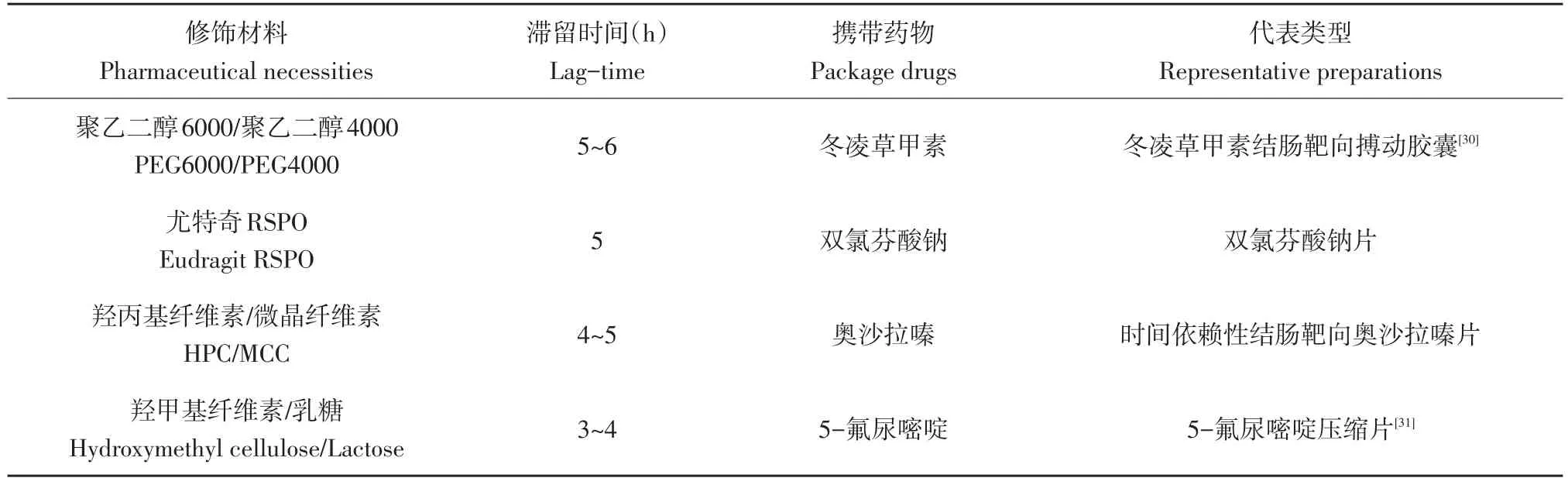
表2 Td OCTDDS主要类型和代表药物Table 2 Main type and representativedrug of Td OCTDDS
2.3 压力控制型药物传递系统(Pressure-controlled OCTDDS,PcOCTDDS)
压力控制释药系统利用结肠固化内容物特性及规律性蠕动产生的蠕动波,瞬时增加结肠段内压,使包被载体材料崩裂,释放药物。机体胃肠道内均有蠕动波,但小肠段内大量小肠液可有效缓冲腔内压,肠内容物所受腔内压降低。但结肠吸收大量液体,且内容物固化,结肠内产生腔内压增大,载体材料崩裂,药物释放,达到结肠靶向效果。
目前,针对压力控释型系统多采用不受pH及时间影响的高分子材料。以肠溶性包衣(PCDC)为例,小肠液缓冲使小肠腔内压不足,包衣无法破裂,到达结肠时,加之结肠固化效果,PCDC药物所受结肠腔内压增大,内容药物释放。胶囊技术目前较常用,例如崔京浩等使用压力控释系统-PCDC(压力控释胶囊)包被咖啡因,将目标药物溶解于水溶性或脂溶性基质中,例如聚乙二醇或者合成脂肪酸,将其用肠溶性胶囊包被,最外层使用不溶于水、缓释效果较好乙基纤维素(EC)包被[32]。通过控制乙基纤维素材料厚度,选择在结肠不同位段释药,在人工胃液2 h和人工肠液4 h,药物释放量低于25%,根据Tmax(5.67±1.21)h后和MRT(16.80±1.74)h结果证明咖啡因在结肠段释放并被吸收。
目前,压力结肠靶向给药系统材料通常与包衣技术-胶囊结合控制药物释放。结肠段内压生理机能研究仍处于起步阶段,具有较大发展空间。
3 微生物菌群引发的被动靶向药物传递体系
3.1 前体药物型药物传递系统(Prodrug OCTDDS,POCTDDS)
前体药物结肠靶向系统(Prodrug OCTDDS,POCTDDS)是指具有活性的药物成分与高分子载体材料通过化学键结合方式构成无活性前体型药物,高分子载体材料仅对结肠段某些细菌释放细菌酶具有敏感性,到达结肠特定菌群位置后,高分子载体材料被特异细菌酶降解并在预设位点释放活性成分,提高位点处药物浓度以提高药效[33]。POCTDDS代表药物制剂如表3所示。
前体药物结肠靶向给药系统目前较为常用的载体材料有偶氮类、糖苷类和葡聚糖类,其中偶氮类载体材料发展较为成熟。5-氨基水杨酸(5-ASA)可较好治疗结肠炎,Couto等使用磺胺吡啶作为载体材料,通过与5-ASA偶氮键修饰构成前体药物,作为结肠定点靶向药物,体外试验发现该前体药物在胃肠道中由于缺乏降解偶氮键活性酶,酶,药物无法释放,到达结肠段后,前体药物被结肠菌群释放的偶氮还原酶降解,偶氮键裂解生成氨基,氨基通过酯基键水解,最终释放可治疗结肠炎的活性5-ASA,获得药物靶向性[34]。因磺胺吡啶具有一定毒副作用,而丁酸盐因新陈代谢速率快、极低生物利用性且半衰期较短等优势被开发。将丁酸盐与5-ASA通过偶氮键相连,在合成过程中使用无毒甘油连接,作用方式见图2。据此消除前体药物型给药系统毒副作用,保持结肠靶向作用优势。另外,修饰具有生理功能的前体材料也成为一种新型研究方法,例如炎症性结肠炎起因为结肠粘液中黏蛋白易被食糜酸化,使结肠粘液受损,酸化位点主要针对黏蛋白的寡糖侧链。氨基糖类物质通过在结肠段保护黏蛋白结构并在结肠粘膜表面形成保护层抵抗酸化,改善结肠粘液韧性。霉酚酸(MPA)作为母体药物通过共价酰胺键和氨基糖类葡糖胺或葡糖胺聚糖作为载体材料连接构成前体药物系统,不仅提高药物亲水性,降低药物在上胃肠道(GIT)释放量,并且可以在结肠微生物群分泌特定酶(N-酰基酰胺酶)作用下释放MPA,氨基糖类前体物质释放保护结肠粘膜,优化IBD治疗效果。
目前,选择正确前体药物结肠给药系统(POCTDDS)药物载体材料是关键问题。因前体型给药系统成本过高、多数前体材料均具有一定毒副作用,临床应用受限。

表3 POOCTDDS主要类型和代表药物Table 3 Main type and representative drug of POOCTDDS
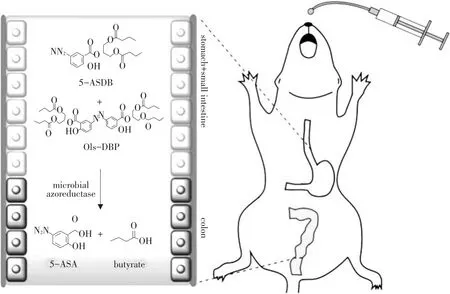
图2 前体药物5-ASDB在结肠的靶向性Fig.2 Prodrug 5-ASDB has colon-targeting properties and therapeutic in vivo
3.2 微生物酶触发型药物传递系统(Bacteria triggered ODTDDS,BtOCTDDS)
健康动物结肠部位存在大量微生物菌群,分泌降解高分子材料细菌酶,例如β-葡萄苷酸酶、β-葡萄苷酶、纤维素酶、硝基还原酶、偶氮还原酶、α-脱羟酶、胆固醇脱氢酶等[39]。以特异性细菌酶敏感的高分子材料作为药物载体,通过包衣或胶囊技术修饰药物,使药物在结肠中释放,具有生物相容性高,安全且无毒副作用,靶向性强优点,这种给药系统称为酶触发型结肠靶向给药系统(Bacteria triggered BtOCTDDS)。
Gauri等使用黄原胶和瓜尔胶包被甲硝锉,用0.1 mol·L-1盐酸、pH 7.4磷酸盐缓冲液模拟胃和小肠液,4%W/V盲肠内容物pH 6.8磷酸缓冲液模拟结肠液,分别作体外释药评价,发现前5 h在胃和小肠中释药量仅为12%~33%,到达结肠段,药物大量释放[40]。
与传统药物相比,承载蛋白、多肽类药物给药系统发展迅速。Wen等以牛血清白蛋白(BSA)模拟蛋白质药物模型,首先使用离子凝胶法制备由壳聚糖负载的纳米颗粒,以具有缓释效果藻酸盐为外壳层,再用同轴静电纺丝法制备同轴纳米颗粒,结果发现封装的BSA二级结构几乎无变化,在胃和小肠中无释放,回盲部75%BSA在模拟结肠液中被释放[41]。BtOCTDDS主要载体材料为偶氮类和多糖类高分子材料,多糖类载体材料主要为水溶性高分子聚合物(见表4)。
除使用多糖类高分子聚合物作为载体材料外,还可通过添加金属离子、多糖、脂质类等物质改造修饰载体材料。郭春静等以酮洛芬(KTF)为药物模型,果胶为载体材料,添加壳聚糖和卵磷脂构成复合混凝胶球,添加金属离子(Ca2+和Zn2+)研究载体材料改性[44],如图3所示。壳聚糖和卵磷脂添加可提高果胶载体包封率(由57.59%升至77.63%)。锌体系果胶系统在模拟小肠液(SIF)中释放量达10%,模拟结肠液(SCF)达到83.21%,证明添加金属离子可提高载体材料性能。
BtOCTDDS利用微生物菌群释放细菌酶降解多糖类载体材料的被动靶向机制,具有生物选择性高、无毒副作用等优点。利用酶触发型结肠靶向给药系统,关键在于正确选择载体高分子分子材料,包被材料通过其他高分子材料合理改造修饰,获得优质载体材料。目前使用其他分子材料修饰载体材料研究尚待深入。
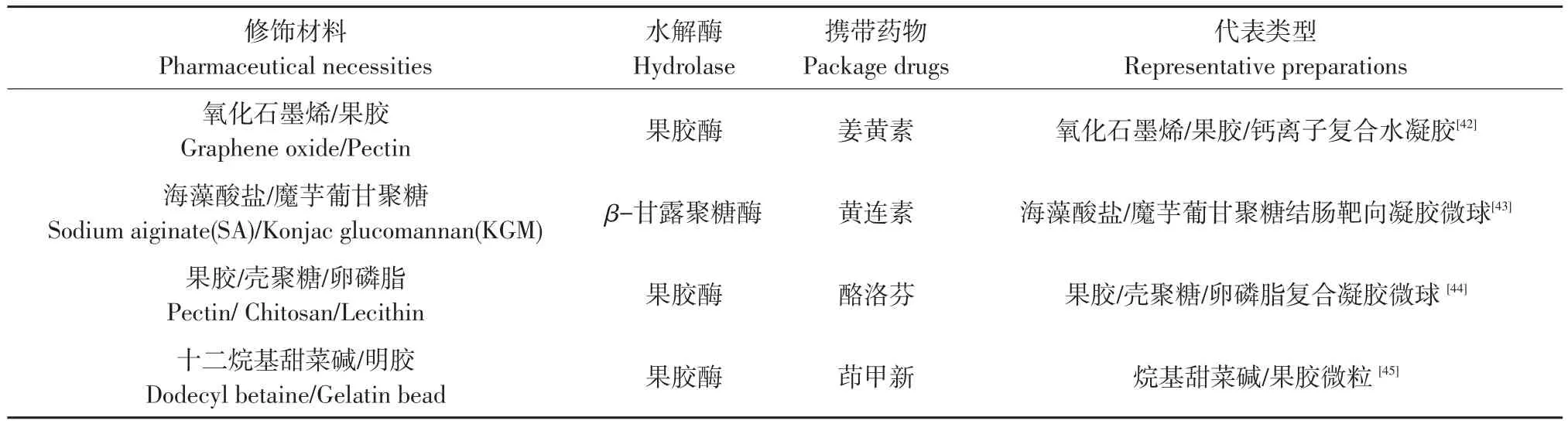
表4 BtOCTDDS主要类型和代表药物Table 4 Main type and representativedrug of BtOCTDDS

图3 果胶钙凝胶球(左)与果胶锌凝胶球(右)扫描电镜Fig.3 SEM of calcium pectin(left)and zinc pectin gel balls(right)
4 综合型结肠靶向给药系统(complex OCTDDS,COCTDDS)
综合型结肠靶向给药系统是指通过两种或以上结肠靶向作用机理组合构建的结肠靶向给药系统。单因素给药系统存在一定弊端,如pH-依赖型受动物机体生理状态及食物种类影响;时控型靶向系统受动物机体间个体性差异影响;前体靶向给药系统修饰目标药物,易受外界因素干扰。为增强药物传递系统精准性及释药稳定性,多种口服结肠靶向系统结合方式成为目前研究热点。COCTDDS主要试剂如表5所示。

表5 COCTDDS主要类型和代表药物Table 5 Main typeand representative drug of COCTDDS
COCTDDS主要为pH和时滞依赖型结肠靶向给药系统、pH-菌群/酶触发型结肠靶向给药系统以及pH依赖/生物粘附型结肠给药系统。倪文娟等依据pH和时间依赖型结肠靶向给药系统,采用离心造粒包衣技术包被姜黄素,使用EC(时滞型内层)和Eudragit FS30D(基于pH外层)包衣[46]。延时型内层涂层液由3.0%EC,0.6%邻苯二甲酸二乙酯和25%乙醇溶液组成,控制涂层重量为2.0%;pH为基础外层包衣液由Eudragit FS30D,40%滑石粉和3.0%柠檬酸三乙酯组成,控制涂层重量为4.0%。结果显示,人造胃液中药丸累积释放率均小于15%,人造肠液中5 h内累计释放率达85%以上,具有明显结肠靶向特征。
此外,材料改进修饰也是提高靶向效果手段之一,例如Akhgari等通过同轴静电纺丝法将Eudragit S与Eudragit RS以纳米纤维材料形式包被消炎痛药物,纳米纤维材料具有多孔性且体表面积占比大优点,增强药物释放效果[47]。另外,以乳酸羟基乙酸共聚物(PLGA)和pH敏感材料甲基丙烯酸共聚物为载体材料,对载体材料纳米修饰,利用结肠炎小鼠模型分析布地奈德纳米球治疗效果及释药效果,发现药物在小鼠结肠病变组织区域富集,证明布地奈德纳米球在体内试验中结肠靶向效果良好[48]。
在pH-酶触发型结肠靶向给药系统研究中,张建平等采用葡聚糖为基质材料,利用接枝聚合及反相乳化交联技术制备交联微球C(Dex-g-PSSS)[49-50]。这种具有酶和pH双重控制的胶联微球,在pH=2条件下,由于强静电作用,对测试药物5-氟尿嘧啶具有极强吸附力,几乎不释药,而在具有葡聚糖酶小肠液中pH 7.2条件下,药物在结肠区域突释。另外,pH依赖型材料Eudragit和多糖类微生物酶触发材料壳聚糖也被开发利用。如党云洁等使用由酶触发的壳聚糖包被吲哚美辛制成固体纳米粒,并用Eudragit树脂作为pH依赖的肠溶材料制备双层包衣迷你片,最终通过动物实验活体荧光成像技术,证明该系统可以靶向作用于结肠[51]。
综上,综合型结肠靶向系统具有多因素调控机制,可提高结肠药物靶向效果和精准性。该方法成为目前最具研究价值给药方法,通过把控材料包衣层厚度并利用多种敏感材料多方位保护药物,提高口服结肠靶向给药系统的作用准确性,弱化机体的个体差异影响。
4 小 结
近年,口服结肠靶向给药成为解决肠道菌群紊乱问题突破口。OCTDDS系统保证传统药物在结肠定点释放,提高病灶位点药物浓度,降低药物毒副作用,也为多肽、蛋白质类药物提供保护,使其免遭胃肠道蛋白酶降解,避免注射治疗给动物带来痛苦。OCTDDS系统依然存在诸多不足,pHOCTDDS以及TdOCTDDS在临床使用中,个体差异及机体健康状态不同会导致药物提前或滞后释放。载体材料安全性有待提高,POOCTDDS在释药后前体材料释放的配体有轻微毒副作用。BtOCTDDS和PcOCTDDS虽采用多糖类高分子材料,较为安全,无毒副性,但高分子材料选择和药物配比存在较多问题。COCTDDS通过不同的子系统联合使用,弥补不同给药系统不足并降低内外环境干扰,但工艺技术尚待完善。
总之,OCTDDS系统性研究将为治疗肠道菌群微生态紊乱、肠道炎症以及结肠定点释放药物研究提供更为有效药物传递方式。同时,为生物分子材料研发提供动力,为靶向传递系统研究提供新设计方法。

