基于脑功能核磁的抑郁症肝郁脾虚证大鼠中枢分子生物学基础研究
李君玲 马雪玲 李玉波 夏 恺 王 田 薛晓兴 赵慧辉 王 伟
(1 首都医科大学中医药学院,北京,100069; 2 北京中医药大学,北京,100029; 3 中国中医科学院中医基础理论研究所,北京,100700)
抑郁症是以情绪低落、思维迟缓、意志活动减退为主要特征的综合征[1]。根据世界卫生组织(World Health Organization,WHO)公布的资料显示,抑郁症是全球范围内引起致残率的第3大疾病,并将于2030年成为最大疾病负担源[2]。然而,目前临床中仅有<50%的患者对现代的一线抗抑郁药有良性反应,<30%的患者能够得到痊愈[3]。因此,寻找更多有效的治疗手段已成为目前的研究热点。中医学是祖国传统文化的宝库,从中医学中挖掘抑郁症的解决方法越来越受到学者们的关注。然而,中医临床治疗的核心是辨证论治[4],证候是中医治疗的基础和前提,因此研究中医对抑郁症证候认识的生物学基础是从中医学中寻找抑郁症解决办法的根本途径。肝郁脾虚证是中医临床治疗抑郁症的常见证型,中医临床治疗肝郁脾虚型抑郁症往往疗效显著[5-7],因此运用现代手段研究肝郁脾虚型抑郁症的生物学基础是从中医学中寻找治疗抑郁症的重要途径之一。
单胺类神经递质是目前研究抑郁证发病机制较为常用的指标,然而,对于抑郁症肝郁脾虚证的中枢生物学基础,究竟选择哪些脑区进行研究更有针对性,一直是研究者们所争论和探讨的。磁共振功能成像(Functional Magnetic Resonance Imaging,fMRI),是一种新型的、无创的、并且可动态进行检测的技术,可以记录静息态大鼠的脑部功能,从全脑范围内寻找模型动物的异常脑区,从而为系统的探索疾病发病相关的脑区提供了一种影像学方法。因此本研究首先利用fMRI的方法对肝郁脾虚型抑郁症大鼠的异常脑区进行探索,在功能核磁所探索的基础上对密切相关脑区进行单胺类神经递质检测,从而对肝郁脾虚型抑郁证的关键中枢分子生物学基础进行探索。
1 材料与方法
1.1 材料
1.1.1 动物 SPF级6周龄雄性SD大鼠110只,适应性喂养一周,据体重平均分为2组:正常组21只,慢性不可预知温和应激(Chronic Unpredictable Mild Stress,CUMS)组(CUMS组)89只。正常组4~5只/笼饲养,CUMS组单笼饲养并予以应激。6周后,对模型大鼠进行病证模型评价及筛选(根据病证模型判定方法,最终为54只符合标准)。将筛选的大鼠根据行为学测试结果平均分为3组:1)M(模型)组:22只;2)S(四逆散)组:14只;3)F(氟西汀)组:18只;Z(正常)组大鼠不变:21只。
1.1.2 动物造模与模型筛选 采用CUMS的方法进行造模,具体的应激方法如下:禁水24 h,禁食24 h,鼠笼倾斜(45°)12 h,潮湿垫料8 h,冷水(4 ℃)游泳5 min,束缚2.5 h,2笼合并12 h,照明24 h,夹尾1.5 min,36 V电压电击1 min,间隔30 s共45 min/次。每日的应激方式由2种不同应激方法组成,1周内不允许连续使用同一种应激方式,应激共持续8周。
1.1.3 模型判定 前期实验发现,SD雄性大鼠CUMS刺激6~8周呈现稳定的肝郁脾虚型抑郁症[8],因此本研究在第6周,采用将肝郁脾虚型抑郁症证临床症状判定标准等效转化为大鼠宏观表征的方式,采用行为学实验中的糖水偏好实验和体重测定及宏观表征观察相结合的方法,对大鼠进行抑郁症(病)、肝郁脾虚证(证)的判别及筛选,具体转换方式为:1)临床中抑郁症患者出现的情绪抑郁转换为动物的糖水偏好实验中的糖水偏好度减低与旷场实验中的自主活动度(如穿格总距离和直立次数)降低;2)临床患者的两胁胀痛转换为大鼠的抓取反抗激烈的表现;3)临床中患者的食欲降低转换为大鼠的体重增长缓慢;4)临床中的大便稀溏转换为大鼠的大便稀软不成形;5)临床出现的肠鸣矢气症状转换为大鼠的拉尾排便次数增多。经测试后,大鼠中同时具有前4项症状的3项(其中前2项症状必须具备)或者具有前2项症状加第5项症状即可判断为肝郁脾虚型抑郁症大鼠。
1.2 方法
1.2.1 脑功能核磁数据采集 在应激8周后,从正常组和模型组中随机抽取6只进行核磁检验。采用7.0T小动物功能核磁仪(Bruker,德国)进行大鼠全脑扫描。使用5%异氟烷将大鼠麻醉后,置于扫描台,借助麻醉面罩通以持续1~1.5%异氟烷(维持呼吸频率:40~50次/min)并加头部固定装置固定头部,以确保大鼠检测过程不会挣扎。具体扫描步骤与相关参数如下:1)扫面T2加权像,设置参数如下:视野3.3 cm×3.3 cm,重复时间4 380 ms,回波时间45 ms,矩阵256×256,层数30层。2)扫面静息态BOLD,设置参数如下:视野2.5 cm×2.0 cm,重复时间3 280 ms,层数20层,层厚/间隙1.0 mm/0.2 mm,回波时间27.6 ms,转角90°,矩阵128×128。
1.2.2 给药方案 在北京康仁堂制备经典方剂组成的四逆散免煎颗粒备用,参照临床用量向动物给药剂量的转换系数(6.25倍)[8-9],以2.5 g/(kg·d)用量对S组大鼠进行灌胃。氟西汀为礼来公司的20 mg胶囊,以2 mg/kg/日用量对F组大鼠进行灌胃。M组与Z组大鼠以1 mL/100 g剂量灌胃蒸馏水。每日应激前30 min进行灌胃。持续给药2周,给药过程中应激不停止。
1.2.3 单胺类神经递质检测 8周后,大鼠断头,迅速剥离下丘脑储存于-80 ℃冰箱中备测。各组随机选取7只大鼠的下丘脑标本进行高效液相单胺类神经递质检测,具体步骤如下:1)蛋白沉淀剂的配制:0.1 mol/L高氯酸溶液(含有0.3 mMEDTA-2Na和0.5 mMolNa2SO3);2)标准品溶液的配制:用配制好的蛋白沉淀剂分别溶解DA、DOPAC、NE、5-HT、5-HIAA、HVA等标准品,使其浓度均为100 μg/mL;3)样品的处理:从-80 ℃冰箱中迅速取出冻存的样品,称重后,加入3倍重量体积的蛋白沉淀剂,采用超声细胞粉碎机对组织进行匀浆(冰上进行以防温度过高),静置10 min,12 000 r/min的速度进行离心10 min,吸取上清液后,相同条件再次离心,吸取20 μL上清液进样检测;4)上机检测的各项条件:Alliance2695型号高效液相色谱仪。ECD2465型号电化学检测器:玻碳工作电极和Ag/AgCl参比电极,+0.75V检测电压。色谱柱:Atlantis C18,2.1×150 mm,3 μm。35 ℃柱温,流动相:50 mM柠檬酸-乙酸钠(内含1 mM B8离子对试剂,4%CH3OH,1.8 mMC8H19N,0.3 mM Na2EDTA,pH为3.5。),流速为0.35毫升/分。5)样品检测:每一次样品测试前将混标进样进行质控。分别配制0.001、0.005、0.01、0.02、0.05、0.1、0.2、0.5、1、1.5、2 ppm11个不同浓度,均以20 μL的量进样,并记录不同浓度下的色谱峰面积。以混标溶液的浓度作X轴,所测出的色谱峰面积作Y轴,建立浓度-峰面积标准曲线,通过该标准曲线,计算每个检测样品的浓度。
1.3 统计学方法
1.3.1 理化指标数据分析 采用SPSS 17.0(Chicago,IL,USA)软件对数据进行统计学分析分析。Shapiro-Wilk检验来检测实验数据是否符合正态分布。根据正态检验及方差分析结果,分别采用单因素方差分析(各组符合正态分布且方差齐)、2组独立样本非参数检验(各组均不符合正态分布)、Tamhane检验或非参数检验(符合正态分布但不具备方差齐性)的方法对各组进行两两比较。
1.3.2 核磁数据分析 核磁数据委托中国中医科学院高能物理研究所利用SPM8软件进行全脑的ALFF和Reho的指标分析,具体步骤如下:1)转换数据,筛选可以分析的高质量图像。2)校正时间片:将中间层作为标准,对所有受试个体的所有volume,对其余层的时间信息进行校正。3)头动校正:对所有受试体,将其第一幅图像作参考标准进行空间校正,生成校正后的以及150副校正后图像的平均图像。4)空间标准化:将第3步所成的平均图像作为源图像,确定图像的配准参数,并将该参数应用于第3步所生成的150副图像上。5)高斯平滑:利用高斯平滑核[半高宽为(3 6 3)mm]对空间标准化的图像进行平滑,以使所有数据符合正态分布。6)去线性漂移、带通滤波:机器噪声等线性影响利用线性回归的方法进行去除。带通频段滤波(0.01~0.08 Hz)来减小低频或高频漂移。7)ALFF测定:对滤波后的数据进行低频振荡幅度值的计算。8)ReHo测定:肯德尔和谐系数被用来计算包含27个体素在内的每个团块的时间序列变化的一致性。9)统计分析:对预处理后的所有图像进行基于广义线性模型的随机效应分析,包括ALFF、ReHo。对于正常组和模型组的预处理后的数据,利用SPM8软件进行双样本t检验的统计分析。10)ALFF与Reho结果显示:个体的体素阈值P<0.001(未校正)、体簇大小>54个体素,认为是具有统计学差异的激活脑区,最后得出正常组和模型组之间的统计参数图。
2 结果
2.1 脑静息态BOLD 应激8周后,模型组较正常组的Reho和ALFF信号均呈现减弱现象,其中在海马、下丘脑、中脑被盖部、嗅皮层、梨状皮层、脑桥的6个脑区Reho信号均减弱。在小脑、下丘脑、脑桥3个脑区ALFF信号均减弱。见图1。
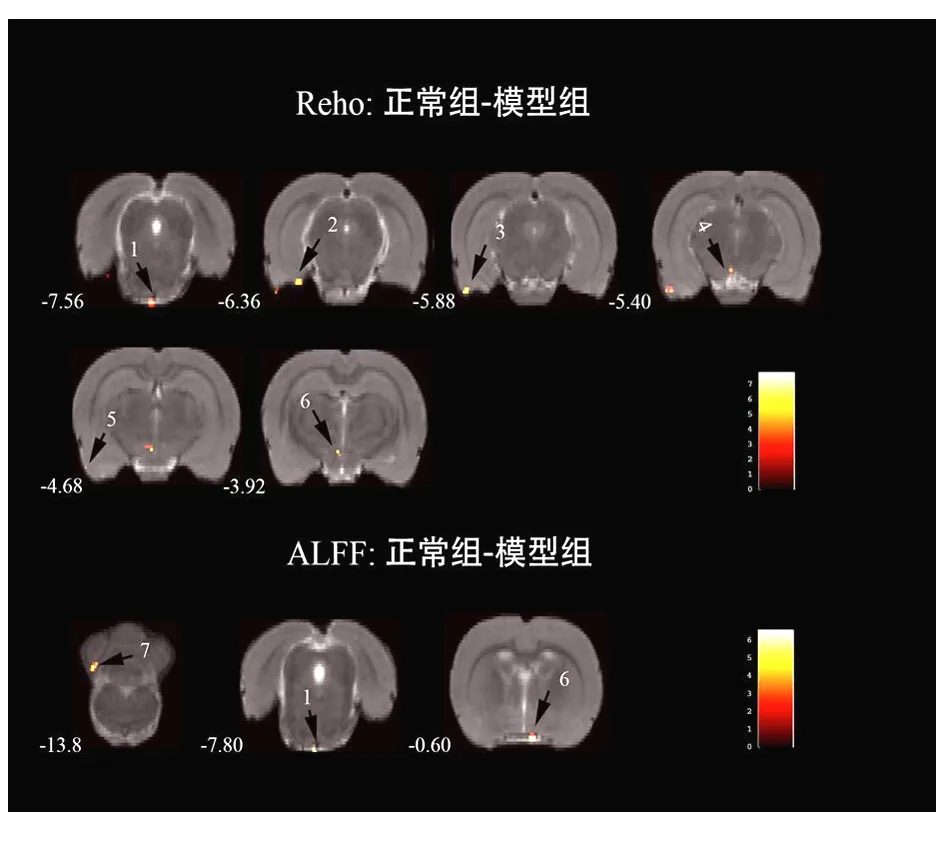
图1 正常大鼠与肝郁脾虚型抑郁症大鼠Reho和ALFF的统计参数图
注:每幅图的左侧底部数字代表Paxinos&Watson所著的2005版大鼠脑立体定位图谱中的z坐标值。右侧底部的色阶代表2组比较的t值大小(颜色越亮,代表t值越大)。每幅脑图上的激活点为具有统计学意义的脑区(AlphaSim以校正全部团块内体素,P<0.001,团块大小>50 voxels),激活点分别代表的脑区为:1.脑桥;2.海马;3.嗅皮层;4.中脑被盖部;5.梨状皮层;6.下丘脑;7.小脑
2.2 下丘脑神经递质 根据功能核磁分析的结果,我们发现肝郁脾虚型抑郁症大鼠下丘脑在Reho和ALFF2个指标中均存在明显的改变,因此我们进一步对下丘脑的神经递质进行了检测。DA:模型组较正常组下丘脑DA含量显著降低,氟西汀组与正常组和模型组比较,均有显著升高;四逆散组与模型组比较有改善趋势,但差异无统计学意义,与正常组间比较,差异无统计学意义(P>0.05);DOPAC、HVA:下丘脑DOPAC、HVA含量各组之间差异无统计学意义;5-HT:模型组与正常组比较,下丘脑5-HT含量显著降低,四逆散组和氟西汀组较模型组比较,含量显著升高;5-HIAA:模型组和氟西汀组与正常组比较,下丘脑5-HIAA含量显著降低,其余各组之间差异无统计学意义;NE:模型组与正常组比较,下丘脑NE含量显著降低,四逆散与氟西汀组较模型组比较有升高趋势,但差异无统计学意义。见图2~7。

图2 各组DA含量比较结果
注:与正常组比较,*P≤0.05;与模型组比较,△P≤0.05
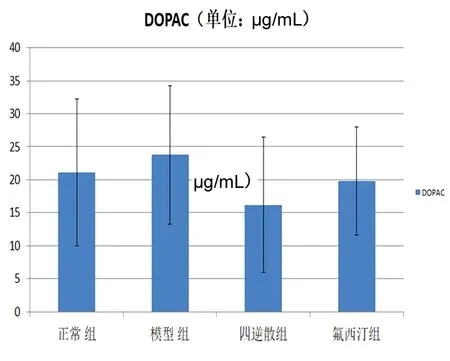
图3 各组DOPAC含量比较结果
注:与正常组比较,*P≤0.05;与模型组比较,△P≤0.05
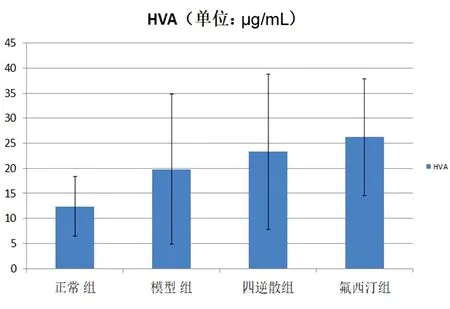
图4 各组HVA含量比较结果
注:与正常组比较*P≤0.05;与模型组比较,△P≤0.05

图5 各组5-HT含量比较结果
注:与正常组比较*P≤0.05;与模型组比较,△P≤0.05

图6 各组5-HIAA含量比较结果
注:与正常组比较,*P≤0.05;与模型组比较,△P≤0.05
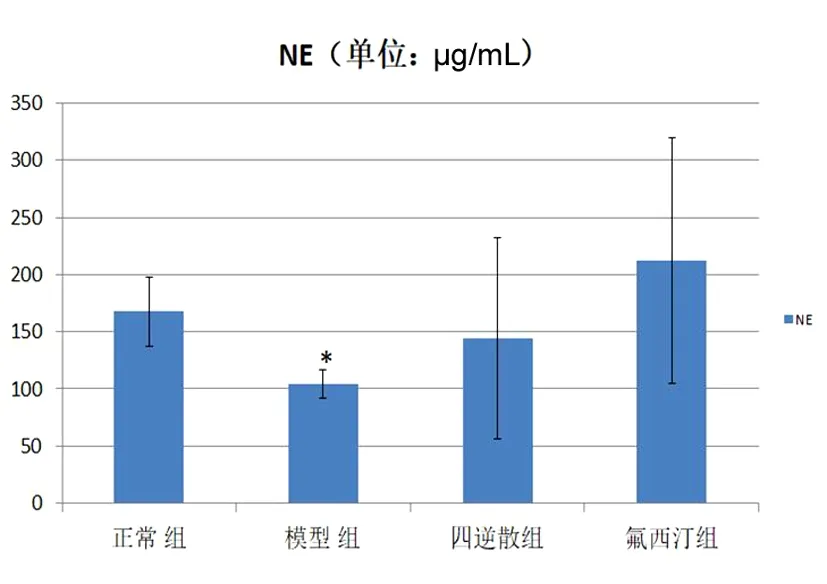
图7 各组NE含量比较结果
注:与正常组比较,*P≤0.05;与模型组比较,△P≤0.05
3 讨论
肝郁脾虚证是抑郁症疾病中的常见证型,本研究参照前期实验研究中大鼠抑郁症肝郁脾虚证的造模、评价方法及所确定的稳定时间窗[9],在慢性应激第8周,首先利用磁共振功能成像的方法,对肝郁脾虚型抑郁症大鼠的相关异常脑区进行了筛选,并基于脑功能核磁的结果,利用高效液相的方法,对所检测到的密切相关脑区——下丘脑进行了单胺类神经递质的检测,同时利用疏肝祖方——四逆散进行方剂反证,确定了与肝郁脾虚型抑郁症大鼠密切相关的中枢分子生物学基础为下丘脑5-HT、5-HIAA、NE和DA。
研究表明,静息态功能磁共振成像(Resting-state Functional Magnetic Resonance Imaging,r-fMRI)是研究机体自发或者固有神经脑活动的影像方法[10],由于这种方法不需要给予检测者各种任务、检测灵敏,方法可靠[5],因此也是目前研究鼠类或其他需麻醉的动物的脑功能的常用方法[10-12]。低频震荡(Amplitude of the Low-frequency Fluctuations,ALFF)和局部一致性(Regional Homogeneity,ReHo)是探索静息态全脑神经元振幅和局部一致性异常脑区的2种方法[13-14]。本研究采用2种方法相结合的方法,检测到与抑郁症肝郁脾虚证大鼠相关的脑区包含海马、下丘脑、中脑被盖部、嗅皮层、梨状皮层、脑桥、小脑,其中在使用ALFF和Reho这2种分析方法时,均检测到下丘脑和脑桥的异常神经活动改变。脑桥在抑郁症的研究中并不多见,目前公认的功能多为调节呼吸和肌肉运动。然而目前也有临床研究发现抑郁症患者出现脑桥的Reho信号改变,与本研究的结果一致[15]。下丘脑-垂体-肾上腺轴的改变是历来被公认的抑郁症发病的机制之一[16-17],同时下丘脑是调节机体稳态的重要中枢脑区,在调节机体的代谢、水平衡、饥饿感、生殖、节律及情绪反应中都起到重要作用,是大脑皮质下调节内脏活动的高级中枢[18],本实验的核磁结果显示肝郁脾虚型抑郁症大鼠的下丘脑ALFF和Reho均存在异常改变,符合肝郁脾虚型抑郁症大鼠情绪抑郁与消化道症状并存的状态。因此我们将下丘脑作为研究肝郁脾虚型抑郁症大鼠中枢分子生物学基础的重点观察脑区。
在此基础上,本研究利用高效液相色谱法方法对肝郁脾虚型抑郁症模型的下丘脑的单胺类神经递质5-HT、DA、NE及其代谢产物5-HIAA、DOPAC进行了检测,并且观察了疏肝祖方——四逆散对下丘脑单胺类神经递质的疗效,从而从模型和方剂反证的角度证明下丘脑5-HT、5-HIAA、NE和DA是肝郁脾虚型抑郁症的重要分子生物学基础,也是疏肝祖方四逆散发挥抗抑郁效应的机制之一。5-HT是一种重要的由脑干中缝核中的5-HT能神经元合成的神经递质,5-HT功能活动的降低是抑郁症患者出现抑郁心态、性功能减弱、食欲下降、内分泌紊乱等症状的重要原因之一,也是目前抗抑郁药物发挥抗抑郁疗效的重要靶标之一[19]。NE是一种与睡眠和觉醒调节、学习和记忆、选择性注意、应激反应以及奖赏系统等有关的中枢神经递质。目前学者们普遍认为中枢5-HT、NE缺乏能引起抑郁,而升高5-HT、NE可以有效改善抑郁状态[20],本研究中肝郁脾虚型抑郁症模型大鼠出现5-HT、NE水平都降低的现象可能是与肝郁脾虚证的抑郁状态有关,而四逆散对5-HT水平的改善较为显著,对NE水平的改善不甚显著,说明下丘脑5-HT的水平下降可能与肝郁脾虚证出现的脾虚症状更为密切;中枢多巴胺系统是体内重要的神经递质系统,中枢DA含量变化对情绪以及行为的调节均起重要的作用,然而,目前实验研究中对于抑郁症不同脑区DA含量的变化,结论不一[21],本研究结果显示肝郁脾虚型抑郁症大鼠下丘脑DA水平呈减少状态。
总之,本研究利用先进的功能核磁影像学方法,通过2种核磁分析方法,对全脑脑区进行探查,筛选出与肝郁脾虚型抑郁症最为密切相关的脑区,在确定脑区的基础上,对其单胺类神经递质进行检测,并采用疏肝方剂进行方剂反证,较为严谨的对肝郁脾虚型抑郁症中枢的分子生物学基础进行了初步探索和研究,也为研究中医中的疏肝疗法治疗抑郁症的分子生物学机制提供了线索,值得注意的是,由于研究时间有限,本研究仅对ALFF和Reho这2种方法均探测到的脑区—下丘脑进行了分子生物学的检测,对于2种方法检测到的其他脑区未来如海马、中脑被盖部、嗅皮层、梨状皮层、脑桥、小脑等尤其是脑桥未进行分子生物学的检测,未来应完善这些脑区的分子生物学检测,以达到更为系统全面的探究肝郁脾虚型抑郁症生物学基础的目的。同时由于本研究的研究对象——肝郁脾虚型抑郁症模型,其抑郁状态较为严重,因此,仅仅两周的四逆散治疗,其抗抑郁疗效不太显著,因此,在以后的研究中,若对四逆散的抗抑郁机制进行研究,其治疗时间可能需要适量延长。
(2018-04-20收稿 责任编辑:张文婷)

