瘤胃保护性5-羟基色氨酸对绵羊胃肠道内容物和血浆中5-羟基色氨酸、褪黑素含量的影响
赵 芳 陈 晖 王 根 高 超 赵国栋 马 晨 杨开伦
(新疆农业大学动物科学学院,新疆肉乳用草食动物营养重点实验室,乌鲁木齐830052)
褪黑素(melatonin,MT)除了可以在松果体中合成,肠道组织中也可合成大量的褪黑素[1],且肠道组织中的褪黑素含量是松果体的400~500倍[2]。肠道组织中的褪黑素来自肠黏膜中的嗜铬细胞[3],肠黏膜中合成的褪黑素可分泌至肠道内容物中[4]。肠道中褪黑素含量的分布存在明显的种属差异。猪胃肠道内容物中褪黑素含量变化趋势为:结肠>盲肠>回肠>空肠>胃;而牛胃肠道内容物中褪黑素含量变化趋势为:回肠、结肠、盲肠>瘤胃、网胃、瓣胃、皱胃>空肠[5]。大鼠直肠内容物中褪黑素含量较高,但在胃、十二指肠、空肠、回肠、结肠内容物中褪黑素含量较低[6]。猪在禁食30 h后进行饲喂,除直肠外,各肠段组织、肠黏膜、内容物中褪黑素含量均明显升高,且内容物中褪黑素含量均在进食后5 h达峰值[5]。因此,禁食与采食、摄入褪黑素或褪黑素的前体物质等均能影响动物肠道组织或肠道内容物中褪黑素的含量[7]。
肠黏膜中由色氨酸为前体物质合成并分泌到肠道内容物中的褪黑素在动物肠道运动调节和组织健康维护中具有重要作用[2],其中5-羟基色氨酸(5-hydroxytryptophan,5-HTP)是色氨酸代谢为褪黑素过程中重要的中间产物之一,5-羟基色氨酸在芳香族氨基酸脱羧酶、5-羟色胺N-乙酰转移酶、羟基吲哚氧位甲基转移酶的催化下,转化为褪黑素。褪黑素及其前体物质如5-羟色胺(5-hydroxytryptamine,5-HT)、5-羟基色氨酸等在绵羊肠道内容物中的含量分布特点尚未见有研究报道,因此,本试验一方面研究褪黑素及其前体物质如5-羟色胺、5-羟基色氨酸等在绵羊肠道内容物中的含量分布特点,另一方面研究补喂褪黑素前体物质——瘤胃保护性5-羟基色氨酸对绵羊肠道内容物中褪黑素及其前体物质如5-羟色胺、5-羟基色氨酸等含量的影响,为进一步认识褪黑素在绵羊等反刍动物肠道运动调节和组织健康维护中的作用提供科学理论依据。
1 材料与方法
1.1 试验时间与地点
本试验于2017年8月1至2017年8月16日在新疆惠康畜牧生物科技有限公司羊场进行,采集血样当天日出时间为06:08,日落时间为22:04。
1.2 试验材料
5-羟基色氨酸购自武汉远成共创科技有限公司,纯度为98%;瘤胃保护性5-羟基色氨酸是以5-羟基色氨酸为原料,由北京亚禾营养高新技术有限责任公司加工制成,其中5-羟基色氨酸有效含量为45.00%,过瘤胃率为88.60%。瘤胃保护性5-羟基色氨酸过瘤胃率的测定过程为:准确称取10 g制成的瘤胃保护性5-羟基色氨酸于带玻璃塞的锥形瓶中,加入100 mL蒸馏水,放入37 ℃、50 r/min的水浴摇床中,预孵4 h后取出锥形瓶,过滤后得5-羟基色氨酸溶液。使用高效液相色谱仪测定滤液中5-羟基色氨酸含量。
瘤胃保护性5-羟基色氨酸的过瘤胃率(%)=[(瘤胃保护性5-羟基色氨酸中5-羟基色氨酸含量-溶液中5-羟基色氨酸含量)/瘤胃保护性5-羟基色氨酸中5-羟基色氨酸含量]×100。
1.3 试验设计
试验选取健康、平均体重为(47.79±3.70) kg的3岁哈萨克母羊15只,按体重分为3组,每组5只,分别为对照组和试验Ⅰ、Ⅱ组。所有羊只饲喂同一营养水平的粉状精料(购自新疆天康畜牧生物技术股份有限公司),每天每只羊的粉状精料饲喂量为体重的1.2%,玉米青贮饲喂量为0.9 kg,混合干草(苜蓿∶麦秸≈1∶1)自由采食,在此基础上,试验Ⅰ、Ⅱ组羊只分别饲喂111、222 mg/kg BW的瘤胃保护性5-羟基色氨酸,饲喂量参考Namboodiri等[8]的研究结果。试验过程中使用的粉状精料组成及营养水平见表1,玉米青贮、苜蓿、麦秸的营养水平见表2。
1.4 饲养管理
试验期间,将每天每只羊的粉状精料和青贮、瘤胃保护性5-羟基色氨酸平均分为2份,分别于07:45、19:45饲喂,饲喂时将瘤胃保护性5-羟基色氨酸与50 g粉状精料混合后饲喂,待绵羊摄入完毕后再饲喂其他粉状精料和玉米青贮。饲喂粉状精料、玉米青贮时为单栏饲养,采食完毕后羊只在运动场中自由活动。
1.5 样品的采集与处理
于试验的第16天,早上采食后6 h进行颈静脉采血,制备血浆。血液采集后立即对绵羊宰杀,放血2 min后,将羊只放入手术台上,腹部向上,使用手术刀、剪刀沿腹线将羊只腹腔打开,使用线绳在瘤胃、十二指肠、空肠、回肠、结肠、盲肠的肠结处结扎,剪断结扎处后,立即将肠道内容物捋至干净的塑料烧杯中,混匀后分装至冻存管中(瘤胃液使用60目尼龙袋过滤),标记好后立即放入液氮中保存。
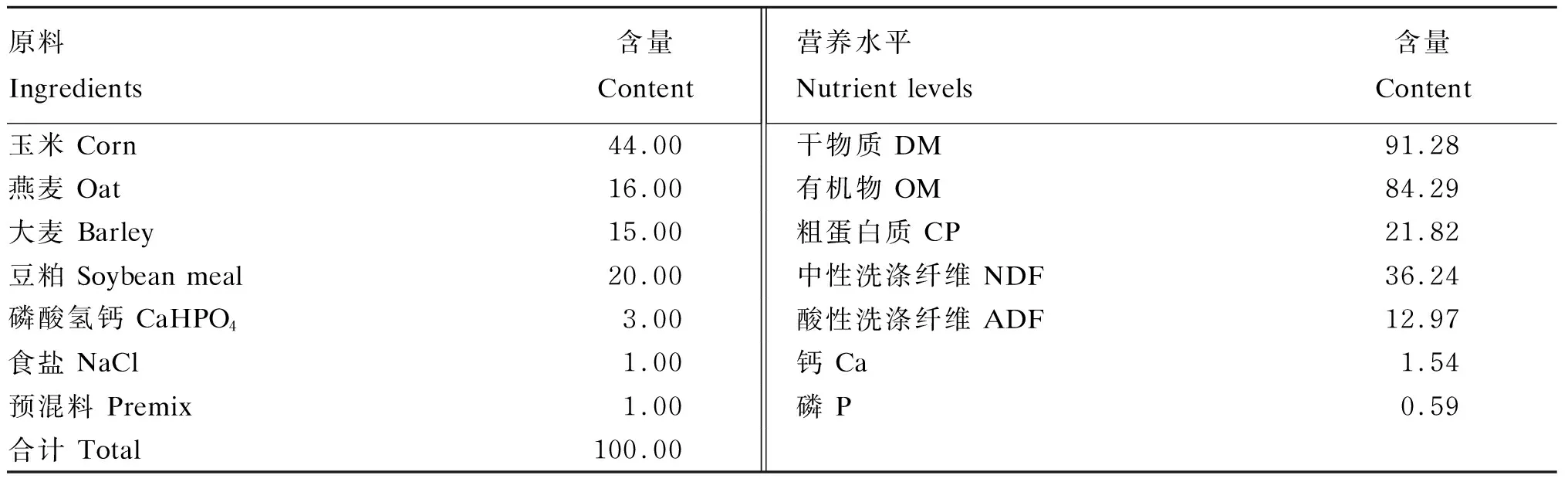
表1 粉状精料组成及营养水平(干物质基础)
每千克预混料含有One kg of premix contained the following: VA 480 IU,VB1816 mg,VB2333 mg,VB649 mg,VD 70 IU,VE 21 333 IU,泛酸 pantothenic acid 20 mg,烟酰胺 nicotinamide 485 mg,Cu (as copper sulfate) 11 mg,Fe (as ferrous sulfate) 35 mg,Mn (as manganese sulfate) 33 mg,Zn (as zinc sulfate) 31 mg,I (as potassium iodide) 2 mg,Se (as sodium selenite) 6 mg,Co (as cobalt chloride) 1 mg。
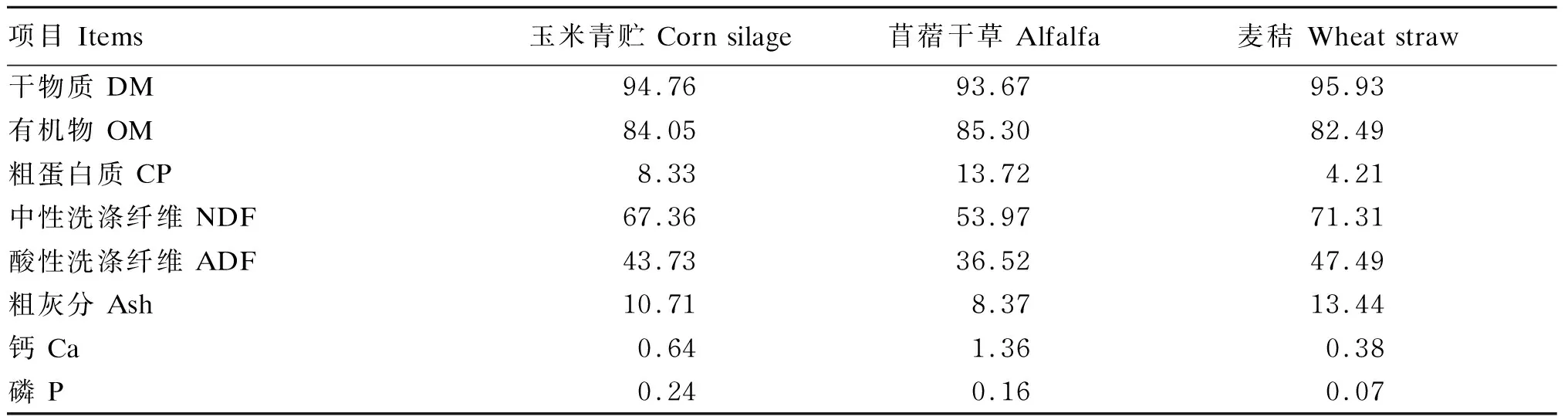
表2 玉米青贮、苜蓿、麦秸的营养水平(干物质基础)
1.6 样品的测定
绵羊血浆中5-羟基色氨酸、5-羟色胺、褪黑素的含量均送至北京华英生物技术研究所进行测定。5-羟基色氨酸、褪黑素含量测定使用放免法(XH-6020全自动放免计数仪,西安核仪器厂),5-羟色胺含量测定使用酶免法(华卫德朗DR-200BS酶标分析仪,无锡华卫德朗仪器有限公司)。
肠道内容物中5-羟基色氨酸、5-羟色胺、N-乙酰-5-羟色胺(N-acetylserotonin,NAS)、褪黑素、5-羟基吲哚乙酸(5-hydroxyindoleaceticacid,5-HIAA)含量使用超高效液相色谱-串联质谱联用(UHPLC-MS/MS)技术测定(高效液相:1290 Infinity series UHPLC System,购自Agilent公司;高分辨质谱:Q Exactive Focus,购自Thermo Fisher Scientific公司)。使用超高效液相色谱仪,通过Waters ACQUITY UPLC BEH C18(100.0 mm×2.1 mm,1.7 μm)液相色谱柱对目标化合物进行色谱分离,以平行反应监测(parallel reaction monitoring,PRM)模式进行质谱分析。
样品处理过程:称取100 mg内容物(1 mL瘤胃液)于Eppendorf管中,加入1 mL提取液(乙腈∶甲醇∶水=2∶2∶1),旋涡混匀30 s,加入钢珠,45 Hz研磨处理10 min,冰水浴条件下超声10 min,12 000 r/min离心15 min(4 ℃),取100 μL上清液用于UHPLC-MS/MS分析。流动相、质谱条件:液相色谱流动相A为0.1%甲酸水溶液,流动相B为乙腈。柱温箱温度为40 ℃,样品盘设为4 ℃,进样体积为1 μL。质谱条件:喷雾电压=+3 500/-3 100 V,气流量(N2)=40,辅助气体流量(N2)=5,辅助气体温度=350 ℃,离子传输管温度=320 ℃。色谱梯度见表3。

表3 色谱梯度
进行UHPLC-MS/MS分析之前,将目标化合物标准溶液引入质谱中。针对每个目标化合物,对其PRM参数进行优化,并选取其中响应最好的
子离子用于定量分析,其他子离子用于目标化合物定性分析,PRM参数优化见表3。
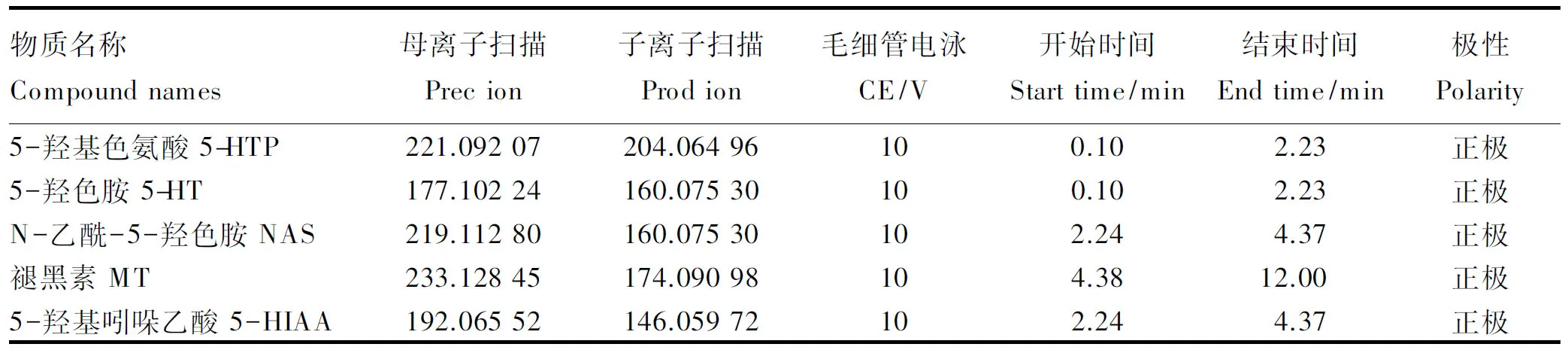
表4 PRM参数优化
1.7 数据分析
数据采用Excel 2003进行初步整理,试验结果以平均值±标准差(mean±SD)表示。试验数据采用SPSS 18.0软件的one-way ANOVA程序进行方差分析,各组间多重比较采用Duncan氏法。
2 结 果
2.1 瘤胃保护性5-羟基色氨酸对绵羊瘤胃液中5-羟基色氨酸、褪黑素含量的影响
由表5可知,试验Ⅰ、Ⅱ组瘤胃液中5-羟基色氨酸含量极显著高于对照组(P<0.01);试验Ⅱ组瘤胃液中5-羟色胺含量极显著高于对照组(P<0.01);对照组瘤胃液中褪黑素含量显著高于试验Ⅱ组(P<0.05),而对照组与试验Ⅰ组相比差异不显著(P>0.05);各组间瘤胃液中N-乙酰-5-羟色胺、5-羟基吲哚乙酸含量无显著差异(P>0.05)。
2.2 瘤胃保护性5-羟基色氨酸对十二指肠内容物中5-羟基色氨酸、褪黑素含量的影响
由表6可知,十二指肠内容物中,试验Ⅱ组5-羟基色氨酸、5-羟色胺、N-乙酰5-羟色胺含量极显著高于对照组(P<0.01),但试验Ⅰ、Ⅱ组褪黑素和5-羟基吲哚乙酸含量极显著低于对照组(P<0.01)。
2.3 瘤胃保护性5-羟基色氨酸对空肠内容物中5-羟基色氨酸、褪黑素含量的影响
由表7可知,空肠内容物中,试验Ⅰ、Ⅱ组5-羟基色氨酸含量极显著高于对照组(P<0.01),试验Ⅱ组5-羟色胺、N-乙酰5-羟色胺、褪黑素含量极显著高于对照组、试验Ⅰ组(P<0.01),对照组5-羟基吲哚乙酸含量极显著高于试验Ⅰ组、试验Ⅱ组(P<0.01)。
2.4 瘤胃保护性5-羟基色氨酸对回肠内容物中5-羟基色氨酸、褪黑素含量的影响
由表8可知,回肠内容物中,5-羟基色氨酸含量的变化为试验Ⅱ组>试验Ⅰ组>对照组,各组间差异极显著(P<0.01);试验Ⅰ、Ⅱ组5-羟色胺含量极显著低于对照组(P<0.01);对照组、试验Ⅱ组N-乙酰-5-羟色胺含量极显著高于试验Ⅰ组(P<0.01);各组间褪黑素、5-羟基吲哚乙酸含量无显著差异(P>0.05)。

表5 瘤胃保护性5-羟基色氨酸对绵羊瘤胃液中5-羟基色氨酸、褪黑素含量的影响
同列数据肩标不同小写字母表示差异显著(P<0.05),不同大写字母表示差异极显著(P<0.01),相同或无字母表示差异不显著(P>0.05)。下表同。
In the same column, values with different small letter superscripts mean significant difference (P<0.05), and with different capital letter superscripts mean significant difference (P<0.01), while with the same or no letter superscripts mean no significant difference (P>0.05). The same as below.
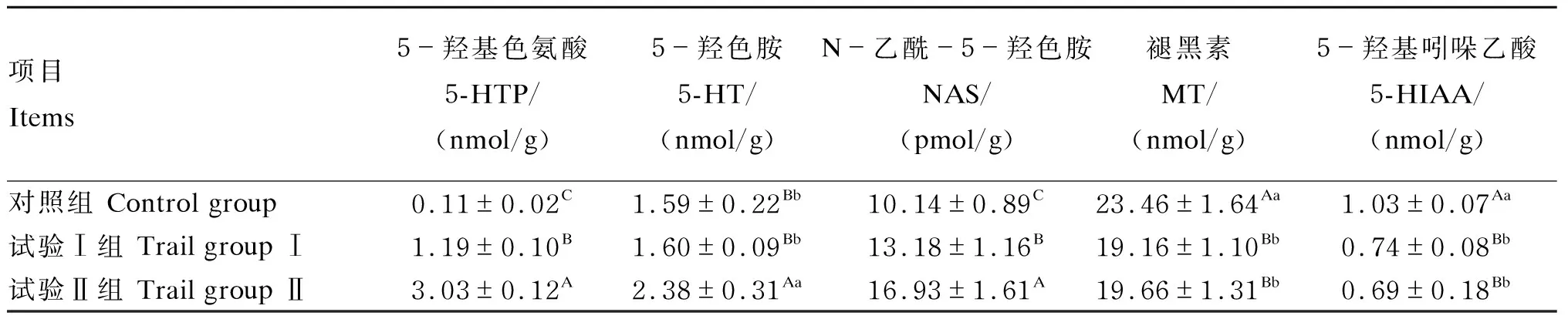
表6 瘤胃保护性5-羟基色氨酸对绵羊十二指肠内容物中5-羟基色氨酸、褪黑素含量的影响
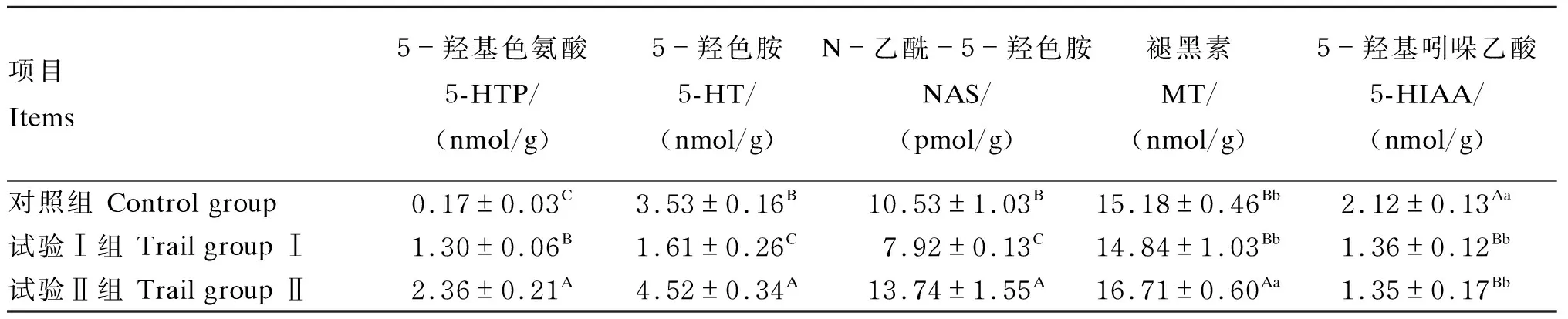
表7 瘤胃保护性5-羟基色氨酸对绵羊空肠内容物中5-羟基色氨酸、褪黑素含量的影响
2.5 瘤胃保护性5-羟基色氨酸对盲肠内容物中5-羟基色氨酸、褪黑素含量的影响
由表9可知,盲肠内容物中,对照组5-羟基色氨酸、5-羟色胺、N-乙酰-5-羟色胺含量极显著高于试验Ⅰ、Ⅱ组(P<0.01),且试验Ⅱ组5-羟基色氨酸、N-乙酰-5-羟色胺含量均极显著高于试验Ⅰ组(P<0.01);各组间褪黑素含量无显著差异(P>0.05);试验Ⅱ组5-羟基吲哚乙酸含量极显著高于对照组(P<0.01)。
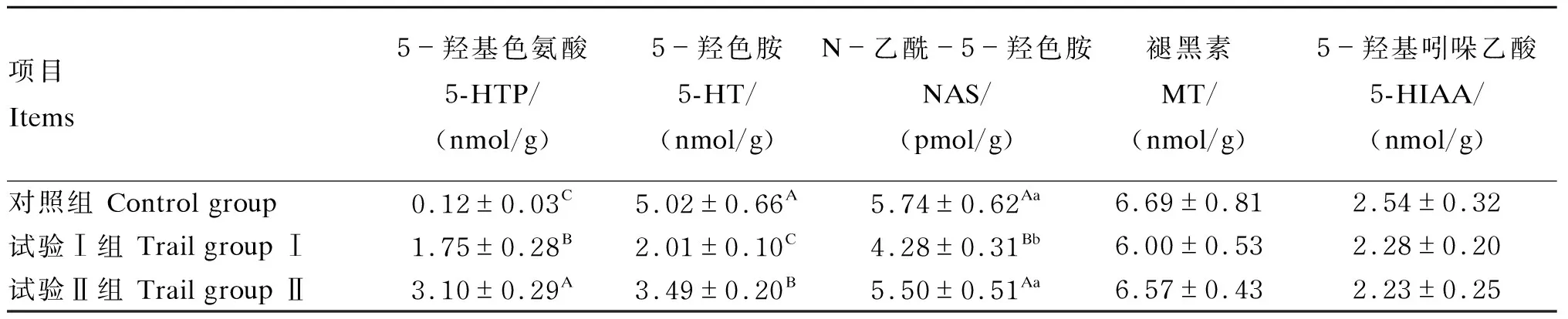
表8 瘤胃保护性5-羟基色氨酸对绵羊回肠内容物中5-羟基色氨酸、褪黑素含量的影响
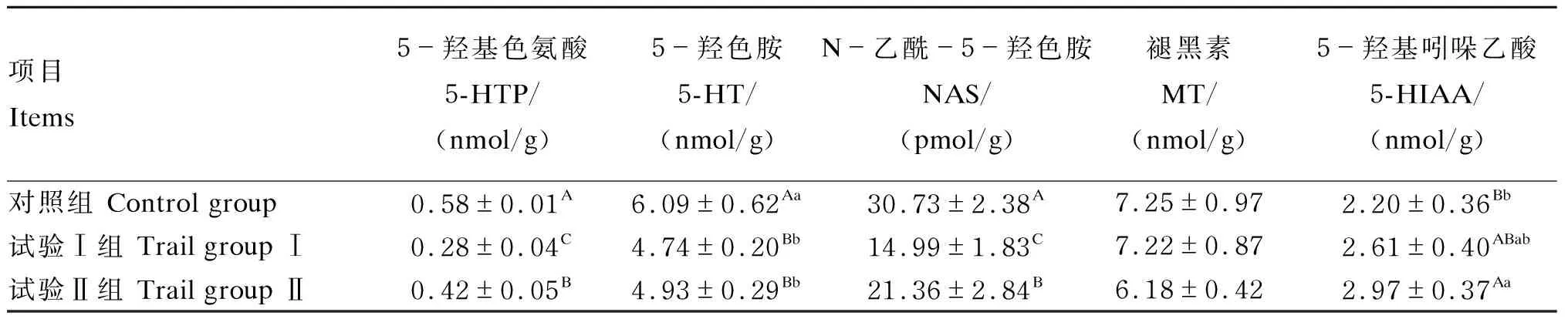
表9 瘤胃保护性5-羟基色氨酸对绵羊盲肠内容物中5-羟基色氨酸、褪黑素含量的影响
2.6 瘤胃保护性5-羟基色氨酸对结肠内容物中5-羟基色氨酸、褪黑素含量的影响
由表10可知,结肠内容物中,试验Ⅰ、Ⅱ组5-羟基色氨酸、5-羟色胺、N-乙酰-5-羟色胺、褪黑素、5-羟基吲哚乙酸含量均高于对照组;其中,试验Ⅱ组5-羟基色氨酸含量极显著高于对照组(P<
0.01),试验Ⅱ组5-羟色胺、N-乙酰-5-羟色胺含量显著高于对照组(P<0.05),试验Ⅰ、Ⅱ组褪黑素含量极显著高于对照组(P<0.01),试验Ⅰ、Ⅱ组5-羟基吲哚乙酸含量显著或极显著高于对照组(P<0.05或P<0.01)。
2.7 瘤胃保护性5-羟基色氨酸对绵羊血浆中5-羟基色氨酸、褪黑素含量的影响
由表11可知,绵羊早上采食瘤胃保护性5-羟基色氨酸后6 h,血浆中5-羟基色氨酸含量增加,且试验Ⅱ组极显著高于对照组(P<0.01);试验Ⅱ组血浆中5-羟基色胺含量显著高于对照组(P<0.01);试验Ⅱ组血浆中褪黑素含量显著高于对照组(P<0.05)。

表11 瘤胃保护性5-羟基色氨酸对绵羊血浆中5-羟基色氨酸、褪黑素含量的影响
3 讨 论
3.1 绵羊胃肠道内容物中5-羟基色氨酸、5-羟色胺、褪黑素含量的分布特点
目前,关于绵羊肠道内容物中5-羟基色氨酸、5-羟色胺、褪黑素、N-乙酰5-羟基色氨酸、5-羟基吲哚乙酸含量分布的研究报道较少。在本试验中,绵羊各肠段内容物中5-羟基色氨酸含量分布特点有很大差异,表现为盲肠>空肠、结肠>瘤胃液、十二指肠、回肠。肠道内容物中的5-羟基色氨酸可能来自肠道中微生物以饲粮中的色氨酸为底物经羟化后形成[9]。5-羟基色氨酸是5-羟色胺的重要前体物质,但导致绵羊胃肠道内容物中5-羟基色氨酸含量分布的差异及其是否还有其他生理功能尚不明确。5-羟色胺主要存在于肠黏膜的嗜铬细胞中[10]。大鼠肠组织中5-羟色胺含量变化为:空肠<胃部<回肠<结肠[11]。在本试验中,对照组绵羊肠道内容物中5-羟色胺含量在结肠中最高,肠道内容物中5-羟色胺含量变化为:瘤胃液<十二指肠<空肠<回肠<盲肠<结肠,与大鼠肠组织中5-羟色胺分布情况基本一致。而在梅花猪肠组织中,5-羟色胺在十二指肠、空肠、回肠、结肠中均有分布,但在十二指肠中含量最高[12],这可能与猪、绵羊消化系统差异性及采食的饲粮中色氨酸的水平有关[13]。N-乙酰-5-羟色胺和5-羟基吲哚乙酸均是5-羟色胺的代谢产物,其中N-乙酰-5-羟色胺是褪黑素形成过程中重要的中间产物。大鼠肠道内容物中5-羟基吲哚乙酸含量变化为:胃部、回肠<空肠<结肠[11],本试验中,对照组绵羊瘤胃液和结肠内容物中N-乙酰-5-羟色胺和5-羟基吲哚乙酸含量较高。
肠道中含有大量的褪黑素[14],肠道中的褪黑素主要在肠黏膜中的嗜铬细胞中合成[15]。肠嗜铬细胞主要以L-色氨酸为底物,经过羟化、脱羧、转氨基后合成褪黑素,且肠道中褪黑素的分布与肠道中嗜铬细胞的密度有关[16-17],肠道内容物中的褪黑素可能有3种来源:肠黏膜[18]、饲粮[7]、肠道微生物[9]。此外,哺乳动物胆汁中含有较高含量的褪黑素[19]。因此,广泛存在的肝肠循环也可能是肠道中褪黑素的来源之一。本试验中,胃肠道内容物中的褪黑素含量分布特点是:十二指肠>瘤胃、空肠>回肠、盲肠>结肠。牛的胃肠道内容物中褪黑素含量变化为:回肠、盲肠、结肠>瘤胃、网胃、瓣胃、皱胃>空肠[13]。西班牙斗牛食管、胃部、肠道前端、肠道后端内容物中褪黑素含量分别为73、78、20、152 pg/g[20]。本试验测定的肠道内容物褪黑素含量分布与前人的研究结果有所不同,可能的原因是:1)与肠道的消化吸收、采食控制有关,尤其是后肠中的褪黑素含量可能受到肠道内容物含量、食糜蠕动速度影响[21];2)采样时间的差异,牛胃肠道中内容物是在牛采食后立即采集,而本试验是在绵羊采食后6 h才采集样品。由此看来,动物肠道中的褪黑素含量受采食时间、采食饲粮的营养水平、消化道特点等多种因素的影响。
3.2 瘤胃保护性5-羟基色氨酸对绵羊胃肠道内容物5-羟基色氨酸、褪黑素含量的影响
Namboodiri等[8]通过腹腔注射的方式给绵羊分别注射了20、200 mg/kg BW的5-羟基色氨酸,腹腔注射可直接进入血液循环,而在饲粮中添加5-羟基色氨酸则会经过胃肠道的代谢,且5-羟基色氨酸能否在瘤胃中降解尚不明确。因此,本试验选择的瘤胃保护性5-羟基色氨酸的添加量为111、222 mg/kg BW。在本试验中,绵羊摄入不同水平瘤胃保护性5-羟基色氨酸后,瘤胃液中5-羟基色氨酸、5-羟色胺含量增加,可能是由于本试验饲喂的瘤胃保护性5-羟基色氨酸在瘤胃的蠕动、饲粮的挤压下,部分瘤胃保护性5-羟基色氨酸的包衣破裂,使5-羟基色氨酸释放出来,进而转化为5-羟色胺。瘤胃液中5-羟基色氨酸、5-羟色胺、N-乙酰-5-羟色胺含量增加,而褪黑素含量则降低,可能本试验饲喂的瘤胃保护性5-羟基色氨酸对N-乙酰-5-羟色胺转化为褪黑素过程中的羟基吲哚氧位甲基转移酶未起到调控作用。目前关于瘤胃中的褪黑素来源尚不明确,可能是反刍动物唾液中含有褪黑素[22],在绵羊反刍、采食过程中,含有褪黑素的部分唾液进入了瘤胃。
绵羊摄入不同水平的瘤胃保护性5-羟基色氨酸后,十二指肠内容物中5-羟基色氨酸含量增加,表明绵羊摄入的瘤胃保护性5-羟基色氨酸在瘤胃蠕动、挤压和肠道消化酶的作用下释放。十二指肠内容物中,5-羟色胺、N-乙酰-羟色胺含量随瘤胃保护性5-羟基色氨酸摄入量的增加而增加,但肠道内容物中褪黑素含量则随瘤胃保护性5-羟基色氨酸摄入量的增加而降低,这也进一步证实羟基吲哚氧位甲基转移酶是褪黑素合成过程中的限速酶[23],可能由于绵羊十二指肠中pH较低[24],肠腔中含有大量的食物抗原、共生微生物以及胆酸盐、胰腺分泌物等营养因子[25],影响了褪黑素合成过程中酶活力或表达的调节,故瘤胃保护性5-羟基色氨酸对绵羊十二指肠褪黑素合成的调节并未有显著影响。犬口服5-羟基色氨酸(0.5 mg/kg BW)后,十二指肠内容物中5-羟基吲哚乙酸含量在采食后0.5 h开始增加[26]。而本试验中,试验组十二指肠内容物中5-羟基吲哚乙酸含量降低,这与上述的试验结果有所不同,这可能是与狗、绵羊消化系统特点、采食饲粮组成和营养水平不同有关。
补喂瘤胃保护性5-羟基色氨酸后,绵羊空肠、回肠内容物5-羟基色氨酸含量高于对照组,但试验Ⅰ组空肠、回肠内容物中5-羟色胺、N-乙酰-5-羟色胺含量低于对照组,同时,褪黑素和5-羟基吲哚乙酸含量也低于对照组。本试验未能够对肠道内容物中的这几个关键酶活力进行测定。但从5-羟基色氨酸代谢为褪黑素的过程来看,5-羟色胺、N-乙酰-5-羟色胺是褪黑素合成过程中的关键中间产物,本试验的结果可能与5-羟色胺-N-乙酰转移酶、羟基吲哚氧位甲基转移酶的变化有关。绵羊白天时松果体中5-羟色胺-N-乙酰转移酶、羟基吲哚氧位甲基转移酶的活力分别为1.1、0.14 nmol/(min·mg prot),夜晚时的活力分别为3.10、0.29 nmol/(min·mg prot),但其他合成酶的活力并未产生显著变化[23]。222 mg/kg BW瘤胃保护性5-羟基色氨酸显著增加了空肠内容物中5-羟基色氨酸、5-羟色胺、N-乙酰-5-羟色胺、褪黑素、5-羟基吲哚乙酸含量,可能是由于222 mg/kg BW瘤胃保护性5-羟基色氨酸达到了调节空肠中褪黑素合成酶活力的底物含量,促进了5-羟色胺、N-乙酰-5-羟色胺、褪黑素、5-羟基吲哚乙酸的合成,而111 mg/kg BW瘤胃保护性5-羟基色氨酸对未空肠内容物中褪黑素合成过程中酶活力或表达起到调节作用。
本试验还发现,绵羊摄入不同水平瘤胃保护性5-羟基色氨酸后,盲肠内容物中5-羟基色氨酸、5-羟色胺、N-乙酰-5-羟色胺含量降低,5-羟基吲哚乙酸含量增加。导致这一结果的原因有3个方面:1)从盲肠的生理特点来看,盲肠是各肠段中长度最短的一段[27],本试验是在绵羊早上采食后6 h采集的肠道内容物样品,外源性的瘤胃保护性5-羟基色氨酸及其代谢产物可能已经通过了该肠段;2)5-羟基色氨酸的代谢产物5-羟色胺具有促进肠道蠕动的功能,可能促进了肠道的蠕动[28],使食糜在盲肠中停留的时间缩短;3)盲肠内容物中5-羟基吲哚乙酸含量随瘤胃保护性5-羟基色氨酸的摄入量增加而增加,推测盲肠内容物中的5-羟基色氨酸增加了单胺氧化酶的活力或表达,使5-羟色胺转化为5-羟基吲哚乙酸,而不是N-乙酰-5-羟色胺和褪黑素,但具体的原因有待于进一步研究。
在结肠内容物中,5-羟基色氨酸、5-羟色胺、N-乙酰-5-羟色胺、褪黑素和5-羟基吲哚乙酸均随瘤胃保护性5-羟基色氨酸摄入量的增加而增加,表明不同水平瘤胃保护性5-羟基色氨酸可能调节了结肠内容物中褪黑素合成过程中的每个步骤中酶的活力或表达。研究表明,肠道微生物可以合成褪黑素[9]。在绵羊的肠道微生物中,结肠中的微生物丰富度较高[29],本试验给绵羊饲喂的瘤胃保护性5-羟基色氨酸可能为结肠微生物提供了更多的褪黑素合成底物,进而增加了结肠内容物中褪黑素含量。其次,本试验是在绵羊早上采食后6 h采集的肠道内容物样品,此时,十二指肠、空肠、回肠、盲肠中的食糜可能通过肠道蠕动到达了结肠,结肠中的5-羟基色氨酸及其代谢产物可能来自于“上游”肠段。本试验添加的瘤胃保护性5-羟基色氨酸可增加绵羊胃肠道中5-羟色胺、褪黑素含量,这2种物质在维持胃肠道生理功能中发挥了重要的作用,但是否会影响绵羊的消化代谢值得进一步研究。
3.3 瘤胃保护性5-羟基色氨酸对绵羊血浆中5-羟基色氨酸、褪黑素含量的影响
在本试验中,绵羊摄入瘤胃保护性5-羟基色氨酸后6 h,血浆中5-羟基色氨酸、5-羟色胺含量增加,这一结果与在人[30-31]、犬[32]、绵羊[33]分别使用腹腔注射、口服摄入5-羟基色氨酸后血浆中5-羟基色氨酸、5-羟色胺、褪黑素含量增加的结果基本一致。
在本试验中,2个试验组绵羊血浆中5-羟基色氨酸、5-羟色胺、褪黑素含量增加,结合绵羊肠道内容物中5-羟基色氨酸、5-羟色胺、褪黑素含量的变化,绵羊血浆中5-羟色胺、褪黑素含量可能来源于绵羊胃肠道。对猪采食后24 h内动脉、腔静脉、门静脉血液中褪黑素含量进行比较发现,经肠道吸收的褪黑素再经过肝脏代谢后,在颈静脉中仍有较高含量的褪黑素[21],说明肠道中的褪黑素含量可影响血液中的褪黑素含量。给切除松果体的鸡饲喂色氨酸后,鸡血浆中褪黑素含量也有所增加[34],提示鸡血浆中的褪黑素可能是以色氨酸为前体物质,在肠道中褪黑素合成酶的作用下转化而来,本试验结果也与该结果一致。以上研究结果说明,血浆中的褪黑素可能来源于胃肠道,且给动物饲喂褪黑素的前体物质可通过胃肠道吸收的方式增加血浆中褪黑素的含量。
4 结 论
① 绵羊胃肠道内容物中5-羟基色氨酸含量的分布特点是:盲肠>空肠、结肠>瘤胃液、十二指肠、回肠;褪黑素含量的分布特点是:十二指肠>瘤胃、空肠>回肠、盲肠>结肠。
② 瘤胃保护性5-羟基色氨酸补喂量为222 mg/kg BW时能提高胃肠道内容物中5-羟基色氨酸含量,但对5-羟色胺、褪黑素含量的影响在各胃肠段表现不同。
③ 瘤胃保护性5-羟基色氨酸补喂量为111、222 mg/kg BW时均能提高绵羊血浆中5-羟基色氨酸、5-羟色胺、褪黑素含量。

