通过定点突变提高纳豆激酶的酶活及热稳定性
赵菡,周丽,周哲敏
(江南大学 生物工程学院,工业生物技术教育部重点实验室,江苏 无锡,214122)
枯草杆菌蛋白酶是丝氨酸蛋白酶的第二大家族,已经作为模式酶被广泛研究[1],研究内容主要包括改造其催化活性[2-3]、底物结合特异性[4]以及稳定性[5]等。纳豆激酶(Nattokinase,NK,EC3.4.21.62)是由日本传统食品纳豆在发酵过程中产生的一种枯草杆菌蛋白酶,其编码基因为aprN[6],具有保守的催化活性中心(Asp32, His64 和 Ser221)。纳豆激酶不仅可以通过激活纤溶酶原将其转变为纤溶酶[7],间接溶解纤维蛋白,还可以直接作用于交联的纤维蛋白[8],因而具有很强的溶栓功效。相较于市售的溶栓药物(链激酶、尿激酶以及蛇毒纤溶酶等),纳豆激酶还有半衰期长、安全、副作用小以及成本低等优点,因此将其开发为治疗心脑血管疾病的口服药物,具有广阔的应用前景[9]。然而野生型纳豆激酶的酶活较低,热稳定性较差,尤其当温度超过60 ℃时,酶分子会迅速失活,不利于其在工艺生产高温环节保证酶活,因此不能满足大规模生产[10]。本文选用一种高效的方法以提高纳豆激酶的活性以及热稳定性。
在蛋白质中,翻译后的脱酰胺过程将天冬酰胺(Asn)和谷氨酰胺(Gln)转化为带负电的天冬氨酸(Asp)和谷氨酸(Glu),可能改变蛋白质的电荷网络进而影响酶的活性、最适pH值和稳定性等[11]。因此,可通过替换酶分子中的Asn和Gln改造酶分子的性质。如KATO将蛋清溶菌酶中2个Asn突变为Asp后,最适pH值向酸性偏移了0.5个单位[12];JAKOB通过改造蛋白酶BgAP表面的Asn和Gln,使其在pH值8.5下的热稳定性提高了2.5 ℃[13]。研究发现,蛋白质表面氨基酸的改造可以改变酶的性质。例如,KHURANA将表面的疏水氨基酸突变为亲水氨基酸提高了脂肪酶的稳定性[14]MICHAEL通过替换酶分子表面的76位和218位氨基酸提高了枯草蛋白酶BPN’的稳定性[15]。此外,表面电荷的改造也可提高酶的活性[16]和稳定性等。如,JAOUADI通过优化丝氨酸蛋白酶表面电荷与电荷之间的相互作用提高了其热稳定性[17]。然而,许多研究集中于改造酶活性中心附近的氨基酸,而远离活性中心的位点也可能影响酶的性质,如,MIYAZAKI采用定向进化方法筛选得到热稳定性及酶活提高的突变体位于远离酶活性中心的loop环上[18]。
综合以上研究,为了高效选择突变位点,设定以下选点原则:选择表面的Asn和Gln;为非保守残基;远离酶的活性中心。最终选择8个位点,分别将其突变为带负电的Asp和Glu,通过筛选得到酶活和热稳定性提高的突变株,为纳豆激酶的工业应用奠定了基础。
1 材料与方法
1.1 菌株,质粒以及培养条件
EscherichiacoliJM109以及E.coliBL21 (DE3)分别用于质粒构建以及蛋白表达,由作者实验室保藏。质粒pET-24a用作表达载体,将纳豆激酶的成熟肽与前导肽基因序列克隆至pET-24a载体上(于限制性酶切位点XbaI 和BamHI之间),得到重组表达载体pET-24a-pro-NK(实验室已有)[10]。LB培养基(10 g/L胰蛋白胨,5 g/L酵母提取物,10 g/L NaCl)用于质粒的构建与培养。自诱导培养基ZYM-5052用于纳豆激酶的发酵表达[19]。培养基中卡那霉素的终质量浓度为50 μg/ mL。
1.2 主要材料与仪器
1 mL离心式蛋白纯化空柱、含镍树脂:生工生物工程(上海)股份有限公司;对硝基苯胺(pNA)、四肽合成底物(N-succinyl-L-Ala-L-Ala-L-Pro-L-Phe-p-nitroanilide,suc-AAPF-pNA) :Sigma公司;PCR仪:BIO-RAD公司;UV-1800PC型紫外可见分光光度计:上海美谱达有限公司;pH计:梅特勒-托利多仪器(上海)有限公司;多功能酶标仪:Bioteck公司(美国)。
1.3 实验方法
1.3.1 基因操作
以质粒pET-24a-pro-NK为模板采用定点突变(重叠延伸)方法构建突变体。所有突变体相关引物如表1所示。

表1 本研究所用引物序列Table 1 Oligonucleotide primers used in this study
PCR得到的基因产物于DpnI酶中37℃消化5 h以降解模板,然后转化至E.coliJM109感受态细胞中并提取质粒,基因序列验证正确后,转化至E.coliBL 21(DE3)中,成功获得阳性转化子。
1.3.2 目的蛋白的表达纯化
挑取单个转化子接种于含卡那霉素的5 mL LB培养基中,37 ℃、200 r/min振荡过夜培养。以2%的接种量将种子培养液转接至100 mL自诱导培养基ZYM-5052中,37 ℃、200 r/min振荡培养。当OD600值达到2左右时,温度降至18 ℃,培养20 h,离心收集菌体,用10 mL结合缓冲液(100 mmol/L Tris-HCl pH 8.0,500 mmol/L NaCl,20 mmol/L咪唑)重悬菌体,并于冰上超声破碎,收集破碎上清液,于4 ℃经亲和层析镍柱离心柱(将含镍树脂装入1 mL离心空柱中)纯化目的蛋白,采用含50~100 mmol/L咪唑洗脱缓冲液进行梯度洗脱,纯酶液于100 mmol/L Tris-HCl pH 8.0缓冲液中过夜透析。采用Bradford法测定蛋白浓度,并将野生型以及突变体纯酶液调节至相同的蛋白浓度。
1.3.3 酶活的测定[3]
在100 mmol/L Tris-HCl pH 8.0缓冲液(含0.1 mmol/L CaCl2)中,以人工合成的suc-AAPF-pNA为底物,以对硝基苯胺(pNA)为标准,在终体积为0.2 mL,25 ℃下反应3 min,根据405 nm 的吸收值测定生成pNA浓度。一个酶活力单位定义为:在25 ℃,pH值8.0,底物浓度为0.4 mmol/L时,1 min内,将1 μmol suc-AAPF-pNA转化为1 μmolpNA所需的酶量。
1.3.4 最适温度和最适pH值的测定
取适量纯酶液溶解于100 mmol/L Tris-HCl(pH 8.0)缓冲液中,根据以上酶活测定方法在30、40、50、60、70 ℃下测定其活性,将最高的酶活力定义为100%。在不同pH值缓冲液条件下测定野生型酶和突变体酶的活性,将最高的酶活力定义为100%,pH值3.0~5.0采用50 mmol/L柠檬酸缓冲液,pH值6.0~8.0为50 mmol/L磷酸盐缓冲液,pH值9.0~11.0为50 mmol/L碳酸钠缓冲液(至少3次独立实验的平均值)。
1.3.5 热稳定性和pH值稳定性的测定
取适量野生型和突变体纯酶液于55 ℃中分别孵育(10~60 min),测定各个纯酶液的半衰期(t1/2),将未处理的原始酶活定义为100%,并以相对酶活对时间作图。取适量野生型和突变体纯酶液在4 ℃下,不同的缓冲液(pH 3.0~5.0,50 mmol/L柠檬酸缓冲液,pH 6.0~8.0,50 mmol/L磷酸盐缓冲液,pH 9.0~11.0,50 mmol/L碳酸钠缓冲液)中孵育4 h,测定剩余酶活,将最高的酶活力定义为100%,并以相对酶活对pH值作图(至少3次独立实验的平均值)。
1.3.6 动力学常数的测定
以人工合成的四肽suc-AAPF-pNA为底物,底物浓度范围为0.05~1 mmol/L,在终体积为0.2 mL,25 ℃下反应3 min,测量suc-AAPF-pNA的初始反应速率,通过软件GraphPad Prism 5拟合得到Km与Vmax值,根据kcat=Vmax/ [Enzyme],最后求得kcat及催化效率常数kcat/Km。
2 结果与分析
2.1 突变点的选择
为提高纳豆激酶的活性及稳定性,本文依照以下3个原则选择突变点:利用GETAREA软件筛选表面暴露程度>50%的Asn和Gln;位点远离酶的活性中心(以减少对酶活的负面影响);为非保守氨基酸(图1)。最终,构建了8个突变体N43D、Q59E、Q103E、N109D、 N118D、Q185E、Q206E、N218D(图2)。

箭头所指为突变位点图1 NK与其他枯草杆菌蛋白酶的序列比对Fig.1 Sequence alignment of NK with other subtilisins
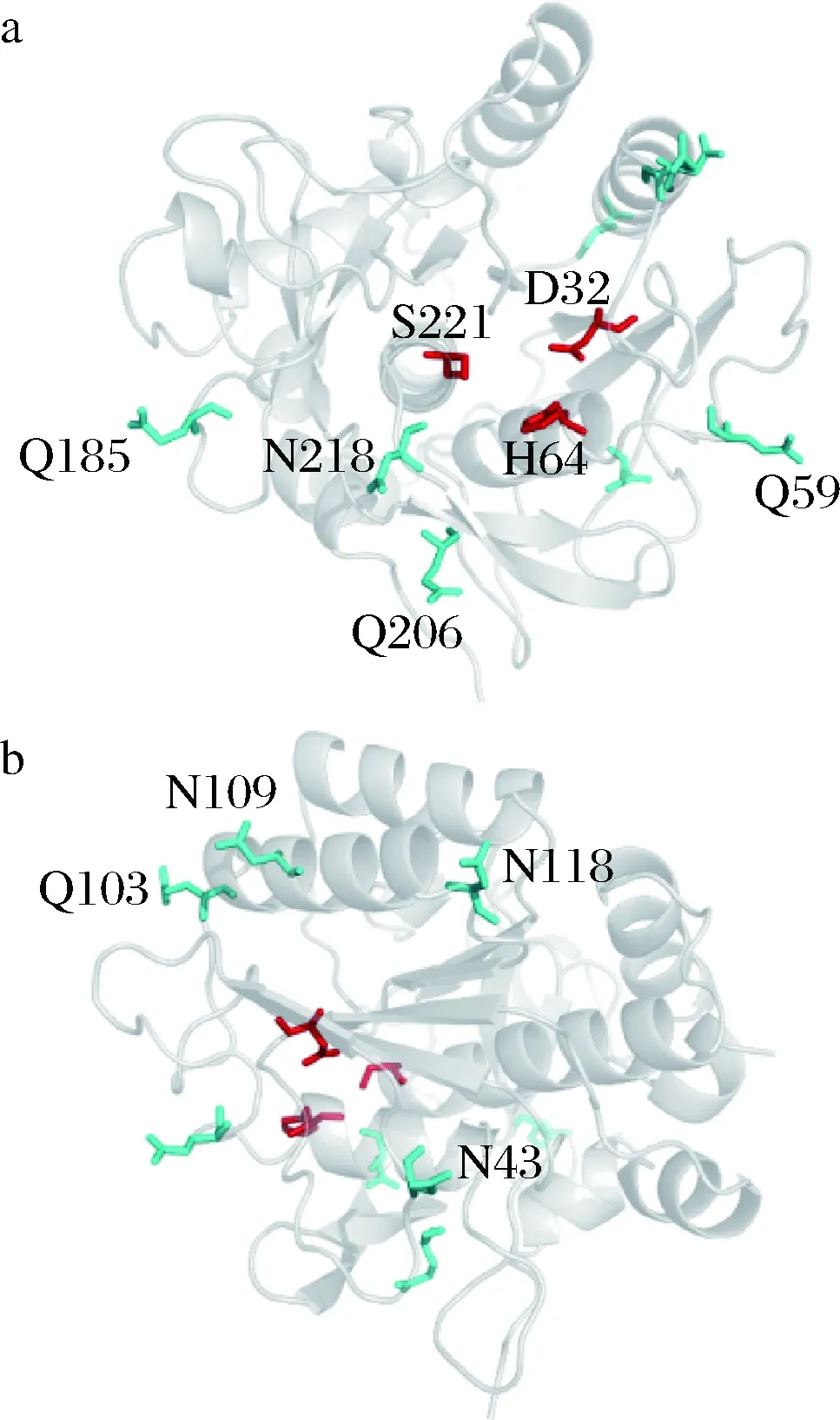
图b由图a旋转一定角度得到;D32,H64,S221为催化活性中心位点图2 突变位点在纳豆激酶三维结构中的分布Fig.2 The distribution of mutants in NK three-dimensional structure
2.2 单点突变的初步筛选
为初步筛选热稳定性提高的突变体,取野生型与突变体粗酶液于65 ℃处理30 min,测定剩余酶活,如图3-a所示,N218D的热稳定性有所提高,相较于WT其残余酶活提高了15%左右。经过初筛,Q59E酶活显著高于WT(图3-b)。
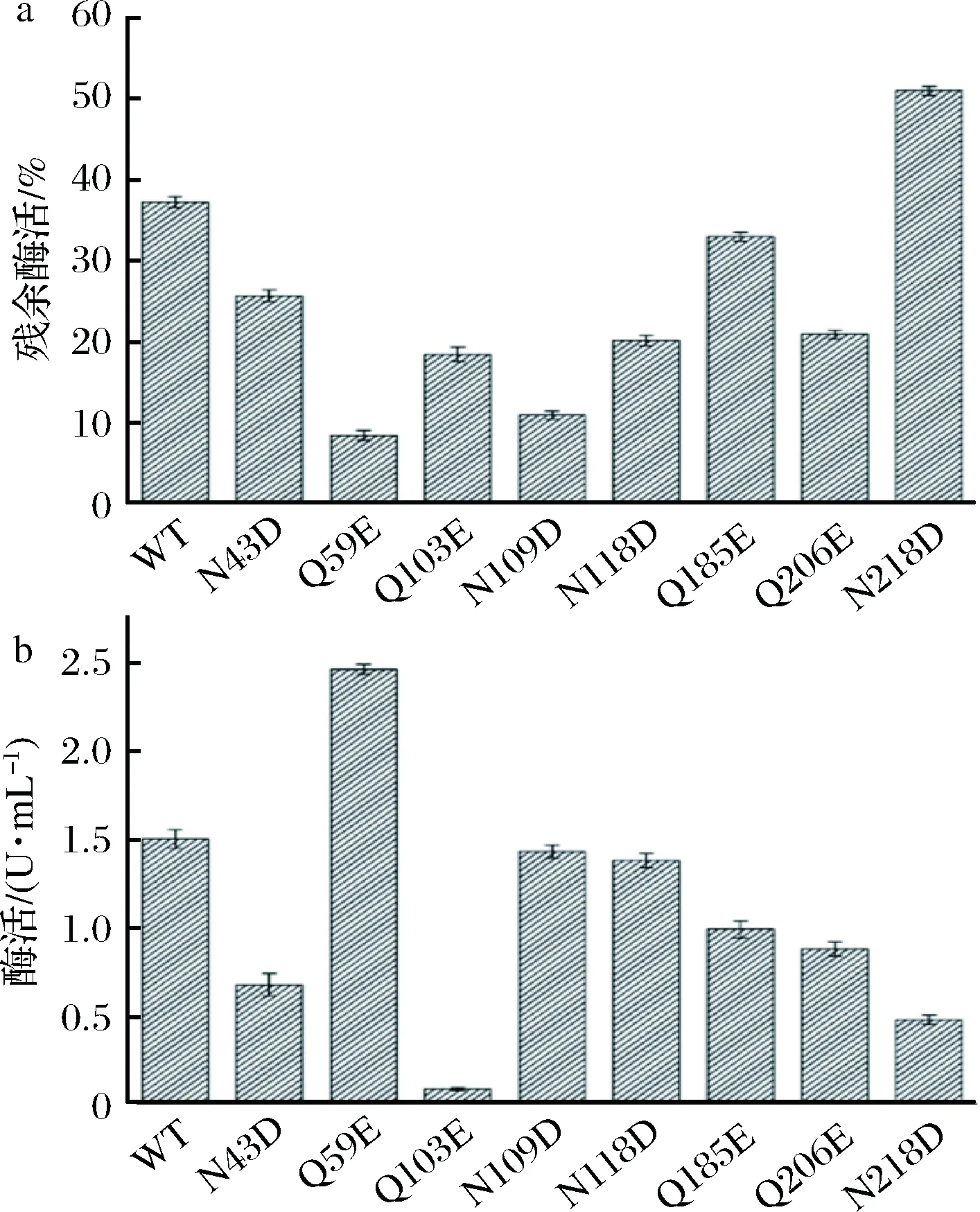
a-热稳定性筛选;b-酶活筛选图3 单突变体初步筛选Fig.3 Preliminary screening of single mutants
2.3 组合突变与酶学性质表征
为进一步提高纳豆激酶的综合性质,将初步筛选得到的酶活提高突变体Q59E以及热稳定性提高的突变体N218D进行组合,得到双突变体Q59E-N218D。
为了准确表征各个突变体酶,将WT以及3个突变体(Q59E、N218D和Q59E-N218D)进行表达纯化,取纯酶液测定其酶学性质。如图4-a和图4-b,各个突变体酶的最适温度和最适pH值并未发生偏移。如图5-a,突变体Q59E的热稳定性较差,而突变体N218D和Q59E-N218D的热稳定性明显提高。其中,N218D在55 ℃下的t1/2约为28 min(表2),相较于WT(约12 min)提高了1.3倍。组合突变体的热稳定性进一步提高,其t1/2提高至33 min左右,为WT的2.75倍。通过对比野生型和突变体的pH值稳定性(图5-b),发现Q59E和N218D的碱性稳定性较差,然而双突变Q59E-N218D 在pH 5~7更为稳定,即耐酸性较WT有所提高。
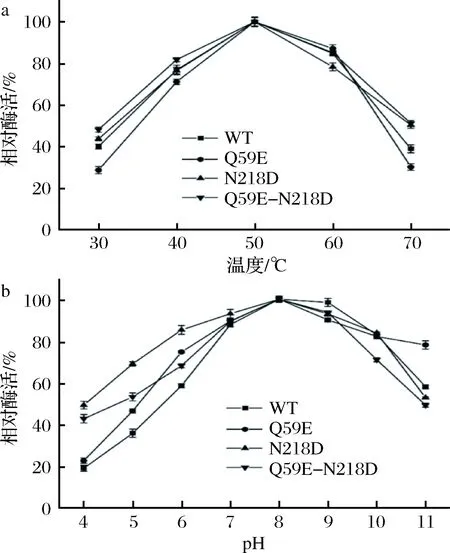
a-最适温度曲线;b-最适pH曲线图4 最适反应条件的测定Fig.4 Determination of the optimum reaction conditions
2.4 动力学常数和比酶活的测定
为了研究催化活性,本文测定了突变体酶的动力学常数以及比酶活值(如表3)。突变体N218D 热稳定性提高,可能是由于其结构刚性增强,然而代价是与底物的亲和能力下降以及kcat的降低,导致催化效率较WT下降了约40%。相反,突变体Q59EKm值降低,说明与底物的亲和能力增强,同时kcat提高了37%,因而催化效率显著提高,约为WT的1.60倍。另外,Q59E的比酶活提高,为WT的1.54倍,与动力学参数相一致。然而,Q59E热稳定性较差,说明酶活与热稳定性之间存在一定的平衡,酶的催化活性更需要柔性的空间构象,而酶的热稳定性则要求酶结构的刚性以抵御外界压力的破坏。因此将Q59E引入N218D,双突变体Q59E-N218D催化效率比单突变体N218D增强,同时热稳定性明显提高,与何孝天的研究相比[10](其提高纳豆激酶热稳定性的同时伴随着催化活性的大幅度下降),本研究提供了综合性质更好的突变株,为纳豆激酶的工业应用奠定了基础。所以组合突变可以一定程度上综合单点突变的优势获得最佳平衡,从而得到更为有效的突变酶。
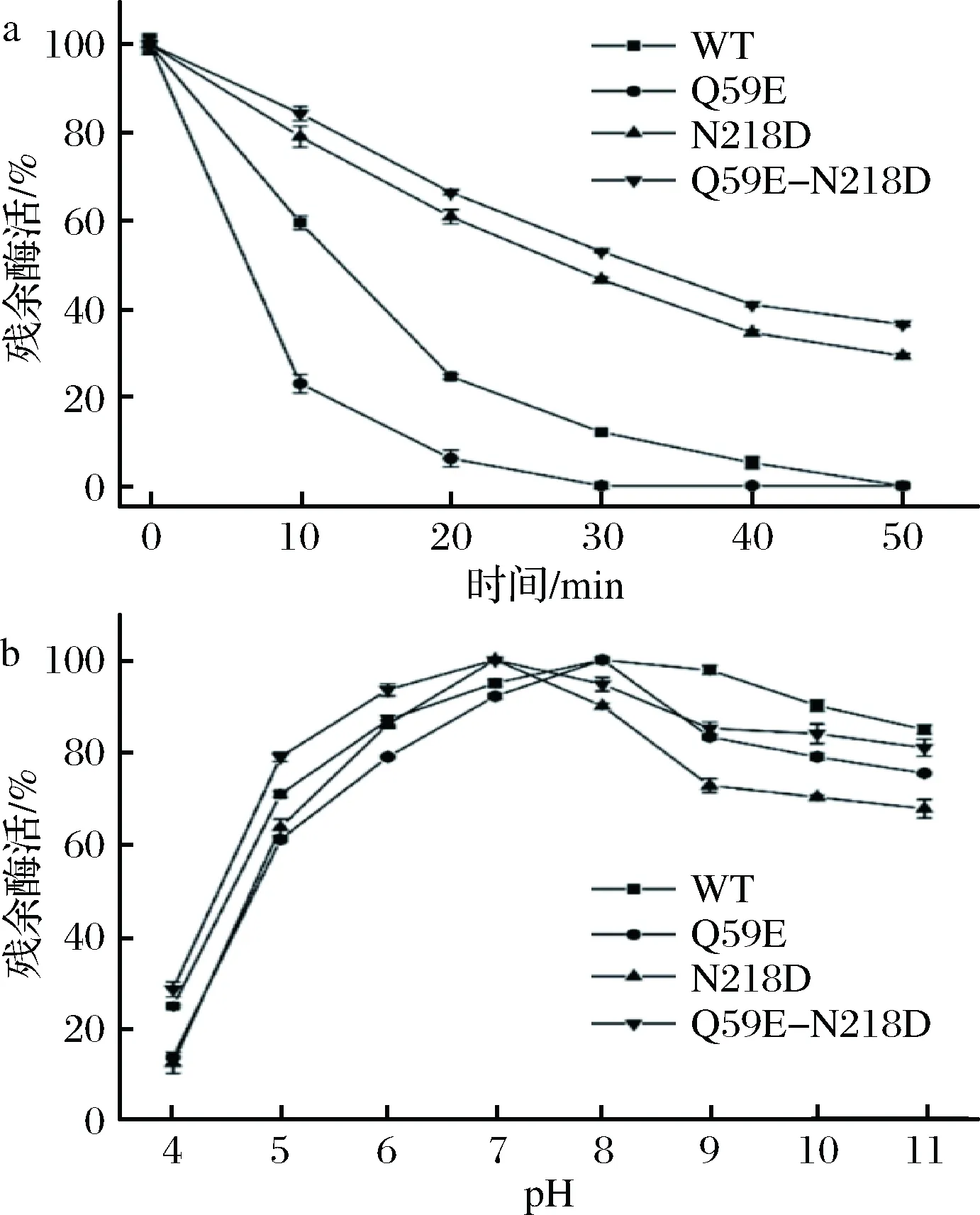
a-原始酶与突变体的热稳定性(在55℃下残余酶活随时间变化)曲线;b-原始酶与突变体在不同pH下的稳定性曲线图5 热稳定性和pH稳定性的测定Fig.5 Determination of the thermal stability and pH stability
表2 野生型与突变体酶的半衰期值Table 2 Half-life of wild-type NK and mutants

酶半衰期(t1/2)/minwild-type11.90±0.59Q59E4.81±0.14N218D28.17±0.35Q59E-N218D32.38±0.98
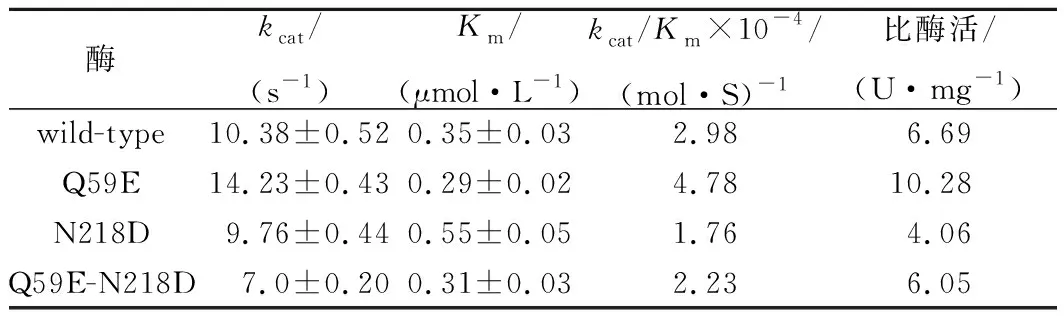
表3 野生型酶与突变体酶的动力学参数以及比酶活Table 3 Kinetic parameters and specific activities of wild-type NK and mutants
3 讨论
本文通过定点突变构建重组纳豆激酶突变体,经过筛选得到催化活性显著提高的突变体Q59E以及热稳定性提高突变体N218D。组合突变Q59E-N218D的热稳定性进一步提高,由野生型酶的12 min提高至33 min,且其比酶活达到与原始酶相似水平。
本文酶活提高突变体Q59E,在蛋白质表面引入了负电荷,可能通过远距离静电相互作用影响酶活性中心区域的结构,从而提高了纳豆激酶的催化活性。因此,本文采用筛选突变体的方法可作为一种改善酶性质的有效策略,为其他酶的改造提供参考。

