植物应答缺铁胁迫的分子生理机制及其调控
张妮娜,上官周平,陈 娟
(西北农林科技大学/黄土高原土壤侵蚀与旱地农业国家重点实验室,陕西杨陵 712100)
虽然土壤中铁的含量很高,但其主要以生物有效性低的三价铁形式存在,尤其是在碱性石灰性土壤上,土壤中铁的溶解度因较高的pH和高含量的碳酸盐而严重降低。数据分析表明,全世界大约40%的耕地面积潜在性缺铁[1],植物缺铁已成为亟需解决的一个重要问题。铁元素在植物生长中起着非常重要的作用,不仅参与植物体光合与呼吸、植物蛋白质及核酸的合成、氮的固定等诸多生理代谢过程,还可参与电子传递,或作为酶促反应中心[2–3]。铁参与植物叶绿素的生物合成,缺铁会使叶绿体结构发育不完整,导致植株叶片缺铁黄化,光合能力下降,作物的产量和品质最终遭受巨大损失。植物作为人类主要的食物来源之一,土壤缺铁不仅严重降低了作物籽粒中的铁含量,还会导致人类的铁营养状况。我国患缺铁性贫血的男女性分别为14.9%、21.2%,城市中有12.3%的5岁以下儿童患有贫血,在北方偏远的农村这一现象则更为突出[4],其中膳食缺铁是人类贫血的重要原因。所以要改善人类的铁营养状况,减少我国城市及农村人口的贫血现象,最根本的还是要解决作物铁缺乏的问题。
面临植物缺铁这一严重现象,不仅要加强植物对铁的吸收和转运,更重要的是从源头治理,采取有效的方法缓解植物的缺铁胁迫,增强其对缺铁环境的适应能力。目前有关植物铁吸收和利用的分子生理机制、调控植物铁营养的相关基因与信号、植物铁生物强化等方面已有大量文献报道,且李俊成等[5]、段立红等[4]、申红芸等[6]、Briat等[7]、Zuo[8]等对以上方面的研究成果也作了较全面的综述。但目前为止还很少有人对植物应答缺铁胁迫所作出的生理反应和调控机制方面作出系统的综述。因此本文主要以植物铁吸收的生理机制为基础,重点阐述了植物如何响应缺铁胁迫,以及在缺铁应答过程中参与调控的相关基因与信号,并提出缓解植物缺铁胁迫、改善植物铁营养成分的有效途径。为深入探索更加有效地缓解铁缺乏的转基因技术及农艺措施提供了重要的理论依据和技术支撑。
1 植物铁吸收的分子生理机制
植物在不断的进化过程中已渐渐形成了一些缺铁适应机制,如适应性机理和非适应性机理。适应性机理受植物体内铁营养状况调控,主要包括机理Ⅰ与机理Ⅱ;非适应性机理就是可能存在的吞噬机理,不受植物体内铁含量的影响。
机理Ⅰ植物通常包括双子叶和非禾本科单子叶植物,如大豆、花生、向日葵、黄瓜等。这类植物主要通过以下三个过程来吸收铁 (Fe):1) H+-ATPase泵系统,该系统通过H+的分泌酸化根际土壤,降低pH值,增加土壤中铁的可溶性;在众多的H+-ATPase(HA) 基因中,一些HA基因的表达受缺铁胁迫诱导,可能与植物铁元素吸收机理Ⅰ的调控有关,例如拟南芥中的AHA2基因[9]及苹果属小金海棠中的MxHA7 基因[10]。2) Fe3+的还原,其中依赖 NADPH 脱氢酶的铁离子螯合还原酶 (ferric-chelate reductase oxidase, FRO) 可以将土壤中难溶解的 Fe3+还原成容易被植物体吸收利用的Fe2+,如模式植物拟南芥中的Fe3+螯合还原酶FRO2[11],这一过程作为机理Ⅰ植物铁吸收过程中的限速步骤,显得尤为重要。3) Fe2+的转运,这一过程涉及到一系列的铁转运蛋白 (iron regulated transporter, IRT),可以将由 Fe3+螯合还原酶还原的亚铁离子转运到细胞内,通过其他转运蛋白的作用又被输送到各个细胞器及器官中供植物生长发育所需,例如拟南芥中的铁转运蛋白基因IRT1[12](图1)。还有一些其他金属转运蛋白,如植物中的NRAMP1 (natural resistance associated macrophage protein 1),也被发现参与吸收土壤中的少量铁元素,但NRAMP对铁吸收的特殊机制还不是很清楚,有研究表明NRAMP依赖于其对铁特殊的亲和力以及其对自身与环境信号的应答反应[13]。然而在石灰性土壤中,这一适应性机理所涉及到的生理及分子调控过程因较高的pH值和HCO3-而受到了显著影响,导致石灰性土壤中的机理Ⅰ植物很容易出现缺铁黄化现象,所以如何有效地提高机理Ⅰ植物根系对铁的吸收及转运,从而缓解其所面临的缺铁黄化现象,成为国内外科学家需要关注的重点问题。
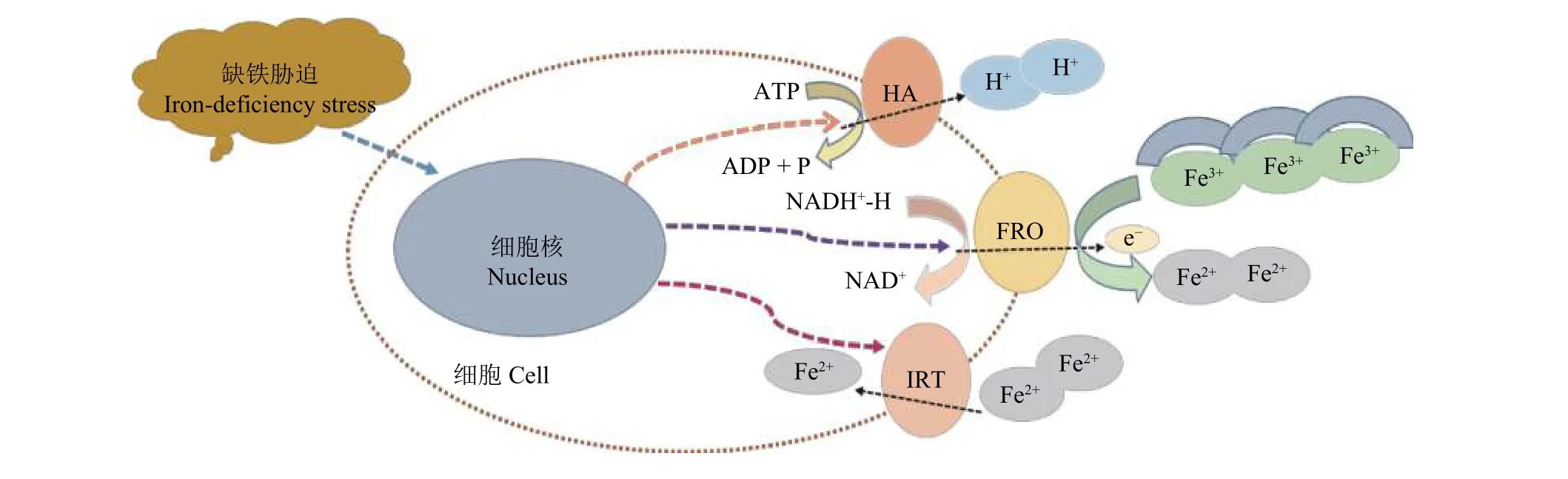
图1 机理Ⅰ植物根系铁吸收及响应缺铁胁迫的作用机理Fig. 1 Mechanisms of iron absorption and response to iron deficiency in strategy Ⅰ plant roots
机理Ⅱ植物主要为禾本科植物,如小麦、水稻、玉米等重要的粮食作物。缺铁条件下这类植物会通过合成与分泌麦根酸 (mugineic acid, MA) 类物质并螯合铁来满足对铁元素的需求,其对缺铁环境的适应主要通过两个关键步骤:第一,麦根酸类植物铁载体 (phytosiderophore, PS) 在植物体内合成后,经载体作用主动分泌到根际。烟碱酰胺合成酶 (nicotinic amide synthetase, NAS)、烟碱酰胺氨基转移酶(nicotinic amide aminotransferase, NAAT) 和双脱氧麦根酸合成酶 (double deoxymagenate synthetase, DMAs)等均是与麦根酸生物合成有关的酶。研究表明在植物根部麦根酸由S-腺苷甲硫氨酸 (S-adenosyl methionine, SAM) 经过这些酶的一系列酶促反应合成,并经 TOM1(transporter of mugineic acid family phytosiderophores 1) 蛋白分泌至土壤中[14–16]。第二,分泌到土壤中的植物铁载体与根际环境中的Fe3+发生螯合作用,形成植物铁载体与Fe3+的螯合物Fe (III)-PS并迁移到根系质膜,然后经过YS1 (yellow stripe 1)和 YSL (yellow stripe1-like) 等载体的特异性转运,直接被植物细胞所吸收,最终释放出Fe3+供植物体代谢利用[17–18](图2)。由于环境pH值的变化不会影响这一机制所涉及的诸多生理过程,因而石灰性土壤上的机理Ⅱ植物并没有表现出特别显著的缺铁症状。有些非典型的铁吸收植物可以同时采用两种机理吸收铁元素,如水稻既能通过OsYSL15转运蛋白转运Fe(III)-PS混合物,也能直接利用自身的Fe2+转运蛋白OsIRT1吸收土壤中的Fe2+[19]。此外,近年来发现植物吸收转运铁的机制,仅有机理Ⅰ和机理Ⅱ是不足以解释,Mori[20]在植物体内发现了转铁蛋白 (NRAMP)和血红蛋白,并表明在铁等金属离子的代谢过程中NRAMP基因家族起着关键的角色,从而提出植物中的铁吸收机制可能还包括一种新的吞噬机制。NRAMP基因在该机制中控制合成的一种全新的高亲和性转铁蛋白,能够主动结合吞噬Fe2+,然后将其转运并释放到细胞质中。最新研究表明,大豆植株中Fe、K等营养元素的缺乏会对NRAMP基因的功能进行不同程度的调控,此外还在大豆根瘤内发现了GmNRAMP的高度表达,并表明GmNRAMP基因能够对大豆根瘤中的Fe或其它金属离子进行转运[21]。然而关于NRAMP基因在植物体内或豆科植物根瘤中详细的调控机制还不是很清楚,仍需要进一步的探讨。
2 植物响应缺铁胁迫
植物经过漫长的进化,缺铁时自身能够诱导产生一系列响应机制来适应低铁环境,包括改变根部构型、增大吸收面积、诱导大量铁吸收相关基因的表达等[22]。其中根系结构的变化可以提高植物对铁的吸收,如单子叶和双子叶植物的根尖膨胀而变粗,生成更多的根毛,大量的转移细胞也相继从根的外表皮细胞和根毛中产生,明显促进了植物根部对铁的吸收能力;根尖主动向根系环境分泌大量的H+、有机酸、酚类等还原物质,从而增加外界环境中铁的可溶性;植物根尖表皮细胞原生质膜上的还原酶活性也因此提高[23]。对于机理Ⅰ植物而言,缺铁胁迫会显著诱导Fe3+螯合还原酶活性。地上部缺铁的诸多症状中,幼叶失绿最为常见,其叶绿体的发育迟缓导致形态结构异常,而叶绿素含量的减少使得植物的呼吸强度减弱,最终降低光合作用,提高光饱和点,光补偿点也随着植株不断缺铁失绿而逐渐升高。此外,铁作为诸如细胞色素氧化还原酶、过氧化氢酶、过氧化物酶、辅酶等许多酶的合成因素或激活剂,一旦缺失这些酶系统功能遭受损坏,植物的能量和物质代谢受到严重影响[24]。由此可见,缺铁胁迫对植物的形态及生理等方面都具有显著影响。
植物对铁元素的吸收主要通过两种不同的机理,因而在它们应对低铁环境时也会做出截然不同的应答反应。机理Ⅰ为双子叶植物和非禾本科单子叶植物,主要通过三个系统做出响应:质子及有机酸、酚类等小分子有机物质分泌系统、Fe3+还原酶系统、Fe2+转运系统。这三个系统均分布在形态发生特化的根尖表皮细胞的细胞质膜上,且对铁缺乏做出了有效的响应。即,1) H+-ATPase大量表达,使质子(H+) 不断渗入到根际土壤中,从而酸化根际环境,增加根际土壤中铁的可溶性及有效性,而且根部有机酸如酒石酸、丙二酸、反丁烯二酸、柠檬酸以及苹果酸的积累显著增加。此外,缺铁时拟南芥根系还会分泌一类次生代谢的酚类物质—香豆素类化合物[25–26]。2) 铁还原酶基因 (FRO) 表达上调,促进吸附在根表皮的 Fe3+还原成 Fe2+。Wu 等[27]和 Mukherjee 等[28]研究发现,缺铁胁迫能够强烈诱导根系Fe3+还原酶基因(FRO3) 的表达。最近,Grillet等[29]还发现 Fe3+进入种子的新途径,即种子胚分泌大量抗坏血酸盐将柠檬酸-苹果酸盐复合物中的 Fe3+还原为 Fe2+。3) Fe2+的转运体基因 (IRT) 大量表达,将被FRO还原成的Fe2+转运到根部细胞供植物体利用[30]。如黄瓜根系及叶片中的CsIRT1基因在缺铁时其表达均明显增强[31]。
机理Ⅱ主要为禾本科植物。这类植物能在缺铁时加快分泌一类对Fe3+有着较强亲和力的麦根酸类植物铁载体 (MAs) ,从而与Fe3+结合形成稳定的Fe3+螯合物 (Fe3+-MAs)。这一过程受到多种基因的调控,如MAs合成过程中的关键酶基因NAS[14]、NAAT[32]等及转运Fe3+-MAs结合蛋白的基因YS1基因[17]。Singh等[33]通过研发得到了表达OsNAS2或PvFERRITIN或两种基因都表达的小麦品系,并经试验表明这三种小麦品系所得籽粒中的铁含量显著高于普通小麦,对人类的膳食缺铁现象进行有效改善。有试验表明缺铁胁迫明显诱导了水稻根系与叶片中OsNAAT1的表达[34]。此外,TaNAAT1,TaNAAT2和TaDMAS因植物体内铁营养状态的不同而差异性表达[35]。
3 调控植物缺铁应答反应的相关基因
3.1 增强机理Ⅰ植物铁吸收的主要基因
人们通过试验逐步发现了酵母和植物铁吸收功能缺陷突变体,并利用异源或同源功能互补法,成功克隆出与植物铁吸收机制Ⅰ相关的许多关键性基因 (表 1)。
Fe3+螯合物还原酶基因FRO2最初是从缺铁诱导的拟南芥根系cDNA文库中筛选得到的,向Fe3+螯合物还原酶缺陷突变体 frd1中转入FRO2基因后,发现缺铁胁迫下的转基因植株根表皮的Fe3+螯合物还原酶活性明显增强,并预测转基因不仅使原来存在的还原酶活性恢复,可能还重新合成了新的还原酶[10]。到目前为止,已经逐步克隆出许多植物根系中的Fe3+还原酶基因,如花生AhFRO1、豌豆PsFRO1、黄瓜CsFRO1等[36–38]。豌豆Fe3+还原酶基因PsFRO1受缺铁信号的诱导,在根、根瘤及叶中都有表达,但在具有Fe3+还原系统及Fe2+转运蛋白的根表皮细胞中高度表达;而PsFRO1在根瘤固氮区的表达可能与植物的固氮作用密切相关[36]。最新研究表明,VIGS技术的使用能够沉默本生烟草中的FRO1基因,且经研究发现FRO1基因沉默或非沉默植物均因缺铁而褪绿,但在铁补充12天后,只有非沉默植物从铁缺乏中恢复过来,FRO1基因沉默植物仍然保持褪绿色,三价铁螯合还原酶活性与FRO1基因的表达也随着显著降低,从而阻止植物对铁的摄取[39]。
IRT也是一类与根部铁吸收相关的重要基因,在根部表达且受缺铁胁迫的诱导。植物中的第一条IRT基因是从拟南芥中获得的,因此被命名为AtIRT1,属于ZIP家族,这一基因也同样是利用酵母突变株功能互补实验克隆而得[12]。对IRT1的序列进行分析与定位,发现AtIRT1编码一个膜蛋白,通常在缺铁的拟南芥根系中表达,尤其是对缺铁敏感的根系外表皮细胞,另外在花的雄蕊中也检测到了AtIRT1,但其表达主要决定于植物的发育状况,而与铁营养状态无关[40]。此外,有研究发现拟南芥根系分泌物中的酚类化合物能够转化植物生长培养基中的不溶性Fe3+,但只有通过IRT1/FRO2高亲和Fe2+转运体系才能从中吸收这部分Fe3+[41]。
除了吸收Fe、Mn、Zn等养分外,IRT1基因还积极参与到植物光合作用的调节过程中。缺失IRT1功能的突变株,其栅栏组织消失,缺铁黄化现象明显,生长发育也受到严重限制。人们最初以为在模式植物拟南芥中决定铁吸收的基因只有IRT1,但随着IRT2和IRT3的逐步发现,尤其是对IRT2全长基因的克隆及其功能的初步研究才使人们对机理Ⅰ植物吸收铁的机制有了更加深入的理解,而且IRT2也可以恢复铁吸收酵母突变株的功能,但仅在根的幼嫩组织中检测到AtIRT2的表达,尤其是对缺铁胁迫较为敏感的根毛区。对植物进行缺铁1 h处理后,发现IRT1和IRT2在根部的转录水平均提高,但IRT1所提高的倍数明显高于IRT2。由此表明在机理Ⅰ中IRT1是植物运输Fe2+的关键基因[40]。
3.2 机理Ⅱ系统中参与调节铁缺乏的关键性基因
缺铁胁迫下,机理Ⅱ植物的根系通常会通过分泌麦根酸类植物高铁载体 (MAs) 来适应这一逆境胁迫。关于MAs的生物合成途径,目前已经非常清楚。L-蛋氨酸 (L-Met) 作为载体合成的前体,先与ATP一起形成S-腺苷甲硫氨酸 (SAM),然后在烟碱酰胺合成酶 (NAS) 的催化下形成烟碱酰胺 (NA),而NA则经过一系列步骤并通过烟碱酰胺氨基转移酶(NAAT) 等的催化再次形成脱氧麦根酸 (DMA),最后在双脱氧麦根酸合成酶 (DMAS) 的作用下转化为麦根酸 (MA) 和差向异构-3-羟基麦根酸 (Epi-HDMA)等麦根酸类植物高铁载体[35]。近年来,已有许多MAs合成途径中的关键酶基因被克隆并鉴定,如NAS[14]、NAAT[32]、IDS1-7、APRT、FDH、ADH[42]以及 YSL 基因[17](表 1)。
通过对缺铁胁迫大麦根系的cDNA文库进行等筛选,Higuhi等[14]得到了7个NAS基因;而Takahashi等[32]也筛选得到了NAATA、NAATB等4个NAAT基因。将NAATA和NAATB基因的大麦基因组片段采用农杆菌转化法转入水稻,观察发现水稻转化株遭遇缺铁胁迫时,其根茎部分的NAAT活性明显升高,并分泌出更多的高铁载体,耐低铁胁迫能力也有所增强。IDS1-7基因也被筛选得到,其中IDS1-3的序列已经过鉴定,且研究发现这3个基因的表达均受缺铁胁迫的诱导[43]。Itai等[44]还从中筛选到了腺嘌呤磷酸核糖转移酶基因 (adenine phosphoribosyl transferase gene, APRT),因腺嘌呤来自蛋氨酸循环,而蛋氨酸循环又与MAs的合成相关联,因此MAs的合成也会受蛋氨酸循环过程中关键酶的影响。甲酸脱氢酶 (formate dehydrogenase, FDH) 及乙醇脱氢酶 (alcohol dehydrogenase, ADH) 等基因也逐渐被克隆[42–44],植物经历长期的缺铁胁迫后可能会出现“生理性缺氧症”,这时FDH和ADH便可发挥作用来增加能量的合成。
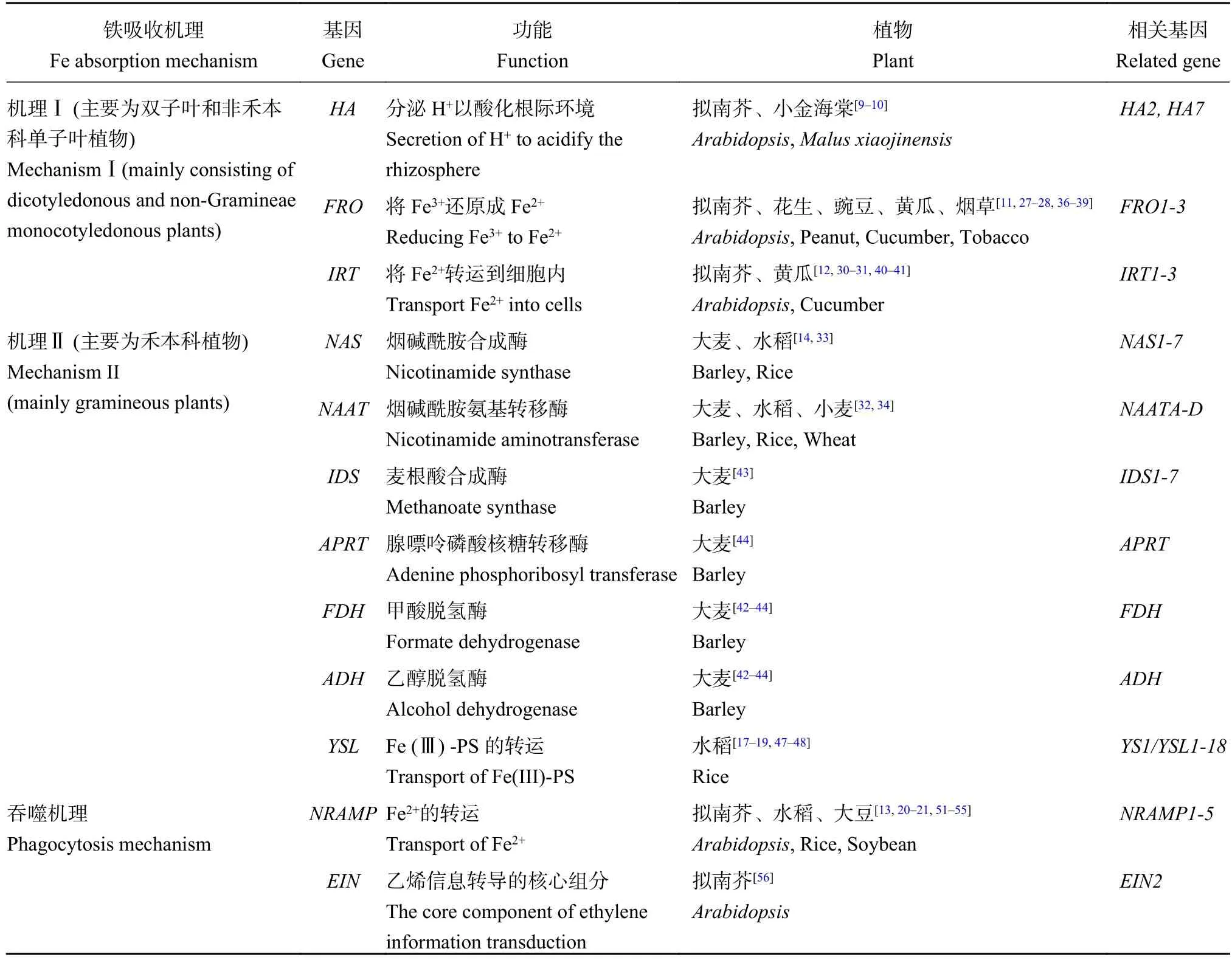
表1 不同铁吸收机理的植物缺铁调控基因Table 1 Major genes responsible for plant iron deficiency
虽然已成功克隆了MAs合成途径的大多数关键基因,但将Fe3+-MAs转运进细胞质的转运蛋白基因的克隆进程却很缓慢。早在1997年便有人发现玉米突变体ysl能够合成并分泌MAs但无法将其转运到细胞质中,便推断该基因很可能就是Fe3+-MAs转运蛋白基因,但因技术问题未能进行克隆[45]。将缺铁胁迫的大麦根系cDNA转入酵母突变体中来筛选转运蛋白基因的试验也未能获得成功[46]。直到2001年Curie等[18]才成功构建出缺铁胁迫的cDNA文库,并从中得到3条ysl- cDNA。之后又在水稻基因组中鉴定出18个假定的OsYSLs,并发现OsYSL2是水稻的一个金属-NA转运体,负责Fe和Mn在植物韧皮部的运输[47]。近来研究发现OsYSL9作为Fe(Ⅱ)-NA和Fe(Ⅲ)-MA的新型转运蛋白,主要负责植物内部铁运输,尤其是从发育种子中的胚乳到胚胎[48]。
3.3 可能存在的吞噬机理涉及到的重要基因
可能存在的吞噬机制中主要涉及转铁蛋白基因及 NRAMP 基因家族 (表 1)。Bereczky等[49]认为NRAMP1 编码的一种完整膜蛋白的结构可能与已知的同源性原核和真核运输系统相似,但这种转运功能尚不清楚,NRAMP1的发现引起了广泛学者对这一膜蛋白的关注。
Ttf-p150是一种经高盐缺铁诱导产生,且由Fisher等[50]在绿藻中首次发现的除动物界之外,存在于质膜上的植物类转铁蛋白,即使在3.5 mol/L NaCl的高盐胁迫下,这种蛋白也能使植物的摄铁效率提高2~3倍,并经试验证明它是以吞噬方式吸收转运Fe3+。
最早在酵母和哺乳动物中发现了NRAMP基因家族,而该基因家族在植物中的研究尚未普遍展开,主要集中于拟南芥、水稻和番茄等几种植物。Belouchi等[51]克隆了水稻的第1个NRAMP基因,并将外源植物NRAMP基因采用异源功能互补法转入突变体中,其表型的恢复充分验证了植物NRAMP基因的功能。酵母铁离子吸收转运高、低亲和系统双突变体fet3、fet4和锰离子吸收突变体smf1的缺陷株表型可以通过AtNRAMP1, 3, 4和OsNRAMP1的表达得以弥补,而AtNRAMP2和OsNRAMP2则不能,说明这两个基因可能不编码铁的转运蛋白[52]。
在35S强启动子的引导下,AtNRAMP1在拟南芥中过量表达并增强拟南芥抗铁毒的能力,表明AtNRAMP1能够对细胞质中游离态Fe2+到质体或液泡等细胞器的转运进行调节,而AtNRAMP2不能对铁吸收酵母突变株的功能进行有效恢复,可以进一步探索其具体的生理功能及机制。有关NRAMP基因家族的研究,在植物中广泛集中于AtNRAMP3,缺铁往往会使AtNRAMP3的表达上调,但研究发现即使在供铁条件下,根茎叶的维管组织中仍然有大量的AtNRAMP3表达,由此表明AtNRAMP3很有可能参与了金属离子在植物体内的长距离运输[53]。此外研究发现,与AtNRAMP3的功能完全相似,AtNRAMP4对于低铁条件下种子的萌发也是必不可少的,且编码的蛋白都位于液泡膜上,因此两者在缺铁胁迫时均可以再利用贮藏于液泡中的铁来满足种子的萌发,直到植物能够正常有效地吸收土壤中的铁[54]。近来已有研究确认,OsNRAMP5有助于水稻中Fe的转运,对植物的生长和发育非常重要[55]。
Alonso等[56]克隆了植物乙烯信息转导的核心组分-EIN2 (Ethylene-insensitive 2) 基因,并经序列分析表明该基因属于膜整合蛋白,与NRAMP基因家族有着21%的相似性,因此猜测EIN2很有可能是一种金属离子转运蛋白基因。
4 感应植物铁缺乏的相关信号
4.1 植物激素及气体信号分子响应缺铁胁迫
经研究发现参与植株缺铁胁迫的植物激素、气体信号分子可能是缺铁应答信号 (图3)。OsARF16作为一种调节生长素再分配的转录因子,可以修复许多由缺铁引发的症状,如植株矮小、光合作用降低、铁含量减少及根系结构变化等,进而增加缺铁水稻的铁营养[57]。而且研究发现外源生长素 (auxin)可以促进植株体内NO积累,说明生长素可能在NO信号途径上游调节植株对铁的吸收[58–59]。赤霉素(GA) 通过正向调节 bHLH038、bHLH039、FRO2、IRT1等铁相关基因的表达来适应铁缺乏,但不能诱导FIT表达[60]。最新研究结果表明缺铁胁迫下,赤霉素信号传导阻遏蛋白DELLA在植物根部的分生组织中发生积累,从而排除根部分生区的表皮细胞,与FIT、bHLH38及bHLH39等转录因子共同作用促进铁吸收[61]。一定浓度的外源脱落酸 (ABA) 处理降低了与果胶和半纤维素结合的根系质外体铁含量,却显著提高植株地上部的铁含量,从而缓解缺铁引起的黄化现象;同时还通过促进酚类物质的分泌及上调AtNRAMP3基因的表达,释放质外体中的Fe并增强液泡中Fe的再利用,最终导致根中可溶性铁含量的升高[62]。水杨酸 (SA) 与NO互作可以促进缺铁环境下落花生对铁的吸收、转运及活化,调节植物体内矿物质元素的平衡,减轻由铁缺乏诱导产生的氧化刺激[63]。NO 供体硝普钠 (sodium nitroprusside,SNP) 和SA不同的配施组合能够通过各种不同的机制来缓解花生缺铁引起的萎黄症,如提高叶片有效铁和叶绿素含量,提高抗氧化酶活性,调节矿物元素平衡等[64]。
细胞分裂素 (CTK) 对根部铁吸收基因的调节不仅与铁营养状态无关,更不受FIT的介导,也不能使铁调控基因AtNRAMP3和AtNRAMP4的表达下调,而是通过一种根系生长-依赖型途径来抑制IRT1、FRO2及FIT的表达,从而控制根部的铁吸收机制[65]。在缺铁条件下,拟南芥的乙烯 (ETH) 突变体erf4中的叶绿素含量升高,而叶绿素降解相关基因AtPAO和AtCLH1的表达降低,另外根中的铁还原酶活性也显著高于野生型植株,铁吸收相关基因AtIRT1和AtHA2也呈现出高水平表达,最终表明AtERF4作为铁缺乏响应的负调控因子,在植物发生缺铁胁迫时发挥着重要作用[66]。研究发现缺铁胁迫下植物释放的ETH也能够激活AtERF72的表达,而AtERF72则通过直接与缺铁响应基因IRT1、HA2及CLH1的启动子区域结合对缺铁反应作出负向调控[67]。茉莉酸(JA) 同样是铁吸收的负向调控因子, 它可能独立于FIT基因,直接通过抑制IRT1和FRO2基因的表达来调控缺铁应答反应[68]。最新研究表明,对水稻野生型植株外源应用油菜素甾醇 (BR) 会使缺铁症状更加明显,植物生长受到影响,茎中OsNAS1、OsNAS2、OsYSL2等基因的表达下调、韧皮部中铁的转运也因此受到抑制[69]。
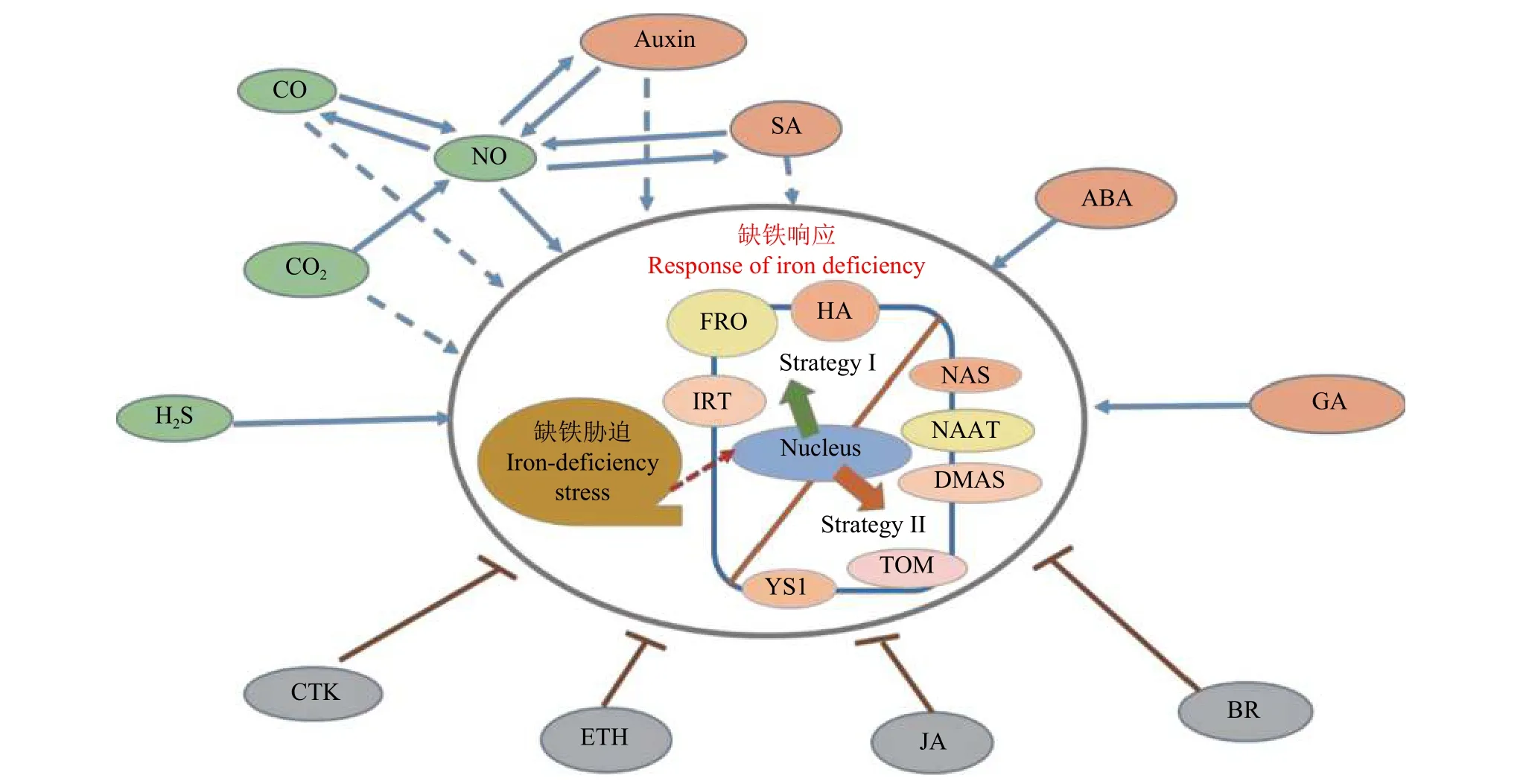
图3 植物激素与气体信号分子对植物响应铁缺乏的作用机制Fig. 3 Mechanisms of plant hormones and gas signaling molecules in response to iron deficiency in plants
在铁含量充足的条件下,NO并不能诱导番茄根系产生缺铁相关响应;但缺铁条件下,根表皮细胞NO含量明显提高[70]。SNP的施加显著促进铁在花生植株细胞壁、细胞器等部分的吸收,增加了有效铁及叶绿素的浓度,并减缓植株在缺铁时对Mn、Cu等重金属的过量吸收。此外,SNP还明显增强了超氧化物歧化酶、过氧化物酶及过氧化氢酶的活性,从而抑制丙二醛与活性氧的积累[71]。NO清除剂cPTIO (carboxy-PTIO) 的施用则完全抑制了植物受到缺铁诱导时根毛的形成及根系铁含量的增加,降低了铁螯合还原酶的活性和根系H+的分泌量,使铁相关基因FIT、MxFRO2-like和MxIRT1的上调表达受到影响,从而降低幼叶和根中的活性铁含量[72]。高浓度的CO2不仅能够增强三价铁还原酶活性、质子分泌及FER、FRO1、IRT等基因表达,还会导致番茄中NO的积累,最终促进其对缺铁胁迫的应答反应[73]。对拟南芥外源施加一定浓度的CO能够阻止因缺铁诱导产生的植株萎黄,增强叶绿素累积及缺铁幼苗中AtIRT1、AtFRO2、AtFIT1、AtFER1等铁吸收相关基因的表达,此外CO也能对单子叶植物如玉米体内的铁平衡进行调节;试验同时表明,CO还可诱发植物根尖NO的积累,而NO清除剂cPTIO的应用却抑制了CO作用效果,因此表明在缺铁胁迫下,CO可能通过调控NO信号分子来改善植物适应铁缺乏环境[74]。近来也确有研究表明,在拟南芥中CO、NO与生长素通过彼此间的信号转导作用共同应对植物缺铁胁迫[75]。新型气体信号分子H2S则通过增强缺铁环境下玉米幼苗叶片中ZmIRT1、ZmFRO1及ZmYS1等铁吸收与调控相关基因的表达,促进根部有机酸的分泌和影响铁在植物组织中的积累,进而缓解缺铁胁迫的所导致的叶绿体合成受阻和光合作用下降的症状[76](表 2)。
4.2 缺铁反应性microRNAs
microRNAs (miRNAs) 是近年来在细胞中发现的一类内源非编码蛋白的单链小分子RNA,其长度约为 20~24 nt,广泛存在于动植物和病毒中,主要通过降解靶基因mRNA或与mRNA结合,从而抑制蛋白翻译的过程来发挥作用。miRNAs的主要功能有响应环境胁迫[77]、参与植物激素的调节和信号转导[78]、调控植物的生长发育[79]及营养平衡[80–81]。目前在动物中已有很多报道表明microRNAs参与了铁稳态的调控[82–83],而在植物体内关于microRNAs调节铁平衡的研究较少。2010年Kong等[84]在拟南芥中通过构建缺铁响应的microRNAs文库,鉴定出8个在缺铁条件下有差异表达的microRNAs。近年来又有研究者在拟南芥中发现了22个靶向15个缺铁响应基因的microRNAs,并表明其中有17、10和4个microRNAs启动子中包含缺铁响应元件IDE1、生长素响应元件和乙烯响应元件[85](表 2)。
5 缓解植物缺铁胁迫的有效途径
5.1 利用铁吸收相关基因的转导提高植物铁含量
铁蛋白 (ferritin, Fer) 不仅可以合成含铁的蛋白质,还能保护细胞免受铁过量引起的氧化损伤,防止自由基的产生。因此可利用转基因技术将外源FER基因导入植物基因组提高植物体内的铁含量。例如Goto等[86]通过农杆菌介导法,在水稻胚乳中用胚乳特异启动子OsGluB1表达大豆铁蛋白基因SoyFERH1,显著提高了胚乳及T1代种子中的铁含量。最新研究结果也表明AtIRT1、AtNAS1和PvFER的协同表达可以增加水稻中的铁含量,是一种更为有效的生物强化措施[87]。
将铁吸收及转运过程中的相关基因导入植物也可提高植物组织中的铁含量。如Robinson等[11]将FRO2基因转入Fe3+还原酶缺陷的拟南芥突变体后,转基因植株中Fe3+还原酶的活性得以恢复。针对水稻吸收利用铁生物学机制的特殊性,Suzuki等[88]将大麦中能够高效合成和分泌麦根酸类植物铁载体的基因,如HvNAS、HvNAAT和HvIDS3转入水稻中,极大地提高了水稻的麦根酸合成和分泌能力,而且转入HvIDS3基因的水稻子粒中铁含量显著增加。
5.2 控制铁吸收抑制及促进因子增强铁的生物有效性
植酸能与Fe2+、Mn2+等金属元素络合形成不易被人体吸收的植酸盐沉淀,从而降低营养元素的生物有效性[89]。采用诱变法筛选低植酸突变体是培育低植酸作物的有效措施。应用化学诱变获得的玉米低植酸突变体lpa1-1和lpa2-1籽粒中的植酸含量分别下降了66%和50%[90]。水稻、大豆和大麦等作物的低植酸突变体也在近年来通过诱变法陆续获得[91–93]。而植酸酶能够在种子萌发过程中催化植酸水解为无机磷和肌醇。动物和人体研究均表明,内外源植酸酶都可降低饮食中的植酸含量,并提高铁的生物利用效率[89]。如植酸酶在小麦胚乳中的转基因表达,使植物中的植酸酶活性增强,并降低了小麦种子中的植酸含量,从而提高谷物中Fe和Zn的生物利用度[94]。
饮食中的氨基酸可以促进铁的吸收,尤其是半胱氨酸或富含半胱氨酸的多肽。Lucca等[95]为了增加饮食中半胱氨酸的含量,把一个富含12个半胱氨酸残基的金属硫因类似蛋白 (cysteine-rich metallothioneinlike protein) 基因导入水稻胚乳,结果发现该金属硫因类似蛋白在水稻胚乳中过量表达,并使半胱氨酸含量比正常水平提高10倍。将NA合成酶基因OsNAS1在水稻种子中特异超表达后获得了NA高积累的转基因水稻,其籽粒的铁吸收效价更是原始品种的2倍[96]。
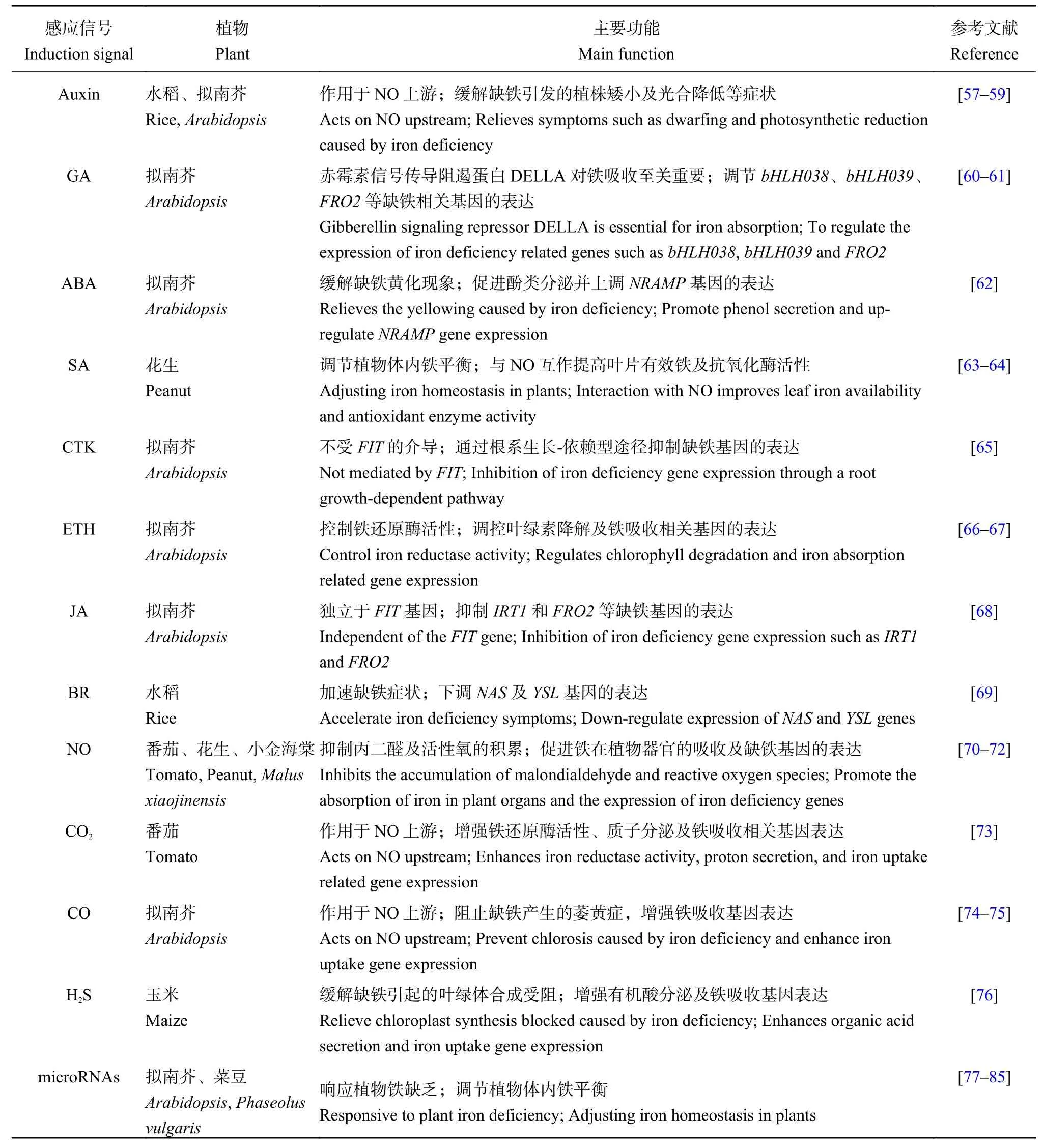
表2 植物感应铁缺乏的相关信号Table 2 Signals in plants responding to iron deficiency
5.3 采用农艺措施等改善植物铁营养
通过施用土壤改良剂、喷施铁肥、种子引发技术、作物间作等农艺措施能够改善作物的营养状况。其中,喷施铁肥能够快速、有效地提高作物中的铁含量及其生物有效性。He等[97]通过试验发现不同铁肥的施用均能提高精米中的铁含量和生物有效性,且DTPA-Fe的效果最为显著。石灰性土壤上铁高效机理Ⅱ植物与铁低效机理Ⅰ植物的间作能有效改善机理Ⅰ植物的铁营养,因为机理Ⅱ植物不仅能通过合成及分泌铁载体满足自身对铁的需求,更重要的是能够显著影响间作机理Ⅰ植物根系对铁的吸收和转运[98]。如玉米/花生在石灰性土壤上的间作可以提高玉米麦根酸的分泌量和花生活性铁含量,同时在缺铁敏感时期,花生AhFRO1和AhIRT1基因显著上调,使其铁还原酶活性提高,从而促进间作花生对铁的吸收及转运,并显著提高花生子粒中的铁含量。而且对于豆科植物花生而言,铁营养的改善还有利于根瘤的形成及固氮能力的提高[98–99],表明一些合理的农艺措施,如喷施铁肥及间作作物合理搭配而充分挖掘和利用植物间互惠互利的遗传潜力,对加强作物铁的吸收和利用具有重要的指导和实践意义。
6 研究展望
迄今为止,植物铁吸收机制研究已经取得了较大的进展,并克隆了大量关键性基因,对其作用也有了初步的实验证据。对有关植物缺铁胁迫的响应及改善植物铁营养也有了一定的了解,但还需对以下几个方面进行更深入、更全面的研究:1) 植物铁吸收机理Ⅰ和机理Ⅱ的具体过程及涉及到的相关基因已经相当清楚,但目前对于Moil所提出的吞噬机制还不是很了解,其中起关键作用的NRAMP基因究竟是如何吸收并转运铁元素的还需要进一步的试验验证,而血红蛋白是否也在这一过程中发挥作用,也要进行深入的研究。2) 虽然已发现了诸多如植物激素、气体信号分子等缺铁胁迫感应信号,但对于激素之间、信号分子之间以及激素与信号分子之间是如何相互作用缓解铁胁迫的还有待于进一步的探索。此外,除拟南芥之外的机理Ⅰ植物和禾本科植物中是否存在响应缺铁的microRNAs,这些microRNAs
又是如何通过调控信号分子或转录因子对缺铁胁迫作出响应的还不是很清楚。3) 尽管目前已有多种途径可以对铁营养成分进行改善,调节植物体内铁平衡,但还需继续对抗铁胁迫基因型品种进行筛选,因为筛选抗逆性强的基因型植物已成为克服植物铁胁迫的根本途径;开发转铁蛋白基因作物的新品种也将成为一种新的研究趋势。最终达到提高植物铁营养效率,从而改善人类铁营养的目的。

