硫磺菌多糖的分离纯化及体外抗氧化、抗肿瘤活性初探△
胡亚平,王锦,郑丽,田新利,代玲,林玲辉,王立安
(1.邢台医学高等专科学校,河北 邢台 054000;2.河北师范大学生命科学学院,河北 石家庄 050024)
硫磺菌(Laetiporussulphureus)又名黄芝、硫磺多孔菌、硫色多孔菌,独立或者呈簇生长于腐烂的落叶或针叶树种的原木、树桩和树干上,是一种有重要利用价值的食用兼药用真菌,广泛分布于欧洲、亚洲和北美洲的美国[1]。张津等优化了从硫磺菌子实体中提取水溶性多糖的提取工艺[2];Lung M Y.从硫磺菌菌丝体和发酵液中分别提取胞内多糖和胞外多糖,发现它们均具有一定的抗氧化活性[3];闫梅霞等发现硫磺菌菌丝体粗多糖对小鼠Lewis肺癌具有一定的体内抑制作用,最大抑制作用达到了35.7%[4];王娟等发现硫磺菌摇瓶发酵液的乙酸乙酯提取物对8种植物病原菌、1种霉菌、7种细菌都有较为显著的抗菌作用[5]。目前对于硫磺菌多糖的研究相对较少,特别是关于硫磺菌多糖的纯化和结构的研究还鲜见报道。
本实验室前期已完成了硫磺菌野生菌种的驯化。本实验以实验室培育的硫磺菌子实体为材料提取粗多糖,进行分离纯化,并对纯化后的多糖进行了理化特性的研究,以及体外抗氧化活性和抗肿瘤活性的初步探究,以期为硫磺菌多糖的进一步研究和开发提供科学依据。
1 材料与方法
1.1 材料与试剂
硫磺菌子实体,由河北师范大学真菌生化与分子生物学实验室种植;人胃癌BGC823细胞株,保存于河北师范大学真菌生化与分子生物学实验室,液氮冻存,按常规方法传代培养。
1,1-二苯基-2-三硝基苯肼(DPPH)、2,6-二叔丁基对甲酚(BHT)、噻唑蓝(MTT)、二甲基亚砜(DMSO)、顺铂(DDP),北京索莱宝科技有限公司;胎牛血清、RPMI1640培养基,浙江天杭生物科技公司;实验室用水均为超纯水,其余所用试剂均为分析纯。
1.2 主要仪器设备
VERTEX 70傅立叶变换红外-拉曼-红外显微镜联用光谱仪,德国布鲁克;S-4800冷场发射扫描电子显微镜,日本日立;BioLogicLP 色谱系统,Bio-RAD公司;MULTISKAN GO酶标仪,Thermo美国。
1.3 硫磺菌多糖的制备及分离纯化
1.3.1 粗多糖的制备 新鲜硫磺菌子实体,烘干机干燥,粉碎后得到硫磺菌子实体干粉,称重得质量m1,向其中加蒸馏水加热浸提三次(液料比20 mL·g-1,80 ℃,4 h),真空抽滤,合并滤液,旋转蒸发仪60 ℃浓缩,将得到的浓缩液采用Sevage法除蛋白[6],弃掉有机相和蛋白层,得到水相层,重复脱蛋白操作直至无蛋白层析出。向收集的水相层加入4倍体积无水乙醇,于4 ℃冰箱静置醇沉过夜,4 000 r·min-1离心20 min,真空冷冻干燥,得到硫磺菌粗多糖(LSPS),称重得质量m2。按公式(1)计算LSPS得率。
LSPS得率(%)=m2/m1×100%
(1)
1.3.2 DEAE-52柱色谱 取硫磺菌粗多糖150 mg溶于10 mL蒸馏水中,配成15 mg·mL-1的多糖水溶液,进行DEAE-52离子交换柱色谱,所用色谱柱规格为1.5 cm×23 cm。以0、0.1、0.3、0.5、0.7 mol·L-1的NaCl溶液进行梯度洗脱,控制流速为2.5 mL·min-1,以4 mL/管收集洗脱液,使用苯酚-硫酸法进行多糖显色,并在 490 nm下测量其吸光度,直到无多糖组分流出,共收集60管。以洗脱管数为横坐标,吸光度为纵坐标绘制洗脱曲线图,合并洗脱峰部分,60 ℃浓缩,-20 ℃真空冷冻干燥后置于-20 ℃冰箱中保存备用。
1.4 扫描电镜观察
取适量冻干的多糖样品粉末,通过双面胶粘在样品台上,清除多余的不能被粘附在样品台上的粉末,使得样品台上只保留一层薄薄的待测样品。喷镀金原子,用扫描电子显微镜观察样品表面并拍照。
1.5 葡萄糖标准曲线的绘制及多糖含量的测定
1.5.1 葡萄糖标准曲线的绘制 采用苯酚硫酸法,参考文献方法[7]稍做改动。用蒸馏水配制10 mg·mL-1的葡萄糖标准液。取10只100 mL容量瓶,分别加入0、0.2、0.4、0.6、0.8、1.0、1.2、1.4 mL葡萄糖标准液,定容至刻度。各取2 mL样品放入试管内,分别加入5%苯酚溶液1 mL,浓硫酸5 mL,混匀。冷却至室温后,用酶标仪于490 nm处测吸光度值,以吸光度值(Y)为纵坐标,葡萄糖含量(μg·mL-1,X)为横坐标,绘制葡萄糖标准曲线。得到标准曲线方程式为Y=aX+b。
1.5.2 多糖含量的测定 用蒸馏水配制一定浓度的多糖溶液,浓度为w(μg·mL-1),取1 mL的多糖溶液用上述的硫酸苯酚法检测,得到吸光度值A1。按公式(2)计算多糖含量。
多糖含量(%)=(A1-a)/wb×100%
(2)
式中:A1为用苯酚硫酸法测定的吸光度值;a、b 为葡萄糖标准曲线公式中的系数值;w 为多糖溶液浓度(μg·mL-1)。
1.6 红外光谱扫描
取2 mg 左右干燥的多糖样品,与 300 mg左右KBr粉末,红外灯下在玛瑙研钵中轻轻研匀压片,进行红外光谱扫描,扫描范围4000~400 cm-1。
1.7 氢谱分析
取多糖10 mg左右,溶于0.5 mL重水(D2O)中,用600 MHz核磁共振仪测定。
1.8 体外抗氧化、抗肿瘤活性测定
1.8.1 抗氧化活性 采用DPPH自由基(DPPH·)清除能力的测定法,参考文献方法[8]稍做改动。用无水乙醇配制0.2 mol·L-1DPPH·工作液,将待测多糖配成不同浓度的样品液,以同一浓度BHT为阳性对照,依次向96孔板中加入100 μL不同浓度的样品液,100 μL的DPPH工作液,室温下暗反应震荡30 min,酶标仪测定517 nm处的吸光度值A。按公式(3)计算DPPH·清除率。
清除率(%)=[A0-(Ai-Aj)]/A0×100%
(3)
式中:Ai为100 μL DPPH·工作液+100 μL 样品液的OD517;Aj为100 μL 无水乙醇+100 μL 样品液的OD517;A0为100 μL DPPH·工作液+100 μL 蒸馏水的OD517。
1.8.2抗肿瘤活性 采用MTT 法,参考文献方法[9]稍做改动。用RPMI 1640将待测多糖配成不同浓度的多糖样品液,以同一浓度顺铂为阳性对照。取对数生长期的BGC 胃癌细胞,以1×105个·mL-1细胞浓度接种于96孔培养板中,每孔加入100 μL,于二氧化碳培养箱(5% CO2,37 ℃)培养24 h 后,加入100 μL多糖样品液,阴性对照组中加100 μL的无血清培养基,并设空白孔。培养48 h后,离心弃去上清,每孔加100 μL MTT(1 mg·mL-1),继续培养4 h后,离心(2 000 r·min-1,10 min)弃上清,每孔加二甲基亚砜 150 μL,震荡10 min,用酶标仪检测570 nm 的吸光度值A。按公式(4)计算癌细胞增殖抑制率。
癌细胞增殖抑制率(%)=(1-As/A0)×100%
(4)
式中:As为实验组吸光度值;A0为空白对照组吸光度值。
1.9 数据处理
本实验进行三次平行实验,测定结果以平均值±标准差(SD)表示,数据分析采用originpro 7.5、 MestReNova软件和IC50软件。
2 结果与分析
2.1 多糖的制备及分离纯化
从40 g硫磺菌子实体干粉中得到的硫磺菌粗多糖(LSPS)为2.82 g,计算得粗多糖得率为7.05%。
采用DEAE-52离子交换柱对LSPS 150 mg进行分离纯化,梯度洗脱曲线如图1所示。用水和不同浓度的NaCl溶液洗脱,共得到三个洗脱峰,合并各洗脱峰组分,分别对其减压浓缩,冷冻干燥后共收集得到3个纯化后的多糖组分,分别命名为LSPS-Ⅰ、LSPS-Ⅱ和LSPS-Ⅲ,其中LSPS-Ⅰ为水洗脱得到,共获得36 mg;LSPS-Ⅱ和LSPS-Ⅲ分别为0.1 mol·L-1NaCl和0.3 mol·L-1NaCl洗脱得到,分别获得24 mg和4 mg。计算得LSPS-Ⅰ、LSPS-Ⅱ和LSPS-Ⅲ的得率分别为24%、16%和2.7%。因为LSPS-Ⅲ含量太少后续未对其做进一步研究,仅对LSPS-Ⅰ和LSPS-Ⅱ进行了研究。

图1 硫磺菌粗多糖经DEAE-52离子交换柱的梯度洗脱曲线
2.2 物理性状和扫描电镜观察
图2是LSPS-Ⅰ和LSPS-Ⅱ的电子显微镜扫描结果,给出了多糖样品的表面结构特征。
冷冻干燥后的多糖组分LSPS-Ⅰ呈现白色透明冰晶状,1万倍放大后在扫描电镜下形态如图2 A 所示,呈透明玻璃状,其表面光滑,并伴有一些小的凹槽;冻干后的LSPS-Ⅱ呈现白色粉末状,1万倍放大后在扫描电镜下形态如图2 B所示,呈不规则的砖块状。可见LSPS-Ⅰ和LSPS-Ⅱ为两种不同的多糖。

图2 LSPS-Ⅰ和LSPS-Ⅱ的扫描电镜图
2.3 葡萄糖标准曲线及多糖含量
以葡萄糖溶液的浓度为横坐标,490 nm吸光值为纵坐标,绘制标准曲线,数据处理后得标准曲线回归方程:Y=0.008X-0.030,r=0.997。实验表明葡萄糖浓度在0~120 μg·mL-1范围内,吸光度与葡萄糖浓度呈良好的线性关系。通过葡萄糖标准曲线方程,计算得到,硫磺菌粗多糖(LSPS)的多糖含量为(39.13±1.02)%。经过DEAE-52色谱柱得到纯化的硫磺菌多糖LSPS-Ⅰ和LSPS-Ⅱ,分别为(85.43±1.23)%和(80.12±1.19)%。此结果表明,经过DEAE-52纤维素色谱柱的纯化,硫磺菌多糖的纯度有了明显的提高。
2.4 IR分析
LSPS-Ⅰ和LSPS-Ⅱ的红外光谱仪扫描结果见图3。由图 3 可知,LSPS-Ⅰ在3 421 cm-1处有一明显吸收峰,此为多糖特征性O-H的伸缩振动峰,是由糖分子内或分子间氢键O-H伸缩振动而引起的吸收,形宽且钝,说明羟基不是游离的,而是在分子间发生了缔合[10];2 927 cm-1附近的吸收峰为次甲基(-CH2)中-C-H的伸缩振动的吸收峰;1 652 cm-1附近的吸收峰为 C=O 伸缩振动峰[11];1 419 cm-1附近的吸收峰可能是由-COOH中的C-O键伸缩振动或是C-H键的反对称伸缩振动和变角振动引起的[12];1 020 cm-1附近的吸收峰是由C-O-H和吡喃糖环的C-O-C中的两种C-O键的伸缩振动引起的[13]。
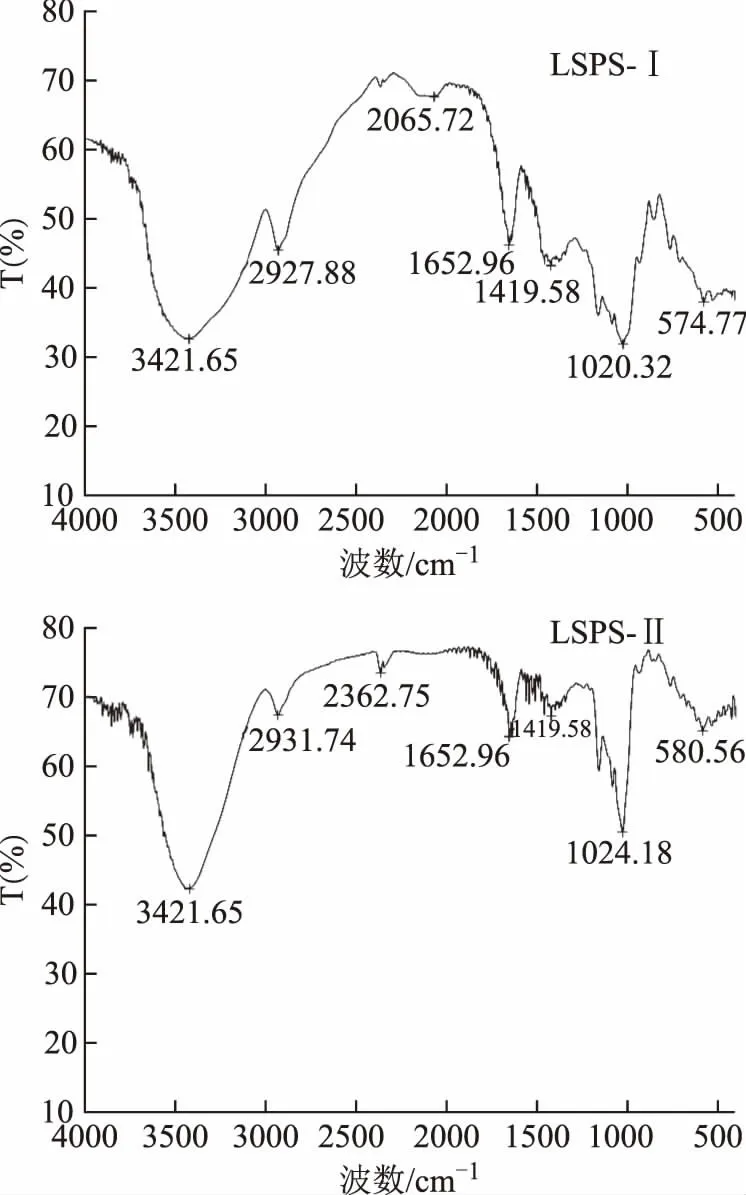
图3 LSPS-Ⅰ和LSPS-Ⅱ的红外光谱图
LSPS-Ⅱ在3 421 cm-1处有吸收,这是 O-H 伸缩振动,与 LSPS-Ⅰ 相似,说明羟基在分子间缔合;2 931 cm-1附近的吸收峰为C-H 伸缩振动;1 652 cm-1附近的吸收峰为 C=O 伸缩振动峰;1 419 cm-1附近有与LSPS-Ⅰ相似的吸收峰;1 024 cm-1附近有与LSPS-Ⅰ相似的吸收峰。
综上所述,由红外图谱可知LSPS-Ⅰ和LSPS-Ⅱ均具有明显的糖类化合物的特征。
2.5 1H-NMR分析
LSPS-Ⅰ和LSPS-Ⅱ的1H-NMR分析见图 4。1H-NMR主要解决多糖结构中糖苷键构型及结构中氢个数比的问题,但是由于非异头质子化学位移δ相近,且有部分重叠现象,使多数质子信号较难解析,一般β型异头质子区域化学位移位于δ4.4~5.0,α型异头质子区域化学位移位于δ5.0~5.5[14]。LSPS-Ⅰ的1H-NMR 信号中有δ5.35、5.17和5.14,LSPS-Ⅱ的1H-NMR 信号有δ5.39,LSPS-Ⅰ和LSPS-Ⅱ的1H-NMR信号均集中在δ5.0~5.5可见这两种多糖均存在α-糖苷构型异头氢。图4中化学位移在δ3.4~4.2之间的信号主要是糖残基上 C2-H 到 C6-H 的信号位移峰[15]。综上分析结果表明,LSPS-Ⅰ和LSPS-Ⅱ均为主要以α构型链接的多糖。

图4 LSPS-Ⅰ和LSPS-Ⅱ的核磁共振氢谱图
2.6 对DPPH·的清除活性
由图5可知,LSPS-Ⅰ和LSPS-Ⅱ与标准抗氧化剂BHT比较,对DPPH·均有一定的清除活性,两种多糖在设定浓度范围内,随着样品浓度增大,清除率相应提高,当样品浓度为6 mg·mL-1时,LSPS-Ⅰ和LSPS-Ⅱ的DPPH·清除率分别为(40.64±0.37)%和(35.49±2.79)%,但阳性对照BHT在浓度1 mg·mL-1时,DPPH·清除率已经达到79.82%。计算得,LSPS-Ⅰ和LSPS-Ⅱ对DPPH·清除率的EC50值分别为10.74和15.67 mg·mL-1,LSPS-Ⅰ对DPPH·的清除活性优于LSPS-Ⅱ。
2.7 MTT
通过检测发现LSPS-Ⅰ对 BGC 细胞增殖无抑制效果,LSPS-Ⅱ对 BGC 细胞增殖的抑制效果见图6,与标准抗肿瘤药物顺铂DDP比较,对BGC细胞有一定的抑制作用,在设定浓度范围内,随着样品浓度增大,抑制率相应提高,当LSPS-Ⅱ在浓度1000 μg·mL-1对 BGC 的抑制率达到了(55.64±1.37)%,其IC50值为 848 μg·mL-1,表现出很强的体外抗肿瘤活性。

图5 LSPS-Ⅰ和LSPS-Ⅱ对DPPH·的清除作用

图6 LSPS-Ⅱ对BGC细胞的抑制作用
3 讨论和结论
硫磺菌作为一种珍贵的食药用真菌,本实验室已完成对其的野生驯化并高产栽培。本研究首次从自行栽培的硫磺菌中得到了两个多糖组分LSPS-Ⅰ和LSPS-Ⅱ。由于在多糖纯化中色素和蛋白质等杂质会对其的分离造成干扰,所以在分离前期一般进行除色素和蛋白的操作。本实验提取得到的硫磺菌粗多糖本身颜色为白色无色素干扰,所以后期只进行了Sevage法除蛋白的操作。
由于多糖的分子结构等与其生物学活性具有密切的关系,弄清多糖的结构可以更深入的揭示其在生命过程中的作用[16]。多糖结构的检测手段有很多,本实验主要采用 SEM 观察了LSPS-Ⅰ和LSPS-Ⅱ的物理结构,采用苯酚硫酸法检测了它们的多糖纯度,对于多糖纯度的检测,由于目前尚未找到比较合适的标准品,因此通过各种方法得到的多糖纯度仍是比较粗略的结果[17]。采用 IR 和1H-NMR 分析了它们的糖键结构,表明LSPS-Ⅰ和LSPS-Ⅱ均具有糖类物质的吸收峰且为α构型。
本实验采用清除DPPH·实验评价LSPS-Ⅰ和LSPS-Ⅱ的体外抗氧化活性,结果显示这两种多糖均具有较好的体外自由基清除能力,且均呈现良好的剂量效应关系。本实验还探讨了LSPS-Ⅰ和LSPS-Ⅱ对BGC细胞的抑制作用,LSPS-Ⅱ对 BGC 细胞增殖的具有较好的抑制效果。综上所述,分离自硫磺菌子实体的多糖组分LSPS-Ⅰ和LSPS-Ⅱ可作为抗氧化剂和抗肿瘤制品进一步研究,并应用于食品医药领域。

