桉树根系共生真菌的分离与鉴定
王思佳,赖文珍,谢贤安,陈 辉,唐 明,胡文涛
(华南农业大学 广东省森林植物种质创新与利用重点实验室,林学与风景园林学院,广州 510642)
桉树是桃金娘科(Myrtaceae)桉属(Eucalyptus)植物的统称,属常绿高大乔木,具有生长速度快、树干通直、适应性强等特点,是中国南方主要的造林树种[1]。南方酸性红壤和砖红壤中磷成分主要为磷酸铝、磷酸铁和磷酸钙,有效磷含量低,引起桉树生长缓慢,某些组织发生畸变等现象[2]。为此,大多桉树栽培区通过施用化肥来提高桉树生长量,而化肥又会导致土壤理化性质不断加剧恶化,土壤质量下降。加之南方土壤呈酸性,磷肥很难被植物吸收,最终导致桉树缺磷现象严重,长期使用化学肥料,不仅会对周围环境造成污染,还会导致土壤肥力退化[1]。
菌根(mycorrhiza)是土壤中某些真菌与植物根系形成的共生体,具有促进植物吸收水分和磷素等矿质营养,提高植物生长量,增强植物抗逆能力和改良森林土壤结构特性等重要作用[3-5]。外生菌根(ectomycorrhizas,ECM)和丛枝菌根(arbuscular mycorrhiza,AM)是林木菌根的主要类型[5]。深色有隔内生真菌(dark septate endophytic fungi,DSE)广泛存在于植物根围,是一类能够定殖在植物根系的真菌类群,被认为是“特殊的菌根菌”[6],并且能够与菌根真菌共同存在于植物根系中[7-8]。
桉树是既可以形成AM,又可以形成ECM的树种[9]。AM真菌可以在一定程度上提高桉树对磷的高效利用,并且能够缓解桉树受到土壤中铝离子的毒害[5]。ECM真菌对桉树青枯病的生物防治有重要意义[10]。朱天辉等[11]对四川省范围内的巨桉(Eucalyptusgrandis)、尾叶桉(Eucalyptusurophylla)、蓝桉(Eucalyptusglobulus)、大叶桉(Eucalyptusrobusta)ECM真菌调查,发现9科11属17种ECM真菌,梁洪萍[12]在四川省内的巨桉发现7科、10属、17种ECM真菌,但这些ECM真菌多为野外调查发现,与桉树的共生效应研究很少。为发掘优良的桉树共生真菌资源,本研究通过对桉树根系真菌侵染率的测定和真菌的分离鉴定,将真菌回接桉树,经柯赫氏法则(Koch's Rule)确定桉树共生真菌,为进一步研究共生真菌促进桉树生长、增加磷素营养吸收的机制,以及应用共生真菌提高桉树造林成活率、生物量和木材产量提供科学依据。
1 材料和方法
1.1 样品采集
尾叶桉、窿缘桉(Eucalyptusexserta)和尾巨桉(E.urophylla×E.grandis)采自华南农业大学树木园和增城教学科研基地,位于N23°09′10″~23°14′22″,E113°20′22″~113°37′56″,属于亚热带季风气候和亚热带海洋性气候,土壤为赤红壤。2017年11月采集样品,在树冠的投影区内取30~40 cm范围内土层的树木侧根作为根样,将根上的大块泥土轻轻抖掉,其余泥土连同根系一起装入密封袋中,同种桉树放入同一密封袋中,封口标记。根样带回实验室后,一部分用于立即观察根系的形态结构和共生真菌的分离,另一部分用于侵染率的测定。
1.2 试验方法
1.2.1共生真菌的侵染率统计将采集的根样冲洗干净,采用透明压片法对根系进行透明、酸化、台盼蓝染色和脱色后,在显微镜下统计菌根侵染情况[13],参照Trouvelot 等[14]的方法统计AM真菌和ECM真菌的侵染率及侵染强度。
1.2.2共生真菌的分离培养采用组织分离法分离真菌。将根系洗去泥土,剪成1~2 cm根段,在体式显微镜下找出带有共生真菌结构的根尖,经3%次氯酸钠表面消毒2~3 min,无菌水中冲洗后,剪成0.5~1 cm的根段,置入PDA培养基内,25 ℃恒温倒置培养[5]。
待培养基内长出菌丝后进行纯化,经过纯化后的菌株一部分进行插片培养[15],待菌丝长到玻片中部,用于真菌的形态学鉴定。另一部分纯化菌株接种到PDA斜面,4 ℃冰箱保存,用于分子鉴定。
1.2.3真菌的形态学鉴定观察菌落的表面特征、形状、颜色、大小、光滑度等菌落特征,记录其生长状况。显微镜下观察菌丝的颜色、是否分隔、分枝情况;观察分生孢子的形状、颜色、大小、细胞壁特征、有无子囊(担子)及子囊孢子(担孢子)等特征。根据真菌分类文献,并参阅近几年有关真菌鉴定的文献对分离菌株进行形态学鉴定[16-18]。
1.2.4真菌的分子生物学鉴定将纯化的真菌在25 ℃培养2周后,收集新鲜菌丝进行ITS序列分析。参照Zhou等[19]研究方法,采用真菌DNA微量提取试剂盒(Omega公司,D3195-01)提取DNA。ITS序列扩增引物选择真菌ITS区通用引物ITS1-F和ITS4(ITS1-F: CTTGGTCATTTAGAGGAAGTAA;ITS4: TCCTCCGCTTATTGATATGC)[20],由生工生物技术有限公司合成。
通过PCR反应扩增真菌ITS rDNA基因。反应体系20 μL[10 μL Premix Tap(Sangon Biotech)、0.5 μL ITS4、0.5 μL IFS1-F、1 μL PCR产物和8 μL ddH2O]。反应条件为95 ℃预变性3 min;94 ℃变性30 s,55 ℃退火25 s,72 ℃延伸1 min,35个循环;最终72 ℃延伸5 min。PCR产物进行1%琼脂糖凝胶电泳(100 V,40 min),采用胶回收试剂盒(OMEGA公司,D2500)进行PCR产物回收。回收产物采用TaKaRa公司pMD18-T试剂盒进行T/A连接并克隆转化。连接反应体系5 μL(2 μL pMD18-T、0.5 μL Insert DNA和2.5 μL Solution Ⅰ),37 ℃培养过夜,送北京擎科新业生物技术有限公司进行双向测序。
将真菌测序所得的ITS序列在NCBI中运用BLAST工具进行比对分析,并从NCBI中下载已知同源序列,用软件MEGA(Version 5.1)进行比对,用Neighbor-Joining法构建系统发育树。使用Maximum Composite Likelihood 方法计算Bootstrap值,估测系统发育树的置信度。
1.2.5共生真菌的回接将沙子、蛭石(体积比为1∶1)在121 ℃灭菌60 min,装满体积为0.3 L的花盆中,参考刘茂军等[21]的方法并做适当修改,将分离出的共生真菌回接到巨桉组培苗(来自中国林业科学研究院热带林业研究所),每株接种20个直径5 mm的菌饼,每组3个重复。将接种好的植株套袋,在组培室内培养(温度25 ℃,湿度60%,光强5 000 Lux),半个月后取下套袋;定期浇水,2个月后,收获接种苗,检测根系共生真菌的定殖情况并测定侵染率。
2 结果与分析
2.1 共生真菌侵染率统计
观察到尾叶桉、窿缘桉和尾巨桉均能被菌根真菌侵染,其中窿缘桉的AM真菌侵染率最高,达到58.75%,侵染强度14.54%;其次是尾巨桉,AM真菌侵染率为51.33%,侵染强度15.74%;尾叶桉最低,侵染率为48.67%,侵染强度为11.03%(表1)。与AM真菌侵染率相比,ECM真菌的侵染率相对较低,尾叶桉、尾巨桉和窿缘桉3种桉树的ECM真菌侵染率依次为11.03%、13.02%和15.00%,侵染强度为1.64%、1.60%和0.81%(表1)。经方差分析,尾叶桉、窿缘桉和尾巨桉3种桉树AM真菌总侵染率差异不显著(P>0.05),ECM真菌总侵染率差异也不显著(P>0.05)。
对3种桉树共生真菌侵染特征观察,发现尾叶桉(图1,A~C)和尾巨桉(图1,D~F)都同时具有AM真菌结构、ECM真菌结构和DSE结构,窿缘桉具有AM真菌结构(图1,G)和ECM真菌结构(图1,H、I)。3种桉树的AM真菌结构和ECM真菌结构都比较明显,典型的深色有隔内生真菌结构在尾叶桉和尾巨桉都有观察到。
尾叶桉、窿缘桉和尾巨桉3种桉树根尖均存在外生菌根的菌套结构(图2)。但3种桉树的外生菌根形态不同,其中尾巨桉为单轴分枝状(图2,A),窿缘桉为单轴分枝和二叉分枝(图2,B、C),尾叶桉的菌根形态呈二叉分枝状(图2,D~F)。外生菌根的菌根形态特征是鉴定外生菌根真菌的依据之一,说明外界自然环境下,本研究采样点的尾巨桉和尾叶桉分别与1种外生菌根真菌形成菌根,窿缘桉与2种外生菌根真菌形成菌根。

表1 桉树根系菌根真菌侵染状况

A~C.尾叶桉;D~F. 尾巨桉;G~I.窿缘桉;a. 菌套结构;b. 深色有隔内生真菌;c. 根内菌丝;d. 丛枝结构;e. 泡囊;f. 根外菌丝图1 桉树根系中的菌丝结构A-C. Eucalyptus urophylla;D-F. E. urophylla × E. grandis;G-I.Eucalyptus exserta; a. Mantle;b. Dark septate endophytes;c. Internal hyphae;d. Arbuscule;e. Vesicle;f. External hyphaeFig.1 Mycelium structure in Eucalyptus roots

图2 桉树根系外生菌根真菌的形态结构Fig.2 Ectomycorrhizas in Eucalyptus roots
2.2 桉树共生真菌的形态特征
从3种桉树根系共分离出6株共生真菌,标记为WY1、WY3、WY9、LY1、WJ1、WJ5。在PDA培养基上培养20 d,形成的菌落颜色呈白色、淡黄色或者深灰色;形状为圆形或椭圆形;菌丝致密或稀疏(图3);其中WY1生长速度最快,25℃恒温培养20 d菌落直径为9 cm,最快长满平板;其次为WY3、WJ5和LY1,菌落直径分别为8.5 cm、8.6 cm和9 cm;WY9和WJ1则生长比较缓慢,菌落直径为5.4 cm和4.4 cm。插片培养的盖玻片置于载玻片上,显微镜观察的菌丝形态(图4),菌落特征和形态特征描述见表2。
从PDA培养基的菌落特征(图3)以及显微镜下的菌丝形态观察(图4),可以看出WJ5、WY3、WY9和LY1的菌落颜色呈深色,菌丝有隔,都具有典型的深色有隔内生真菌的特征,初步推断为DSE。而WY1和WJ1的菌落呈白色,菌丝无色,推测属于担子菌亚门(Basidiomycotina)。参照真菌形态和分类描述的特征,鉴定出WY3为茎点霉属(Phomasp.),WY9为镰刀霉属(Fusariumsp.),LY1为拟盘多毛孢属(Pestalotiopsis),WY1为小皮伞属(Marasmiussp.),WJ1为裸脚伞属(Gymnopussp.),WJ5为伞状霉属(Umbelopsissp.)。
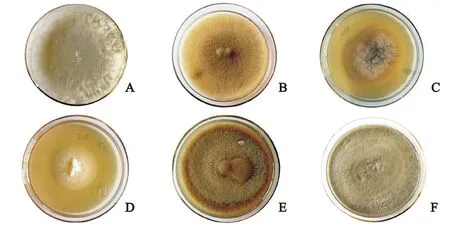
A. WY1;B. WY3;C. WY9;D. WJ1;E. WJ5;F. LY1图3 分离菌株在PDA培养基上生长20 d后的菌落形态Fig.3 The isolated fungus colonies on PDA medium after 20 days

A. WY1;B. WY3;C~D. WJ5;E~G. LY1;H. WJ1;I. WY9图4 分离的真菌的菌丝和孢子形态Fig.4 The mycelium and spore morphology of isolated fungi
2.3 共生真菌的分子鉴定
提取根系共生真菌DNA后,利用引物ITS1-F和ITS4,对提取的DNA菌液进行PCR扩增,在凝胶成像系统中看到清晰的条带(图5)。将真菌测序所得的ITS序列提交到GenBank数据库后,在线运用BLAST工具进行比对,结果显示:WY1和WJ1与GenBank中的JN943601.1和MF100988.1菌株有95%以上的相似度,结合形态特征确定它们为担子菌亚门中不同属的2种外生菌根真菌,分别为三色小皮伞菌(M.tricolor)和黑柄裸脚伞(G.melanopus);WY3、WY9、WJ5和LY1分别与GenBank中茎点霉属、镰刀霉属、二型伞霉(U.dimorpha)和芒弗里亚拟盘多毛孢(P.mangifolia)有94%以上的相似度(表3)。
将真菌测序所得的ITS序列提交到GenBank数据库,运用BLAST工具进行比对,并从NCBI下载GenBank数据库内已知同源序列,用软件MEGA(Version 5.1)进行对比分析,用Neighbor-Joining法构建系统发育树(图6),可以看到,6株真菌(红色☆标出)分为3个类群,隶属于担子菌亚门、接合菌亚门(Zygomycotina)和半知菌亚门(Deuteromycotina)。其中担子菌亚门单独成一类群,包括WY1和WJ1;接合菌亚门包括WJ5;WY3、WY9和LY1同属半知菌亚门,其中LY1和WY9有极高的相似度。

表2 真菌菌落特征和形态特征

表3 桉树根系共生真菌rDNA ITS序列Blast比对结果

图5 分离真菌DNA的PCR产物1%琼脂凝胶电泳Fig.5 PCR products of isolated fungi on 1% agar gel electrophoresis
综合形态特征和ITS序列分析,确定6种真菌隶属3亚门5目6科6属。其中,半知菌亚门、瘤座孢菌目(Tuberculariales)、瘤座孢菌科(Tuberculariaceae)、镰刀霉属,分离自尾叶桉;球壳孢目(Sphaeropsidales)、球壳孢科(Sphaerioidaceae)、茎点霉属,分离自尾叶桉;黑盘孢菌目(Melanconiales)、黑盘孢菌科(Melanconiaceae)、拟盘多毛孢属、芒弗里亚拟盘多毛孢,分离自窿缘桉。担子菌亚门、伞菌目(Agaricales)、小皮伞科(Marasmiaceae)、裸脚伞属、黑柄裸脚伞,分离自尾巨桉;白蘑科(Tricholomataceae),小皮伞属、三色小皮伞菌,分离自尾叶桉。接合菌亚门、毛霉目(Mucorales)、伞状霉科(Mucoraceae)、伞状霉属、二型伞霉,分离自尾巨桉。

图6 基于18S rDNA ITS序列构建的系统发育树Fig.6 Neighbor-joining phylogenetic tree based on 18S rDNA ITS sequences

A~B. 三色小皮伞菌;C~D. 芒弗里亚拟盘多毛孢;E~F. 二型伞霉;G. 镰刀霉属;H. 黑柄裸脚伞;I. 茎点霉属a. 根外菌丝;b. 深色有隔内生真菌;c. 微菌核;d. 根内菌丝图7 分离的真菌在回接根系上形成的菌丝结构A-B. M. tricolor;C-D. P. mangifolia;E-F. U. dimorpha;G. Fusarium sp.;H. G. melanopus;I. Phoma sp.a. External hyphae;b. Dark septate endophytes;c. Microsclerotia;d. Internal hyphaeFig.7 Mycelium structures of isolated fungi formed in re-inoculated roots after 60 days

A~D.三色小皮伞菌;E、F.黑柄裸脚伞图8 回接根系上的外生菌根形态A-D. M. tricolor; E-F. G. melanopusFig.8 Ectomycorrhizas formed in re-inoculated roots of Eucalyptus after 60 days
2.4 真菌回接桉树的侵染效应
2.4.1真菌与桉树共生效应6种真菌回接巨桉组培苗后菌丝侵染情况显示,茎点霉属、镰刀霉属、二型伞霉和芒弗里亚拟盘多毛孢4种真菌形成深色有隔菌丝和微菌核(microsclerotia)结构(图7),推测它们为DSE,微菌核丰富度分别为46.8%、42.3%、56.7%和62.3%。三色小皮伞菌和黑柄裸脚伞2种真菌形成外生菌丝及菌套结构,确定为桉树外生菌根真菌(图8)。
2.4.2回接后侵染率统计6种真菌回接无菌巨桉组培苗,测定侵染率发现,6种真菌均能在巨桉根内侵染,其中茎点霉属的侵染率最高(52.2%),其次为黑柄裸脚伞(侵染率为45.3%),三色小皮伞菌、镰刀霉属、二型伞霉和芒弗里亚拟盘多毛孢的侵染率分别为30%、32.2%、33.2%和22.1%。
3 讨 论
桉树是典型的既可以形成丛枝菌根(AM),又可以形成外生菌根(ECM)的树种[5],甚至外生菌根、丛枝菌根和两者混合菌根同时存在[22],本研究在尾叶桉、窿缘桉和尾巨桉3种桉树除了观察到有ECM结构和AM真菌结构,同时,在尾叶桉和尾巨桉中还观察到典型的深色有隔内生真菌结构,说明桉树菌根真菌具有多样性,不仅是前人报道的可以与AM真菌、ECM真菌形成混合菌根,还可以和DSE形成共生体系。
本研究在桉树根系中首次报道2种ECM真菌,三色小皮伞菌和黑柄裸脚伞。弓明钦等[23]对华南地区桉树ECM真菌的调查发现11种,优势菌为多根硬皮马勃(SclerodermapolyrhizumPers);朱天辉等[11]和梁洪萍[12]分别发现四川桉树有17种ECM真菌,都与本次分离到的2种ECM真菌不同,不同树种、不同生态环境会影响菌根真菌的种类和多样性。三色小皮伞菌具有产漆酶的特性,漆酶属于木质素降解酶类,可参与植物细胞壁的形成,还可去木质素,在环境修复、农业生产等领域用途广泛[24];黑柄裸脚伞为中国新纪录种[25],其生物学特性有待进一步研究。
在桉树根系中分离得到4种内生真菌,回接后均观察到DSE典型的深色有隔菌丝和微菌核结构,推测它们为桉树根系中的DSE,有待于进一步的研究。茎点霉属、拟盘多毛孢属和镰刀霉属是桉树中具有一定抗菌作用的内生真菌[26],谢玲等[27]在甘蔗(Saccharumofficinarum)根围发现深色有隔内生真菌茎点霉属,韦继光[28]从南山茶(Camelliasemiserrata)和短叶罗汉松(Podocarpusmacorphyllus)中分离出芒弗里亚拟盘多毛孢;格希格图等[29]在桉树根系中发现镰刀菌(Fusarium)的存在,徐超等[30]发现二型伞霉可提高铁皮石斛生长速度和增强抗旱能力。

