基于线粒体Cyt b和COⅠ基因序列的华南鲤群体遗传结构分析
王桢璐,姚东林,谢少林,3,范兰芬,邹记兴,周爱国,3,4
(1.华南农业大学海洋学院,广东广州510642;2.广东省清远市水产技术推广站,广东清远511510;3.清远市北江水产科学研究所,广东清远511510;4.广东省清远市兴渔水产科技有限公司,广东清远511510)
鲤亚科(Cyprininae)鱼类在鱼类分类学中属于鲤形目(Cypriniformes)鲤科(Cyprinidae)。中国鲤亚科鱼类共有五属,分别为鲃鲤属(Puntioplites Smith)、原鲤属(Procypris Lin)、鲤 属 (Cyprinus)、须 鲫 属 (Carassioides)和 鲫 属(Carassius)[1]。其中,鲤在华南地区有华南鲤亚种的分布,华南鲤遍布华南地区的几乎所有流域。
目前,对鲤的研究已经从传统形态学研究转向分子生物学方面的研究。通过对中国鲤中的红鲤资源进行形态学、分子遗传学等方面的研究,获取了中国6个红鲤种群的全面数据,为红鲤的育种奠定了基础[2]。2010年,中国首次完成了鲤鱼的全基因组测序;2013年,中国学者从形态学、染色体组型和同工酶等方面对山东省东平湖的野生鲤鱼资源进行了全面研究[3]。这些研究工作为中国鲤亚科鱼类的研究提供了坚实基础。线粒体(mitochondrion)作为真核生物细胞中的一种双层膜细胞器,为有氧呼吸提供场所,并为细胞提供能量。线粒体存在于细胞质中,其内部存在一定的遗传物质,因此线粒体DNA为细胞外遗传物质。细胞色素b(Cyt b)和细胞色素氧化酶Ⅰ(COⅠ)是常用的线粒体标记基因[4-7]。细胞色素b(Cyt b)基因进化速度适中,其变异主要为转换和颠换,因此在不同科、属、种中能较好地显示进化关系,常用于构建物种系统发育关系[8-9]。细胞色素氧化酶Ⅰ(COⅠ)作为分子标记具有诸多优势,有足够的变异且相对保守、有合适的序列长度、可用通用引物扩增和测序等,其分子标记作为DNA条形码可快速鉴定物种,近年来被广泛应用于物种鉴定[10-15]。
目前,有关华南鲤的研究资料很少,华南鲤的资源状况尚不清楚。该研究以线粒体Cyt b和COⅠ基因为分子标记,结合2个标记各自的进化特点,在每个基因片段独立分析的基础上,分析不同地区华南鲤种群遗传多样性,有助于了解其资源现状,为其资源保护工作提供一定的理论依据。
1 材料与方法
1.1 试验材料
该研究华南鲤(Cyprinus carpio rubrofuscus Lacepede)样品分别采至海南万泉河(21尾)、珠江水系的高明河(31尾)和广东榕江(22尾),共采集74个样品。样本采集是随当地渔民出船捕捞获得,剪取新鲜样品的肌肉和尾鳍组织,加入95%乙醇后4℃保存备用。
样品DNA采用海洋组织提取试剂盒提取(天根生化科技有限公司)、Taq DNA聚合酶采用宝生物工程(大连)有限公司产品,试验中其他试剂均为分析纯,测序送至上海英骏公司进行。试验根据已经报道的鲤科目鱼类相关序列,并参考其他文献的报道,结合两者信息用Editseq及Primer premier 5.0 软件设计引物[14-15],COⅠ 基因:上游引物 F,5'- TCA ACCAACCACAAAGACATTGGCAC-3';下游引物 R,5'-TAGAC TTCTGGGTGGCCAAAGAATCA -3'。Cyt b基因,上游引物 F,5'-GACTTGAAAAACCACCGTTG -3';下游引物 R,5'-CCTCAGAAGGATATTTGTCCTC -3'。
1.2 方法
1.2.1 华南鲤基因组DNA提取 取保存于95%乙醇中的样品80~100 mg,用去离子水冲洗1遍,再放入有去离子水的烧杯中漂洗2 min,用滤纸吸干后置于1.5 mL离心管内。先加入50μL裂解液,用剪刀剪碎组织样品后,再加入450μL裂解液和10μL蛋白酶K用漩涡振荡器混合20 s,置水浴锅中55℃恒温裂解,裂解时间视具体裂解效果而定,一般3~7 h。完全裂解后,按照海洋组织DNA提取试剂盒的操作说明进行提取,提取产物用琼脂糖凝胶电泳检测提取效果,后置于-20℃保存备用。
1.2.2 华南鲤Cyt b和COⅠ基因PCR扩增与测序 PCR反应体系总体积为50 μL,包括 dNTPs(2.5 mmol/L)2 μL,10×buffer 5μL,Taq DNA 聚合酶(1 U/μL)2 μL,上下游引物各1 μL。
PCR反应程序:94℃预变性7 min(Cyt b)和4 min(COⅠ);94℃变性30 s,60℃退火30 s,72℃延伸30 s(Cyt b)和1 min(COⅠ),35个循环;最后72℃延伸5 min。PCR产物经电泳、胶回收(采用TaKaRa凝胶纯化试剂盒)后送至上海英骏公司,在ABI 3730自动测序仪上用正向引物进行单向测序。
1.3 数据分析
采用Chromas 2.23软件查看序列的测序效果,并以此为依据判断测序是否准确。使用MEGA 6.06软件的Clustal W功能进行序列比对并进行人工矫正,然后计算平均碱基数、碱基组成比例、简约信息位点等数值,并构建系统进化树。使用DNASP(版本号为4.5)软件进行中性假说检验(Fu's Fs和Tajima's D算法)和核苷酸分析,并计算平均核苷酸差异值和核苷酸多样性。使用Allequin V 3.5.1.3软件分析单倍型多样性和单倍型组成等。
2 结果与分析
2.1 华南鲤Cyt b和COⅠ基因的序列组成及变异
该试验获得并分析Cyt b和COⅠ基因序列均为52个,其中海南鲤分别为16、19个,珠江鲤17、16个,榕江鲤19、17个。对华南鲤3个种群线粒体Cyt b和COⅠ基因进行序列测定,用Clustal W软件进行序列比对,人工校正后共得到分析序列长度分别为729 bp(Cyt b)和610 bp(COⅠ)。序列的简约信息位点数,T、C、A、G、A+T、C+G 含量见表1。
3个种群Cyt b基因序列共检测到22个简约信息位点,其中海南鲤最多,16个样本共检测到简约信息位点10个,海南鲤 T、C、A、G 含量分别为 26.97%、30.42%、28.91%、13.72%,A+T的含量(55.88%)明显高于 C+G的含量(44.12%);珠江鲤17个样本共检测到简约信息位点4个,T、C、A、G、A+T、C+G 含量分别为 28.48%、29.05%、29.05%、13.43%、57.52%、42.48%;榕江鲤 19 个样本共检测到简约信息位点8个,T、C、A、G、A+T和C+G含量分别为 27.10%、30.28%、28.66%、13.96%、55.76%和 44.24%。
3个种群COⅠ基因序列共检测到13个简约信息位点,其中海南鲤19个样本共检测到简约信息位点4个,T、C、A和G 含量分别为 26.94%、29.13%、27.05%、16.89%,A+T 的含量(53.99%)明显高于C+G的含量(46.02%);珠江鲤16个样本共检测到简约信息位点5个,T、C、A、G、A+T和C+G含量分别为 27.20%、28.88%、27.14%、16.78%、54.34%、45.66%;榕江鲤17个样本共检测到简约信息位点4个,T、C、A、G、A+T、C+G 含量分别为 27.20%、28.86%、27.16%、16.77%、54.37%、45.63%。

表1 华南鲤3个种群Cyt b和COⅠ基因序列特征
2.2 基于Cyt b和COⅠ基因序列对华南鲤种群遗传距离的分析
应用MEGA 6.06计算该研究的华南鲤3个种群的Kimura双参数模型遗传距离、平均遗传距离、各种群内的平均遗传距离、两两种群间的净遗传距离。由表2可知,线粒体Cyt b基因序列的核苷酸分化速率为 2%/百万年[16-17],由试验结果可知,海南鲤与珠江鲤和榕江鲤的分化年代较远,大约在2.5万年和2.65万年前,而珠江鲤和榕江鲤之间的的分化年代大约在1.5万年前。
对3个群体间的遗传分化指数进行计算发现,Cyt b和COⅠ基因分析结果一致,珠江鲤和榕江鲤两群体间的FST值统计检验不显著(P>0.05);海南鲤同珠江鲤、榕江鲤两群体间的FST值统计检验均显著(p<0.05)。由此可知,珠江鲤和榕江鲤两群体间的遗传分化不显著,而海南鲤同珠江鲤和榕江鲤种群产生了一定程度的遗传分化。
2.3 基于Cyt b和COⅠ基因序列对华南鲤种群遗传结构分析
由表3可知,华南鲤3个种群52个样本共计13个(Cyt b)和12个(COⅠ)单倍型,其中海南鲤有10、5个单倍型,珠江鲤有均7个单倍型,榕江鲤有6、5个单倍型。3个华南鲤种群共同单倍型分别为4、2种,分别为Cyt b基因(Hc3、Hc5、Hc7和Hc8)、COⅠ基因(Hd1和Hd4)。分析Cyt b基因序列发现,除了4种共有单倍型外,海南鲤和珠江鲤无其他共同单倍型,而与榕江鲤也无其他共同单倍型,此外还有Hc4、Hc6、Hc9、Hc10 4种特有单倍型;珠江鲤除4种共有单倍型外,还与榕江鲤有2种共同单倍型:Hc11和Hc13,Hc12为其特有单倍型。
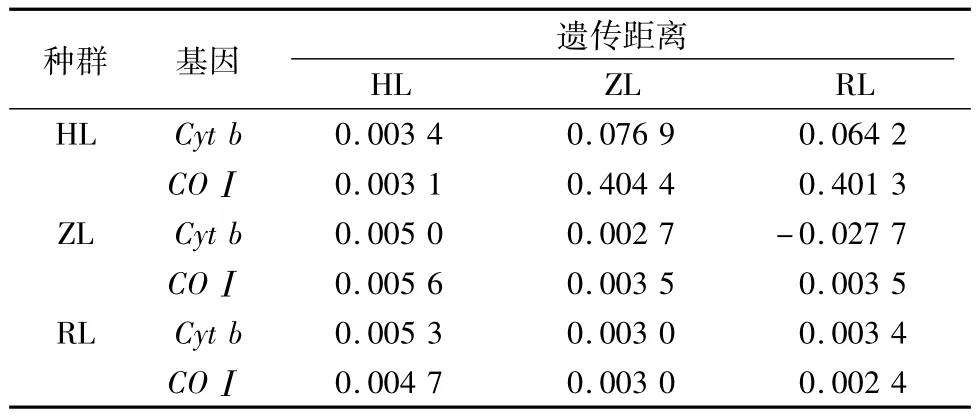
表2 华南鲤种群间遗传距离分析
由表4可知,各群体的核苷酸多样性指数较低,单倍型多样性指数整体均较高。分析Cyt b基因序列单倍型多样性和核苷酸多样性可知,海南种群均最高,而珠江、榕江鲤相对较低,其中珠江鲤的核苷酸多样性(0.002 68)明显小于海南鲤(0.006 37)。而分析COⅠ基因序列发现,海南鲤群体的遗传多样性(0.003 13)较珠江鲤和榕江鲤(0.003 51)低。通过Tajima's D和Fu's Fs进行中性检验,结果表明华南鲤3个种群内的Tajima's D和Fu's Fs值均不具备显著差异性。
2.4 基于Cyt b和COⅠ基因单倍型序列对华南鲤种群聚类分析
采用Mega 5.0软件对华南鲤3个种群Cyt b和COⅠ基因单倍型序列进行 NJ聚类分析,bootstrap(重复次数为1 000)检验NJ树各分支置信度,由图1可知,各地理种群无序分布于个分支,没有发现明显的地理聚群、地理结构;各种群间没有明显的谱系结构。

表3 Cyt b和COⅠ基因序列单倍型及其分布

表4 华南鲤种群的遗传变异参数统计

3 分析与讨论
3.1 华南鲤种群序列特征分析
线粒体Cyt b和COⅠ基因是目前常用的分子标记,试验运用序列测定技术分析华南鲤3个种群的Cyt b和COⅠ基因序列特征。脊椎动物线粒体一般特征为“高(A+T)含量且低G含量”[18],华南鲤3个种群的Cyt b和COⅠ基因序列也符合这一特征,与李青等对星斑川鲽、黄盖鲽、石鲽,线粒体Cyt b和COⅠ基因序列的研究结果[19]相符。研究表明,碱基中A+T的含量越高,线粒体DNA的进化优势越明显[20]。海南鲤、珠江鲤、榕江鲤的 A+T的含量分别为 55.88%、57.52%、55.76%(Cyt b),53.99%、54.34%、54.37%(COⅠ),均明显高于C+G的含量。此外,无论Cyt b还是COⅠ基因的序列,珠江鲤的碱基中A+T含量都是最高的,这表明珠江鲤相对于海南鲤、榕江鲤具有更强的进化优势,可能与珠江鲤处于珠江流域生存环境有关,珠江作为中国第二大河流,年径流量大、流经地域广,较海南鲤所处的海南岛万泉河水系和榕江鲤所在的榕江水系更为复杂。
3.2 华南鲤种群遗传多样性分析
遗传多样性是物种适应环境、不断进化的基础,一个物种的遗传多样性与其进化潜力、适应能力和生存能力密切相关[21-22]。华南鲤3个种群Cyt b基因序列平均遗传距离为0.003 1,52尾个体检测出13个单倍型,总群体单倍型多样性为0.874,核苷酸多样性指数为0.004 15,平均核苷酸差异数为3.027。基于COⅠ基因序列的分析表明,3个种群Cyt b基因序列平均遗传距离为0.003 0,检测出12个单倍型,总群体单倍型多样性为0.770,核苷酸多样性指数为0.003 38,平均核苷酸差异数为1.835。核苷酸多样性能精确的揭示一个群体线粒体DNA的多态性程度[23]。研究表明,华南鲤的核苷酸多样性远小于南海圆舵鲣的核苷酸多样性(0.036 81)[24]。当一个群体核苷酸多样性指数在 0.001 5 ~0.004 7时,其群体的遗传多样性较低[25]。该研究结果表明,3种华南鲤的遗传多样性不高。此外,华南鲤3个种群基于Cyt b和COⅠ基因序列均具有较高的单倍型多样性和较低的核苷酸多样性的特征,这与曹艳等对中国南海康氏马鲛[26]和熊丹等对南海短尾大眼鲷的研究结果[27]相似,故推测华南鲤近期历史上有种群快速扩张情况,因此单倍型多样性会增加,但由于时间不够长,核苷酸的变异还没有形成累积效应,故核苷酸多样性较低。但Tajima's D和Fu's Fs中性检验均不具备显著性差异,则表明华南鲤没有出现群体扩张,出现这一矛盾的原因可能是该研究的样品数量及采样点较少。
3.3 华南鲤种群的遗传分化
分析华南鲤Cyt b和COⅠ基因的序列组成及变异发现,珠江鲤和榕江鲤的A+T含量十分接近,且均较高;而海南鲤的A+T含量均较低。基于Cyt b和COⅠ基因序列对华南鲤种群遗传距离的分析发现,珠江鲤与榕江鲤之间的遗传距离均为0.003 0,是3个种群间遗传差距最小的数值。而其他两两之间的遗传距离均在0.004 7~0.005 6之间。通过分析华南鲤3个群体的NJ进化树发现,3个群体散乱分布于各支,未出现明显单一的地理聚群;从Cyt b基因的进化树上可见珠江和榕江2个群体有更多的交集,而海南群体产生了一定的遗传分化;从COⅠ基因的进化树上可见珠江和海南种群相对较为集中,与榕江种群均有交集,这些结果也体现了一定的遗传进化和地理格局的分布。
Heather等根据FST大小划定了群体的分化程度:高度分化,FST>0.25;中度分化,0.05 < FST≤0.25;低度分化,0 <FST≤0.05,作为群体遗传分化标准被广泛认可[28]。在对华南鲤种群遗传结构的分析中,海南鲤和珠江鲤、榕江鲤2个种群间基于Cyt b基因序列的FST值分别为0.076 9和0.064 2;基于COⅠ 基因序列的FST值分别为0.404 4和0.401 3,均远高于高度分化标准(0.25);而珠江鲤和榕江鲤间基于Cyt b基因序列的FST值为-0.027 7,基于COⅠ基因序列的FST值为0.003 5,均低于海南鲤和珠江鲤、榕江鲤2个种群间的FST值。
综上分析,在3个华南鲤种群中,海南鲤相对于其他2个种群遗传分化较大,而珠江鲤和榕江鲤有较近的遗传关系,之间的遗传分化相对较小。另外,珠江鲤和榕江鲤的遗传分化指数没有显著差异,而同海南鲤的差异显著,这与3个种群的地理位置有一定关系。珠江鲤所在的珠江水系是华南地区最大的水系,其每年水量巨大且支流众多[29],与榕江鲤所在的榕江水系有一定接触,2个种群间的交流更加频繁,故珠江鲤和榕江鲤的遗传分化指数差异不显著。而海南鲤主要分布于海南岛,本次试验所用海南鲤采集于海南岛万泉河水系,所处地区未受到深度开发,与外界产生交流少[30],故同珠江鲤、榕江鲤的遗传分化指数差异显著。

