家蚕δ-鸟氨酸转氨酶基因Bmoat转录分析及对免疫的响应
张永红, 朱 峰, 唐芬芬, 邵榆岚, 白兴荣
(云南省农业科学院蚕桑蜜蜂研究所,云南蒙自 661101
家蚕能量代谢过程中,精氨酸在精氨酸酶的作用下水解成鸟氨酸和尿素[1-2],其中δ-鸟氨酸转氨酶(ornithine-δ-aminotransferase,δ-OAT)作为鸟氨酸代谢途径中的关键酶,对脯氨酸合成起着重要作用[3],而脯氨酸参与机体的能量代谢[4];家蚕感染BmNPV以后新陈代谢明显加快,家蚕体内能量代谢水平会高于或低于未感染家蚕[5],因此研究Bmoat基因对了解其参与家蚕感染BmNPV后免疫应答功能和能量供应的一些补偿机制具有重要意义。
δ-鸟氨酸转氨酶是1种线粒体基质酶,它主要在生物机体合成脯氨酸过程中发挥关键作用[6-7],其cDNAs从酵母到人的多种物种中得到分离,δ-OAT几乎在动物各种组织中表达,当外界生理刺激侵入机体时该酶能在特异组织产生应答[8]。果蝇δ-鸟氨酸转氨酶基因与哺乳动物相比具有较高的同源性,其编码47 ku大小的蛋白,该基因在果蝇的脂肪体内高效表达[9]。在植物拟南芥体内,δ-OAT蛋白氨基酸序列同样与酵母、哺乳动物等序列高度同源,在土壤盐分高浓度胁迫条件下,δ-OAT蛋白活性和oat基因mRNA水平显著高于正常条件下培养的植株[10],再者转基因烟草体内过量表达δ-OAT蛋白能够增加植株的抗逆性[11]。You等研究发现通过转基因使小鼠过量表达δ-OAT蛋白,小鼠在干旱和高渗透压环境下抗逆性增强[12]。与哺乳动物相比,关于昆虫δ-OAT基因相关研究较少;δ-鸟氨酸转氨酶参与了家蚕能量代谢,至今鲜有相关Bmoat基因在免疫应答机理方面的报道。本研究克隆δ-鸟氨酸转氨酶编码基因,对该基因进行生物信息学及转录情况分析,并结合BmNPV侵染明确其表达规律对防御BmNPV的免疫应答机制,为探索基因在家蚕免疫方面的功能和防御应答模式提供理论依据。
1 材料与方法
1.1 材料及主要试剂
家蚕品种P50和BmNPV,均由云南省农业科学院蚕桑蜜蜂研究所保存。本试验使用病毒浓度为5.27×106/mL。
MiniBEST Universal RNA Extraction Kit、M-MLV反转录试剂盒、PCR相关试剂、荧光定量SYBR Primix ExTaqTMⅡ(Tli RNaseH Plus)试剂盒,均为宝生物工程(大连)有限公司产品;引物、凝胶回收试剂盒及其他化学试剂,均为生工生物工程(上海)股份有限公司产品。
1.2 试验方法
1.2.1 家蚕样品的采集 家蚕正常条件饲养至5龄3 d,收集家蚕幼虫头部、血液、中肠、脂肪体、马氏管、丝腺、精巢和卵巢组织样品;在家蚕饲养过程中,收集家蚕蚁蚕至上蔟不同发育时期个体;在BmNPV处理的试验中,家蚕按常规方法饲养至5龄起蚕后分为2组,其中试验组每头蚕添食10 μL BmNPV多角体悬浮液(5.27×106/mL),对照组添食等量的ddH2O。添食后在相同条件下饲养。采集添食BmNPV或ddH2O后3、6、12、24 h家蚕的中肠组织,采集的样品进行3次生物学重复,每个重复至少取5头蚕,采集的样品置于 -80 ℃ 保存备用。
1.2.2 家蚕总RNA提取及cDNA合成 家蚕中肠组织用液氮充分研磨,根据MiniBEST Universal RNA Extraction Kit总RNA提取试剂盒抽提RNA。在紫外分光光度计上测定组织RNA样品浓度和纯度,保留D260 nm/D280 nm比值在1.8~2.0之间的样品,按照M-MLV反转录酶使用说明书将抽提的RNA反转录成cDNA。
1.2.3 BmOAT序列分析 参照家蚕基因组数据库(http://silkworm.genomics.org.cn/)设计Bmoat的引物(表1)。将提取的家蚕5龄3 d各组织总RNA反转成cDNA。以家蚕脂肪体组织cDNA为模板,进行PCR扩增,扩增条件:95 ℃预变性4 min;95 ℃变性30 s,60 ℃退火30 s,72 ℃延伸90 s,35个循环;最后72 ℃终延伸10 min。胶回收试剂盒回收PCR产物,纯化后的PCR产物连接至pMD18-T载体并转化大肠杆菌Top10,利用M13引物扩增验证阳性克隆,阳性菌液送生工生物工程(上海)股份有限公司测序。对BmOAT蛋白的分子量、等电点(http://web.expasy.org/compute_pi/)、信号肽(http://www.cbs.dtu.dk/services/SignalP/)、功能结构域(https://www.ncbi.nlm.nih.gov/Structure/cdd/wrpsb.cgi)、蛋白质二级结构(http://bioinf.cs.ucl.ac.uk/psipred/)和三级结构(https://swissmodel.expasy.org/)进行在线预测;用GeneDoc软件对BmOAT与其他物种δ-鸟氨酸转氨酶进行多序列比对,用MEGA 5.0软件[13]中的邻接法(neighbor-joining)构建系统发生树(Bootstrap 1 000次重复检验进化树的可靠性)。
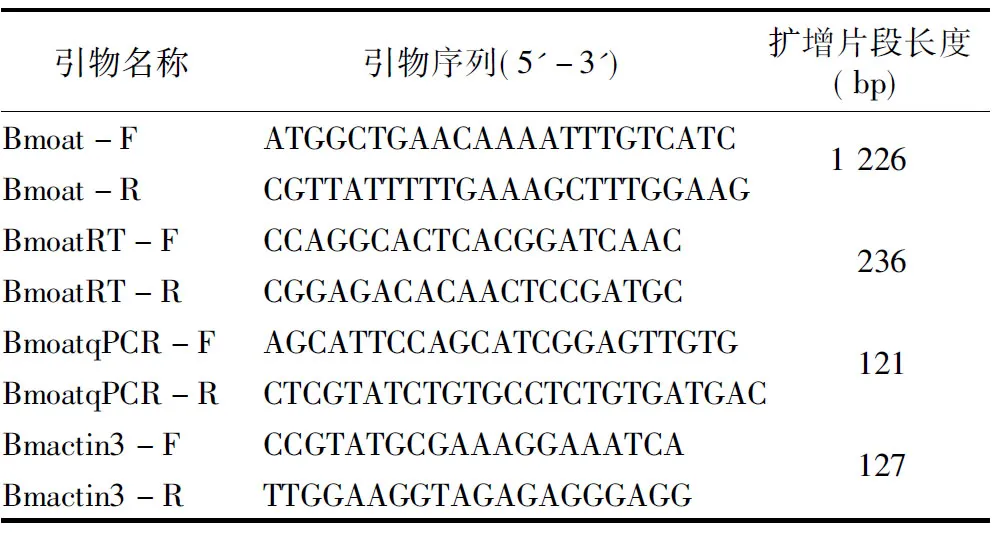
表1 本研究所用引物
1.2.4Bmoat基因时空转录情况分析 根据Bmoat基因序列设计RT-PCR半定量与qRT-PCR荧光定量引物,由表1可知,Bmactin3为内参基因,以家蚕5龄3 d幼虫各组织器官及蚁蚕5龄7 d幼虫组织器官cDNA为模板进行PCR扩增,RT-PCR扩增条件:94 ℃ 4 min;94 ℃ 30,72 ℃ 30 s,共31个循环;72 ℃ 10 min。PCR产物用1%的琼脂糖凝胶检测。qRT-PCR反应仪器为StepOnePlus Real-Time system(Life technologies),参照SYBR Primix ExTaqTMⅡ(Tli RNaseH Plus)试剂盒操作说明配制荧光定量反应体系,反应体系为 20 μL(SYBR预混液10 μL,ROX Reference Dye 0.4 μL,10 μmol/L 上下游引物各0.4 μL,模板1 μL,ddH2O 7.8 μL),反应程序:95 ℃预变性30 s;95 ℃ 30s,60 ℃ 30 s,40个循环。每个样品进行3次重复,收集试验组和对照组目的基因与内参基因的Ct值进行数据分析。采用2-ΔΔCt计算目的基因的相对表达量,其中ΔΔCt=(Ct靶标-Ct内参)处理-(Ct靶标-Ct内参)对照。同样以BmActin3为内参基因,家蚕蚁蚕5龄7 d幼虫各组织器官的cDNA为模板进行PCR扩增,对家蚕整个幼虫时期目的基因转录情况进行分析。
1.2.5 BmNPV感染家蚕5龄幼虫后Bmoat的转录分析 设计Bmoat的荧光定量PCR引物,由表1可知,在BmNPV处理的试验中,以不同时间段的2组家蚕中肠组织cDNA为模板,Bmactin3为内参基因进行实时荧光定量PCR检测,反应条件及目的基因相对表达量的计算方法同“1.2.4”节。
2 结果与分析
2.1 Bmoat克隆与序列分析
根据家蚕基因组数据库设计Bmoat特异性引物,以家蚕5龄3 d中肠组织cDNA为模板进行PCR扩增,目的基因片段经过克隆并测序。结果显示,BmoatORF全长为1 224 bp,编码407个氨基酸,信号肽预测为非分泌型蛋白;通过NCBI Conserved Domain Search在线工具发现,8~402位氨基酸为磷酸吡啶依赖酶(pyridoxal phosphate,PLP)的转氨酶结构域(Trysin-like serine protease domain)。预测分子量为 44.7 ku,理论等电点为6.36。利用PSIPRED Server在线软件预测BmOAT蛋白质的二级结构(图1-A),预测结果发现,BmOAT蛋白由12个α螺旋、14个β折叠和一些无规则卷曲构成;通过SWISS-MODEL同源建模预测BmOAT蛋白质三级结构,构建三维结构图(图1-B),与其二级结构特征一致。
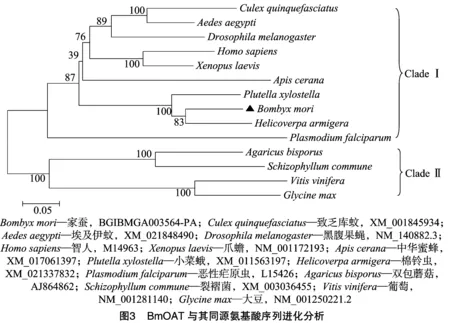
BmOAT的氨基酸序列(BGIBMGA003564-TA)与NCBI上登录的其他昆虫δ-鸟氨酸转氨酶进行多序列比对。结果显示,序列中均含有磷酸吡啶依赖酶的转氨酶结构域(图2);其中BmOAT与棉铃虫OAT(GenBank登录号:XM_021337832)序列同源性最高,为84.3%。利用MEGA 5.0软件,采用邻接法对上述鸟氨酸转氨酶构建系统进化树(图3),进化分析结果显示,不同物种鸟氨酸转氨酶聚为2支(CladeⅠ和Clade Ⅱ),BmOAT与棉铃虫和小菜蛾氨基转移酶在亲缘关系上较近。
2.2 Bmoat时空转录情况分析
通过半定量RT-PCR对Bmoat在5龄3 d各组织的表达进行检测。组织转录情况分析发现,Bmoat在家蚕各个组织均有转录(图4-A1),以精巢相对表达量最高(图4-A2)。对家蚕蚁蚕整个幼虫时期进行表达谱分析发现,Bmoat基因在家蚕整个幼虫时期持续性表达(图4-B)。
2.3 BmNPV感染家蚕后Bmoat的转录分析
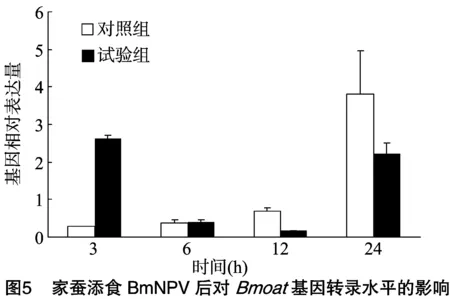
为了检测Bmoat是否参与家蚕的免疫应答,以添食ddH2O的5龄起蚕作为试验组,BmNPV处理的起蚕为试验组,利用实时荧光定量qRT-PCR(图4)对Bmoat在中肠的转录水平进行分析。结果显示,与对照组相比,试验组家蚕感染BmNPV 3 h后BmoatmRNA转录水平开始升高,而感染 6 h 时无明显变化,至感染12、24 h时开始下调表达,这说明Bmoat的表达受病原微生物BmNPV入侵的影响,BmNPV侵染家蚕的第一道屏障是中肠,再结合其在正常家蚕中Bmoat基因表达水平,认为它在防御BmNPV方面发挥着重要的作用。
3 结论与讨论
δ-鸟氨酸转氨酶是一种线粒体基质酶,它主要参与生物机体能量代谢。本研究成功克隆获得Bmoat基因(BGIBMGA003564-TA),其基因序列由9个外显子和8内含子组成,编码区全长1 224 bp,编码407个氨基酸,属非分泌性蛋白,预测分子量为44.7 ku,等电点为6.36。氨基酸多重序列比对分析结果表明,BmOAT与棉铃虫OAT序列同源性最高(84.3%);而系统发育进化树显示,家蚕与鳞翅目昆虫棉铃虫和小菜蛾转氨酶同聚在CladeⅠ一个分支上。微生物、昆虫、植物和动物δ-OAT中均含有磷酸吡啶依赖酶PLP的保守结构域[14],BmOAT与鳞翅目昆虫棉铃虫和小菜蛾OAT序列具有高度保守的底物特异性位点,因此可利用底物类似物、基因定点突变等方式来预防农林害虫。


在对BmOAT蛋白进行酶活测定时发现[15],该蛋白在家蚕5龄期间、羽化后乃至蛹期仍具有较高活力,加之Bmoat基因在家蚕各个组织中均有表达且整个幼虫时期呈持续性表达,说明该基因在家蚕整个生理周期都表达;脂肪体作为昆虫氨基酸代谢的重要场所,oat基因在双翅目昆虫果蝇脂肪体高丰度表达[9],而Bmoat基因在家蚕的性腺组织高量表达(图4-A2),这可能与基因转录的剪切方式和氨基酸代谢有关,有待近一步验证。
中肠是家蚕防御BmNPV等病源微生物的重要免疫场所,本研究以家蚕中肠作为探索Bmoat基因是否参与免疫响应的对象,家蚕添食BmNPV病毒粒子后,感染组和对照组目的基因荧光定量结果表明,Bmoat基因转录水平在家蚕感染BmNPV后发生明显变化,在感染3 h时呈上调趋势,在家蚕感染BmNPV病毒粒子早期,宿主体内病毒数量较少,BmNPV作为免疫刺激因子诱导了Bmoat基因的表达,家蚕为防御病毒入侵而新陈代谢加快,产生更多能量;而在感染6 h时基因表达量无明显变化,感染至12、24 h时均表现出明显下调,此时随着BmNPV感染时间的延长,病毒在宿主体内大量繁殖,吸收和消耗了大量蚕的养分,使蚕缺乏营养,抑制了目的基因的表达,进而产生上述的试验结果。