利心冲剂改善心力衰竭大鼠心肌能量代谢的作用机制研究
, , ,
进入21世纪以来,各种心脏疾病导致心力衰竭的发病率仍然呈上升趋势。近年来,调节衰竭心肌细胞能量代谢受到关注,有望成为治疗心力衰竭的一种新策略[1]。研究显示,心肌组织沉默信息调节因子2同源蛋白(silent information regulator 2 homolog,Sirt1)和过氧化物酶体增殖物激活受体γ辅激活因子-1α(peroxisome proliferator-activated receptor gammaco-activator,PGC-1α)是参与心肌能量代谢的重要物质,本研究观察中药利心冲剂调控心力衰竭大鼠模型心肌Sirti/PGC-1α的表达,探讨利心冲剂改善心肌细胞能量代谢的机制。
1 材料与方法
1.1 药品与试剂 利心冲剂:由黄芪、黄精、补骨脂、葶苈子、益母草按10∶5∶4∶4∶10的比例组成,采用江阴天江药业有限公司生产的免煎颗粒。
试剂:磷酸肌酸(creatine phosphat,PCr)Elisa试剂盒,由上海源叶生物科技有限公司提供,批号:1600526。Sirt1抗体,由SANTA CRUZ BIOTECHNOLOGY,INC公司提供,批号:A1324;PGC-1α抗体,由SANTA CRUZ BIOTECHNOLOGY,INC公司提供,批号:A6384。
1.2 实验方法
1.2.1 动物 SPF级健康SD大鼠80只,雄性,体重200 g~260 g,由浙江省实验动物中心提供,许可证号:SCXK(浙)2014-0001。
1.2.2 造模及分组 参照文献[2],采用腹主动脉缩窄法制备心脏压力负荷超载心力衰竭模型:SD大鼠术前禁食8 h,称重,10%水合氯醛腹腔注射麻醉,常规备皮消毒,逐层打开腹腔,左侧肾动脉上方游离腹主动脉,将8号注射器针头磨钝,平行置于腹主动脉上,用4号手术线将腹主动脉和注射器针头一同结扎,然后缓慢撤出注射器针头,关腹,分层缝合。假手术组仅开腹游离腹主动脉,穿线不结扎。术后予青霉素腹腔注射5 d,预防感染。手术成功2周后从存活大鼠中随机选取大鼠2只,断头处死,取出心脏,用预冷生理盐水冲洗,取左心室心肌部分,以10%甲醛固定,HE染色,光镜下观察确认造模成功。
造模成功后将SD大鼠随机分为4组,每组10只。假手术组、模型组给予等体积双蒸水;利心冲剂低剂量组(低剂量组)给予利心冲剂20 g/kg;利心冲剂高剂量组(高剂量组)给予利心冲剂40 g/kg。各组大鼠灌胃给药,每日1次,连续3个月。末次给药后大鼠脱颈处死,取左心室心肌组织,-70 ℃温箱保存备用,检测相关指标。
1.3 观察项目及检测方法
1.3.1 心肌匀浆PCr检测 称取左室心肌组织1 g,以2∶1比例加入冷磷酸缓冲盐溶液(PBS,4 ℃),匀浆器迅速制备心肌匀浆,3 000 r/min离心5 min,取上清,-70 ℃温箱保存。按PCr ELLSA检测试剂盒操作说明书进行。
1.3.2 Western-Blot法测定心肌匀浆Sirt1、PGC-1α蛋白表达 冰上裂解组织,手持式匀浆器匀浆,匀浆后BCA法测定各样本的蛋白浓度,根据蛋白浓度计算各样本电泳时的上样量。使用10%预制SDS-PAVE凝胶,上样本后以恒压110 V进行凝胶电泳,电泳结束后,以恒压120 V进行湿法转膜,转膜后牛奶封闭,之后孵育第一抗体,4 ℃过夜,清洗后孵育第二抗体2 h,凝胶成像系统化学发光成像,保存数据为图片,应用Quantity One对各条带进行分析,计算出相对值后导出Excel表格做进一步统计。

2 结 果
2.1 利心冲剂对心力衰竭大鼠心肌匀浆PCr的影响 与假手术组比较,模型组、利心冲剂低剂量组及利心冲剂高剂量组PCr含量均显著降低(P<0.05),提示心力衰竭时细胞内PCr含量呈下降趋势;与模型组比较,利心冲剂高剂量组PCr明显升高(P<0.05),说明利心冲剂治疗能够提高细胞中的PCr水平。详见表1。

表1 各组大鼠PCr含量比较(±s)
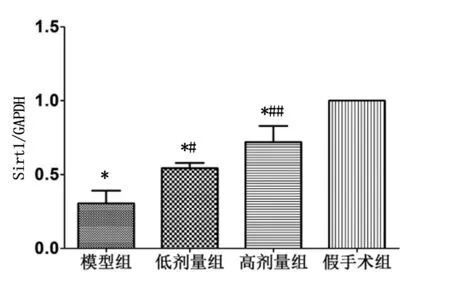
2.2 利心冲剂对心力衰竭大鼠心肌组织Sirt1蛋白表达的影响 与假手术组比较,模型组、利心冲剂治疗组中Sirt1蛋白表达明显降低(P<0.01),说明心力衰竭时心肌组织内Sirt1的含量呈下降趋势;与模型组比较,利心冲剂低剂量组与高剂量组中Sirt1蛋白表达明显增多(P<0.05或P<0.01),提示利心冲剂可以提高Sirt1表达水平。详见图1、图2。

图1 Sirt1蛋白表达电泳图
与假手术组比较,*P<0.01;与模型组比较,#P<0.05,##P<0.01。
图2 Sirt1蛋白表达相对定量柱状图
2.3 利心冲剂对心力衰竭大鼠心肌组织PGC-1α蛋白表达的影响 与假手术组比较,模型组、利心冲剂治疗组中PGC-1α蛋白表达明显降低(P<0.01),说明心力衰竭时心肌组织内PGC-1α的含量呈下降趋势,与模型组比较,利心冲剂低剂量组与高剂量组中PGC-1α蛋白表达明显增多(P<0.05或P<0.01),提示利心冲剂可以提高PGC-1α表达水平。详见图3、图4。

图3 PGC-1α蛋白表达电泳图

与假手术组比较,*P<0.01;与模型组比较,#P<0.05,##P<0.01。
图4 PGC-1α蛋白表达相对定量柱状图
3 讨 论
心力衰竭是各种心脏疾病的严重和终末阶段,是世界范围内突出的公共卫生问题[3]。近20余年,心力衰竭的治疗模式已经从改善血流动力学转变为抑制神经内分泌的过度激活,并取得了长足的进步。目前的治疗虽然延缓了心力衰竭的进程,但并未使得心力衰竭致残率和病死率明显下降。人们逐渐认识到能量代谢贯穿于心肌从肥大到衰竭的全过程,是心力衰竭发生、发展、恶化的重要因素之一[4-5]。
心肌正常的能量代谢是维持心脏内环境稳定和心脏舒缩功能的基础[6],三磷酸腺苷(adenosinetriphosphate,ATP)和PCr参与了心肌能量代谢,其中ATP是直接的供能物质,PCr是主要的能量储备。能量底物在线粒体通过三羧酸循环氧化磷酸化为ATP,后者被肌酸激酶(creatine kinase,CK)转移并储存在PCr中,PCr能在肌酸激酶的催化下及时转化为ATP,补充心肌收缩时不断消耗的ATP[7]。心力衰竭时ATP的合成受限,细胞内ATP耗竭,PCr水平下降,心肌处于“能量饥饿状态”[8]。Sirt1是酵母染色质沉默子Sirt2在哺乳动物中的同源体1,具有组蛋白去乙酰化酶活性[9],与基因转录沉默、细胞生长周期调节、能量代谢及寿命期限延长有着密切的关系,还通过调节心肌细胞能量代谢、活性氧(reactive oxygen species,ROS)产生、血管生成、细胞自噬及死亡等过程,在心力衰竭发生发展的病理生理过程中起着重要的作用[10]。近年研究发现,PGC-1α是线粒体生物合成的中枢调节因子[11],可促进线粒体生物合成,增强不同组织细胞有氧呼吸功能,而线粒体参与了心脏能量产生和新陈代谢等重要生理过程,其功能障碍是导致心功能恶化的主要因素之一。Sirt1能够通过去乙酰化作用激活PGC-1α,促进线粒体的生物合成,调节线粒体的功能,从而调节能量代谢障碍、协调心脏舒缩功能,发挥心肌保护作用[12]。Sirt1/PGC-1α途径调控的线粒体功能可能是维持和修复心肌细胞的主要机制之一,在心力衰竭、心肌肥大等心血管疾病中发挥重要作用。
慢性心力衰竭归属于中医“胸痹”“喘证”等范畴,基本病机概括为心气虚乏,心阳式微,瘀阻水停,其主要病理变化是虚、瘀、饮[13-14]。治宜益气温阳、活血利水。利心冲剂(黄芪、黄精、补骨脂、葶苈子、益母草)针对气阳虚乏、络脉瘀阻、水湿停聚三大基本病理变化,以黄芪和黄精补益心气,补骨脂温阳化气,振奋心肾气阳治其本;黄芪益气利水,益母草活血利水,葶苈子泻肺利水,通利水停瘀阻治其标。前期临床对照研究证实,与单纯西药治疗比较,利心冲剂干预后病人生活质量、射血分数改善明显,B型利钠肽(BNP)下降[15];作用机制研究也显示,利心冲剂能改善大鼠心力衰竭模型心肌病理和血流动力学;减少大鼠心肌组织神经内分泌因子的表达,降低血清血管紧张素Ⅱ水平;抑制心肌细胞凋亡;调控心肌组织金属蛋白酶组织抑制因子(TIMP-1)的表达、抑制由转化生长因子β(TGF-β)诱导的心肌胶原沉积和纤维化[16-17]。
本研究结果显示,与假手术组比较,模型组、利心冲剂低剂量组及利心冲剂高剂量组PCr含量均显著降低(P<0.05),表明心力衰竭大鼠存在能量代谢障碍;与模型组比较,利心冲剂高剂量组PCr明显升高(P<0.05),说明利心冲剂改善了心力衰竭大鼠的心肌能量代谢。模型组Sirt1及PGC-1α显著下降,经利心冲剂干预后,Sirt1及PGC-1α水平明显上升,提示利心冲剂可能通过Sirt1/PGC-1α途径,促进线粒体增殖,从而调节线粒体的能量合成,改善了心肌细胞的能量代谢。中医药改善心肌能量代谢障碍或将成为慢性心力衰竭新的研究方向。

