大鼠全脑缺血再灌注后海马CA1区细胞凋亡及银杏叶提取物的保护作用❋
吕建国 孙燕玲
(湖北科技学院, 1 临床医学院&附属第二医院, 2 基础医学院, 咸宁 437100)
脑血管疾病与心脏病、恶性肿瘤并称为当今世界三大致死性疾病[1],其中缺血性脑血管疾病的发病率最高,约占全部脑血管患者的70%[2]。缺血脑组织尽早恢复或再通血液灌注,重新获得血氧供应是临床上首要的治疗原则。但闭塞的脑血管再通的同时,会发生脑缺血再灌注损伤[3]。脑缺血再灌注损伤引起的神经细胞死亡主要有坏死和凋亡2种方式,细胞凋亡是重要的神经细胞死亡方式[4-5]。现在普遍认为细胞凋亡是一系列高度调控的半胱氨酸蛋白酶(caspase)级联反应事件的结果,在线粒体介导的细胞凋亡中,caspase-3处于该级联反应的下游,它通过降解细胞内相应底物使细胞死亡,与其他下游的caspase成员一起执行凋亡事件[6]。Bcl-2是重要的抗凋亡蛋白,可通过抑制caspase-3的生成和活化,发挥抑制凋亡的作用[7-8]。本实验采用Pulsinelli 4血管闭塞法制备大鼠弥漫性全脑缺血模型,观察Bcl-2和caspase-3在脑缺血再灌注后神经细胞死亡中的作用以及银杏叶提取物(extract of Ginkgo biloba, EGb761)对其的影响,探讨EGb761对脑缺血迟发性损伤保护的分子机制,为临床应用提供更充分的理论和实验依据。
1 材料和方法
1.1 仪器和试剂
RM2245德国Leica石蜡切片机;CH2日本Olympus生物显微镜;BAS124S德国Sartorius电子天平;3K15德国Sigma高速冷冻离心机;PowerPac Basic美国Bio-Rad Western blotting电泳仪;Epoch美国BioTek酶标仪;CFX Connect美国Bio-Rad荧光定量PCR仪;MDF-U53V日本Sanyo -80℃超低温冰箱。
末端脱氧核苷酸转移酶(TdT)、 逆转录试剂盒购自美国Promega公司;地高辛标记脱核苷酸(DIG-dUTP) 购自德国B.M公司;生物素化抗地高辛抗体(Anti-DIG-Biotin Body) 购自美国Sigma公司;TRIzol Reagent Kit购自美国Invitrogen公司;qPCR Kit购自日本Toyobo公司;BCA蛋白浓度测定试剂盒购自美国Thermo Scientific公司;抗Bcl-2抗体、抗Caspase-3抗体购自美国Abcam公司;辣根过氧化物酶标记的山羊抗兔IgG二抗购自美国EarthOx公司;DAB显色试剂盒及蛋白酶K由北京中山生物技术有限公司提供;EGb761由法国益普生药业公司生产。
1.2 动物模型及动物分组
健康雄性SD大鼠42只,体质量200~250g,由华中科技大学同济医学院动物室提供。将SD大鼠用水合氯醛(350mg/kg)腹腔麻醉后,将大鼠头部固定在颅脑定位仪上,剪毛后用75%乙醇消毒皮肤,经枕部正中切口,分离暴露第1颈椎两侧的横突翼小孔,电凝阻断双侧椎动脉。然后将大鼠仰卧位固定在实验台上,在颈正中切口分离暴露双侧的颈总动脉,勿伤及迷走神经。在颈总动脉下放置丝线,并打一活结松松地套在颈总动脉上,外置备用。24h后,用外置丝线将事先已分离的颈总动脉提起,用无损动脉夹迅速夹闭双侧颈总动脉,造成全脑缺血[9]。20min后,松开双侧颈动脉夹进行再灌注。局部喷洒庆大霉素注射液,再灌注时间为48 h。模型成功的标准是: 全脑缺血开始约1 min内,动物角膜反射消失,翻正反射消失,呼吸频率加快,眼球变白,缺血期间无抽搐,肛温在36.5℃~37.5℃。
将SD大鼠随机分为3组,每组14只。(1) 假手术组(Sham组),除不阻断颈总动脉外,余手术操作同动物模型制备。(2) 缺血再灌注组(IR组),术前用生理盐水按1ml/100g灌胃预处理,连续7d,每天1次。手术操作为动物模型制备。(3) EGb761预处理组(EGb组),将EGb761用蒸馏水配制成浓度为10mg/ml,然后按1ml/100g对大鼠进行术前预处理,给药方法同IR组。
1.3 取材
将SD大鼠用水合氯醛(350mg/kg)腹腔麻醉后,仰卧固定在动物台上。开胸后将灌注针头插入,直至升主动脉。先快速灌注温热生理盐水约50ml,后灌注约450ml 4℃的4%多聚甲醛磷酸缓冲液进行前固定。之后取脑,轻柔剥取双侧海马。预做原位末端标记(TUNEL)凋亡的标本于同种固定液中后固定6~12h,常规制成石蜡包埋块。预做透射电镜观察的标本固定在2.5%戊二醛中,4℃保存并于1周内常规电镜标本包埋。预做mRNA测定和免疫印迹检测的标本置于-80℃冻存。
1.4 TUNEL凋亡检测
采用末端脱氧核苷酸转移酶(TdT)介导的地高辛标记的脱氧脲苷酸(DIG-dUTP)缺口末端标记法对凋亡的神经细胞进行原位检测。
1.5 透射电镜观察
海马经2.5%戊二醛及锇酸后固定,按电镜标本制作,常规进行包埋,取海马冠状面切片,每只大鼠随机取4~5张切片,用日立-600型透射电镜对海马CA1区神经细胞进行超微结构观察并拍片。透射电镜在75kV 电压,放大倍数在5000~20000倍条件下,观察海马CA1区神经细胞超微结构的病理改变。
1.6 Bcl-2 和caspase-3 mRNA表达水平的测定
1.6.1 RNA提取和逆转录 按照TRIzol Reagent Kit操作说明书提取大鼠海马CA1区细胞总RNA,用酶标仪于260nm处测定吸光度(A)值,并计算RNA浓度。参照逆转录试剂盒要求的标准条件进行逆转录反应,反应条件为42℃,60min;95℃,5min。所得cDNA产物于-70℃保存备用。
1.6.2 引物的设计和合成 根据GenBank中大鼠β-actin、Bcl-2、caspase-3全序列,取其保守区,按照实时荧光定量PCR(qPCR)引物设计原则设计引物,引物序列由武汉擎科生物技术有限公司合成。Bcl-2 mRNA 引物(163bp)序列: 上游5′-ACGGTGGTGGAGGAA CTCTT-3′,下游5′-GCAGATGCCGGTTCAGGTA-3′。Caspase-3引物扩增产物(148bp)序列: 上游5′-A GAGCTGGACTGCGGTATTGAG-3′,下游5′-GAAC CATGACCCGTCCCTTG-3′。β-actin mRNA 引物扩增产物(116 bp)序列: 上游5′-CTCATGCCATCCTG CGTCT-3′,下游5′-ACGCACGATTTCCCTCTCA-3′。
1.6.3 PCR扩增 以逆转录后的cDNA为模板,按照qPCR Kit进行PCR扩增。反应体系(15μl)包括: 模板(cDNA)1.5μl,2×SYBR Green Real-time PCR Master Mix 7.5μl,上、下游引物(10μmol/L)各0.5μl,Nuclease-Free Water 5μl。PCR反应条件为: 95℃变性30s,60℃退火30s,72℃延伸50s,共39个循环。
1.7 免疫印迹检测Bcl-2和caspase-3蛋白表达水平
取保存于-80℃的海马组织,称重、提取CA1区组织蛋白;用BCA蛋白定量分析试剂盒(Thermo Pierce BCA Protein Assay Kit)检测蛋白浓度;加入5×SDS-PAGE 蛋白上样缓冲液,沸水中煮8min使蛋白变性;以12%的SDS聚丙烯酰胺分离胶和5%的浓缩胶电泳分离蛋白;湿法转移到NC膜上;5%脱脂奶粉封闭90min;加入兔抗大鼠Bcl-2(1∶1000)、caspase-3(1∶1000),4℃孵育过夜;洗膜后加入辣根过氧化物酶标记的山羊抗兔IgG二抗(1∶10000),室温下摇床孵育60min;洗膜后采用增强化学发光法显色,以β-actin (Abbkine)为内参。
1.8 图像分析
在同一放大倍数(×40)、同一光强度下对海马CA1区随机抽取15个不重复视野,测定TUNEL阳性标记的平均光密度值。
1.9 统计学处理
2 结果
2.1 TUNEL神经细胞凋亡
TUNEL染色IR组海马CA1区于再灌注48 h可见大量阳性神经细胞,呈散在分布,有些区域相对集中,阳性信号为胞核中的棕黄色颗粒;Sham组未见凋亡阳性细胞;EGb组凋亡阳性神经细胞较IR组明显减少(图1A1~C1)。经图像分析系统检测,Sham组、IR组和EGb组神经细胞凋亡阳性染色的平均光密度值分别为0.712±0.016、0.893±0.038和0.725±0.019。IR组凋亡阳性信号显著强于Sham组(P<0.01);EGb组凋亡阳性信号较IR组明显减弱(P<0.01),EGb组与Sham组相比,差异无统计学意义。
2.2 超微结构
IR组可见细胞膜皱缩,胞质电子密度升高,线粒体结构较清楚,线粒体嵴较规整,内质网明显扩张,胞核形状不规则,染色质浓缩边集或碎裂,核周膜不清,核膜皱缩; Sham组可见神经细胞核大且圆,染色质均匀分布,核仁清楚,核周隙清晰,核膜完整,胞质内线粒体结构清晰,线粒体嵴排列整齐,内质网无扩张,核糖体丰富,或附着于粗面内质网,或游离散在分布;EGb组可见神经细胞胞核清楚,染色质分布较均匀,核膜完整,线粒体结构清晰,线粒体嵴规整,内质网轻度扩张,核糖体较丰富,胞膜完整(图1A2~C2)。
2.3 Bcl-2 和caspase-3 mRNA的表达水平
与Sham组相比,IR组Bcl-2 mRNA表达水平显著下降,caspase-3 mRNA表达水平显著升高,差异有统计学意义(P<0.01);EGb组相较于IR组Bcl-2 mRNA表达水平明显升高,caspase-3 mRNA表达水平则明显降低(P<0.05)(图2)。
2.4 Bcl-2和caspase-3的蛋白表达水平
与Sham组相比,IR组Bcl-2 蛋白表达水平显著降低,caspase-3蛋白表达水平显著升高;EGb组相较于IR组Bcl-2蛋白表达水平明显升高,caspase-3蛋白表达水平则明显降低(图3)。
3 讨论
缺血性脑血管疾病是危害人类健康与生命的常见病和多发病,尤其是缺血后的再灌注损伤对人类健康危害较大。脑缺血再灌注损伤是一种常见的临床病理生理过程,在此过程中,除坏死外,还存在另一种细胞死亡形式,即细胞凋亡,且细胞凋亡可能在缺血再灌注损伤的病理过程中起着重要的作用[10-11]。近年来,细胞死亡机制已成为学者们研究的热点。自1972年美国病理学家Kerr等提出凋亡这一概念后,人们逐步认识到细胞凋亡是由多基因调控的细胞主动死亡的过程,具有重要的生物学意义[12-13]。
典型的细胞凋亡形态特征表现为胞膜表面皱缩起泡或芽变,失去微绒毛,与邻周细胞脱离联系;胞质电子浓度增高,线粒体结构清晰,线粒体嵴增多;内质网腔扩大,核膜皱缩,染色质浓缩边集,其中核的改变是最早的形态改变[14]。坏死细胞表现为肿胀,胞膜不连续,线粒体结构模糊,内质网高度扩张呈泡状,溶酶体破裂,染色质边集碎裂,核膜断裂[15]。本实验TUNEL染色和透射电镜结果显示,在脑缺血再灌注48h,虽然存在极小数的神经细胞坏死,但细胞凋亡仍是迟发性死亡期(DND)神经细胞死亡的主要方式[16]。

图1 各组大鼠海马CA1区神经细胞TUNEL染色(A1~C1)和超微结构(A2~C2)。A1: Sham组,细胞排列整齐,核大且圆,核仁清晰,无棕染的阳性神经细胞;B1: IR组,有2处凋亡神经细胞相对集中,胞核呈深棕黄色,另外可见数个核为棕色淡染的神经细胞;C1: EGb组,细胞排列较规则,凋亡阳性细胞少见,胞核呈棕黄色深染,×40;A2: Sham组,核圆形,染色质均匀分布,核膜完整,核周隙清晰,线粒体结构清楚,线粒体嵴排列规整,核糖体丰富,×8000;B2: IR组,胞核形状不规则,核膜连续,染色质浓缩、边集,线粒体结构较清楚,内质网高度扩张,×5000;C2: EGb组,核圆形,核膜连续,有异染色质附着于上,核周隙较清晰,线粒体嵴排列较规整,内质网轻度扩张,×20000.
Fig 1 TUNEL staining (A1-C1) and ultrastructure (A2-C2) in hippocampal CA1 neurons of rats in each group. A1: In sham group, cells were arranged in neat rows, with large and round nuclei, clear nucleoli, and there were non-brown-dyed positive neurons; B1: In IR group, there were two places where apoptotic nerve cells were relatively concentrated, and the nuclei were dark brown-yellow. In addition, there were a few of nerve cells with light brown nuclei; C1: In EGb group, the cell arrangement was relatively regular, apoptosis-positive cells were rare, and the nuclei were brownish dark-stained. ×40. A2: in sham group, the nucleus circle, the chromatin uniform distribution, the nuclear membrane integrity, the perinuclear space was clear, the mitochondrial structure was clear, mitochondrial ridge arrangement was neat, and the ribosomes were rich, ×8000; B2: In IR group, the nuclear shape was irregular, the nuclear membrane was continuous, chromatin concentration and edge set, the mitochondrial structure was clear, and the endoplasmic reticulum was highly dilated, ×5000; C2: In EGb group, the nucleus circle, the nuclear membrane was continuous with heterochromatin attached to it, the perinuclear space was clear, mitochondrial ridge arrangement was relatively regular, and the endoplasmic reticulum was slightly enlarged, ×20000.
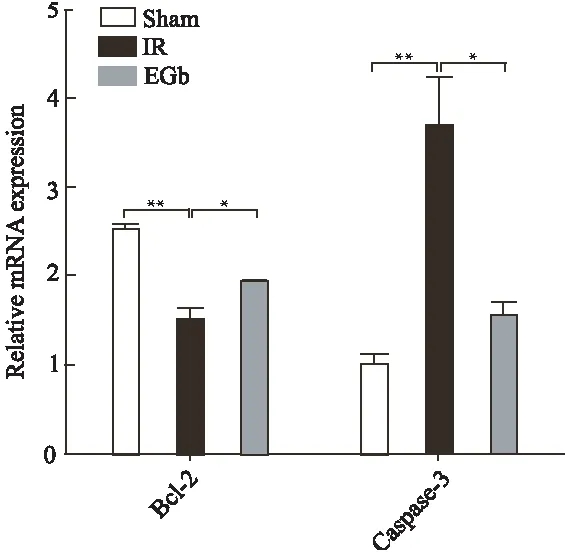
图2 各组大鼠海马CA1区神经细胞Bcl-2和caspase-3 mRNA的表达
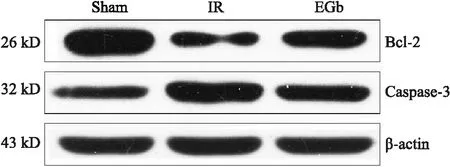
图3 各组大鼠海马CA1区神经细胞Bcl-2和caspase-3的蛋白
在脑缺血再灌注后神经细胞迟发性死亡期,线粒体是神经细胞缺血受损的靶细胞器,线粒体凋亡是细胞凋亡的第一步[17]。在线粒体凋亡途径中,缺血再灌注后产生大量氧自由基攻击线粒体,细胞色素C氧化酶去磷酸化,细胞色素C(Cyt-c)从线粒体进入到细胞质,激活凋亡蛋白酶活化因子-1(Apaf-1),活化的Apaf-1能够激活caspase-9,而活化的caspase-9继续激活下游的效应分子caspase-3,启动细胞凋亡[18]。caspase-3是一种特异的半胱氨酸蛋白酶,是线粒体凋亡通路下游的关键执行者,caspase-3活化后能够酶解、切割特异性底物如DNA依赖性蛋白酶(DNA-PK)、固醇调节元件结合蛋白(SREBP)等,通过改变它们的结构或影响特定信号分子而引起细胞凋亡[19]。
在正常细胞中,Bcl-2基因产物主要定位在线粒体、核周模及内质网上,发生凋亡时,Bcl-2转到线粒体外膜及其他细胞器膜上,与其他促凋亡蛋白如Bad结合或形成离子通道来维持线粒体外膜的完整性。Bcl-2能够与Apaf-1、caspase-9结合形成三元复合物,阻断细胞色素C释放至胞质,抑制下游凋亡级联反应,从而发挥抑制凋亡的作用[20]。本研究对Bcl-2和caspase-3的转录和蛋白水平进行检测,结果提示EGb761可能通过下调caspase-3和上调Bcl-2的表达和活化来减少脑缺血损伤后神经细胞的凋亡,从而促进神经细胞的存活。
EGb761是银杏叶中提取的有效成分,近年来研究表明,EGb761对脑缺血损伤具有抗过氧化、减轻兴奋性氨基酸毒性等广泛的生物活性[21],其对抗的这些不利因素都是凋亡发生的易感因素。本实验采用100mg/kg 的剂量,连续7 d用EGb761对SD大鼠进行灌胃预处理,结果显示TUNEL染色阳性神经细胞明显减少,未见坏死神经细胞;caspase-3 mRNA及蛋白表达减弱,Bcl-2 mRNA及蛋白表达增强;神经细胞超微结构病理改变的明显改善,程度也明显减轻,由此可推测EGb761对脑缺血再灌注后神经细胞凋亡具有显著的保护作用。EGb761对脑缺血再灌注损伤的保护作用机制可能是多方面的,本研究仅从caspase-3、Bcl-2两个凋亡相关基因进行了研究,并探索了其可能的作用机制,而这些机制还需要进一步深入的探讨,以明确这种保护作用是否具有剂量和时间依赖性。

