肠内营养支持对进展期胃癌术后营养及化疗耐受性的影响*
张迪,张立,陆宏伟,吉鸿,卢乐,张瑜,黎一鸣
(西安交通大学第二附属医院1.普通外科,2.内分泌科,陕西 西安 710004)
进展期胃癌患者由于肿瘤、手术及化疗等多种原因,或多或少存在营养状况不佳,而营养状况差不仅影响患者的生活质量,而且会增加治疗副作用,影响患者的依从性和耐受性,进而影响术后化疗的进行,甚至导致患者因无法耐受而终止治疗。对恶性肿瘤患者是否进行营养支持尚存在争议,有研究认为[1-2],化疗期间适当的营养支持可改善肿瘤患者的营养指标,提高患者对化疗的耐受性,进一步提高化疗对肿瘤患者的疗效。欧洲肠外肠内营养学会(ESPEN)制订的营养风险筛查,采用评分方法对营养风险进行评估,并建议对NRS评分≥3的患者进行临床营养支持。本研究对进展期胃癌患者化疗时的营养指标、免疫学指标、化疗毒副反应情况进行对比分析,现报道如下。
1 资料与方法
1.1 一般资料
选取2015年3月-2016年3月西安交通大学第二附属医院普通外科收治的54例进展期胃癌术后化疗患者,知情同意,自愿参加。按随机分组原则进行分组:实验组27例,其中,男性17例,女性10例,年龄48~61岁,中位年龄57岁,行远端胃癌根治术18例,近端胃癌根治术6例,全胃切除3例;对照组27例,其中,男性20例,女性7例,年龄48~61岁,中位年龄56岁,行远端胃癌根治术19例,近端胃癌根治术4例,全胃切除4例。
所有患者既往无恶性肿瘤病史及放化疗史,术后均恢复顺利,无心肺肾等伴随疾病,无代谢性疾病及免疫性疾病,实验过程中未发现肿瘤复发和转移,两组患者在性别、年龄、手术方式、肿瘤分期等各方面比较,差异无统计学意义(P>0.05)。所有患者均经病理检查确诊为进展期胃癌,都选用标准的FOLFOX4化疗方案,本研究已通过该院伦理委员会的审核。
1.2 治疗方法
两组患者于术后2周化疗,均采用FOLFOX4化疗方案(第1天5%葡萄糖500 ml+奥沙利铂150~200 mg静脉滴注,第1~5天,5%葡萄糖250 ml+亚叶酸钙200 mg静脉滴注,5%葡萄糖500 ml+氟尿嘧啶750 mg),所用患者均完成1个周期化疗,期间止吐及增强免疫力药物应用相同。
两组均有营养支持小组根据临床营养诊治流程进行治疗,术前两组患者营养风险筛查评分(NRS)差异无统计学意义(P>0.05),术后出院后化疗前,告知患者可能出现的化疗不良反应,指导进食高营养易消化食物,化疗出院后进行电话随访,鼓励患者进食,指导不良反应的应对措施,详细记录患者营养摄入情况,指导少量多餐饮食、鼓励增加营养摄入,所有患者的目标总供能为每天30~35 Kcal/kg,其中,碳水化合物 3 ~ 4 g/(kg·d),蛋白质 1.2 ~ 2 g/(kg·d),脂肪0.8~1.2 g/(kg·d),实验组患者在上述治疗基础上再给予口服营养素补充,营养素是在整个研究过程中一直服用。
1.3 观察指标
1.3.1 营养指标 两组患者于化疗前和化疗结束后检测体重、BMI,空腹抽取外周血,应用全自动生化分析仪检测前清蛋白、转铁蛋白、清蛋白、白细胞计数、IgA等。流式细胞仪检测T淋巴细胞亚群数量。不良反应评价:骨髓毒性、胃肠道反应及神经毒性。
1.4 统计学方法
数据分析采用SPSS 20.0统计软件,计量资料以均数±标准差(±s)表示,比较采用t检验和重复测量设计的方差分析,计数资料以率(%)表示,比较采用χ2检验,P<0.05为差异有统计学意义。
2 结果
2.1 两组患者一般资料比较
两组患者均为进展期胃癌患者,化疗前性别、年龄、手术方式、肿瘤分期等一般资料的比较差异无统计学意义(P>0.05)。见表 1。
2.2 化疗前后营养学及免疫学治疗比较
实验组与对照组化疗前后各指标变化比较采用重复测量设计的方差分析。结果:体重指数:①不同时间的比较有差异(F=10.010,P=0.002);②组间的比较有差异(F=3.121,P=0.027);③两组变化趋势的比较无差异(F=0.494,P=0.687)。清蛋白:①不同时间的比较有差异(F=14.670,P=0.000);②组间的比较有差异(F=6.662,P=0.000);③两组变化趋势的比较无差异(F=0.818,P=0.486)。前白蛋白:①不同时间的比较有差异(F=73.620,P=0.000);②组间的比较有差异(F=3.740,P=0.012);③两组变化趋势的比较有差异(F=8.759,P=0.000)。转铁蛋白:①不同时间的比较有差异(F=15.40,P=0.000);②组间的比较有差异(F=5.848,P=0.000);③两组变化趋势的比较无差异(F=2.350,P=0.074)。白细胞计数:①不同时间的比较无差异(F=0.162,P=0.687);②组间的比较有差异(F=8.902,P=0.000);③两组变化趋势的比较差异无统计学意义(F=0.753,P=0.522)。IgA:①不同时间的比较有差异(F=5.633,P=0.019);②组间的比较有差异(F=6.841,P=0.000);③两组变化趋势的比较无差异(F=1.440,P=0.232)。以上指标变化趋势说明在化疗过程中实验组较对照组有更好的营养状态。见表2。
两组患者化疗后两组指标相应下降,但实验组下降缓慢,差异有统计学意义(P<0.05)。结果:CD4+:①不同时间的比较有差异(F=4.315,P=0.039);②组间的比较有差异(F=8.548,P=0.000);③两组变化趋势的比较无差异(F=0.444,P=0.723);CD8+:①不同时间的比较无差异(F=0.054,P=0.816);②组间的比较无差异(F=0.087,P=0.967);③两组变化趋势的比较无差异(F=0.121,P=0.948)。CD4+/CD8+:①不同时间的比较有差异(F=4.025,P=0.046);②组间的比较无差异(F=0.480,P=0.696);③两组变化趋势的比较无差异(F=0.133,P=0.940)。综上各指标,化疗期间给予额外肠内营养可一定程度改善患者的免疫功能。见表3。

表1 两组患者一般资料比较
表2 两组患者营养学指标比较 (±s)
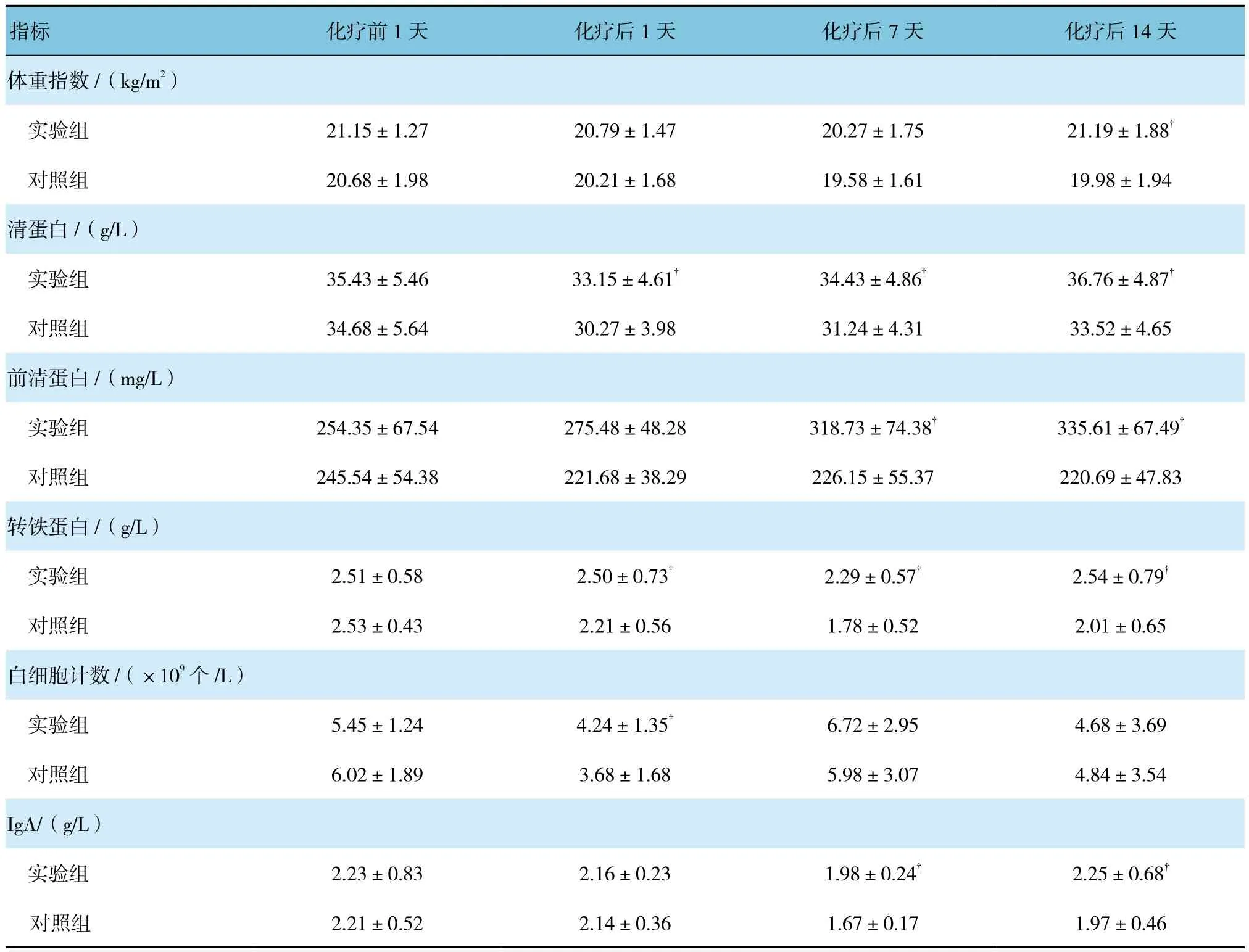
表2 两组患者营养学指标比较 (±s)
注:白细胞计数的比较,考虑到患者均常规应用具有升白作用的药物,因此该指标参考意义较小;†与对照组比较,P <0.05
指标 化疗前1天 化疗后1天 化疗后7天 化疗后14天体重指数 /(kg/m2)实验组 21.15±1.27 20.79±1.47 20.27±1.75 21.19±1.88†对照组 20.68±1.98 20.21±1.68 19.58±1.61 19.98±1.94清蛋白/(g/L)实验组 35.43±5.46 33.15±4.61† 34.43±4.86† 36.76±4.87†对照组 34.68±5.64 30.27±3.98 31.24±4.31 33.52±4.65前清蛋白/(mg/L)实验组 254.35±67.54 275.48±48.28 318.73±74.38† 335.61±67.49†对照组 245.54±54.38 221.68±38.29 226.15±55.37 220.69±47.83转铁蛋白/(g/L)实验组 2.51±0.58 2.50±0.73† 2.29±0.57† 2.54±0.79†对照组 2.53±0.43 2.21±0.56 1.78±0.52 2.01±0.65白细胞计数/(×109个/L)实验组 5.45±1.24 4.24±1.35† 6.72±2.95 4.68±3.69对照组 6.02±1.89 3.68±1.68 5.98±3.07 4.84±3.54 IgA/(g/L)实验组 2.23±0.83 2.16±0.23 1.98±0.24† 2.25±0.68†对照组 2.21±0.52 2.14±0.36 1.67±0.17 1.97±0.46
表3 不同免疫学指标比较 (±s)

表3 不同免疫学指标比较 (±s)
注:†与对照组比较,P <0.05
实验组指标对照组化疗前1天 化疗后1天 化疗后7天 化疗后14天 化疗前1天 化疗后1天 化疗后7天 化疗后14天CD4+ 39.76±6.67 37.47±6.85 34.51±7.62† 39.82±7.05† 38.89±8.32 36.58±6.73 31.42±5.68 36.75±6.82 CD8+ 25.29±5.34 25.68±5.71 24.94±6.02 25.68±5.83 25.01±6.53 24.87±5.74 25.41±4.52 25.59±5.79 CD4+/CD8+ 1.56±0.85 1.58±0.73 1.43±0.56† 1.59±0.74† 1.45±0.76 1.32±0.68 1.27±0.72 1.35±0.55
2.3 化疗不良反应评价
不良反应评价是以骨髓毒性、胃肠道反应及神经毒性等比较常见,并且与本化疗方案相关的项目进行评价。经比较,发现在骨髓毒性、胃肠道反应程度方面,两组差异有统计学意义(P<0.05),实验组较对照组减弱。见表4。

表4 两组患者化疗毒副反应比较 例
3 讨论
进展期胃癌就诊时常伴随不同程度的营养不良[3-4],其原因有以下几个方面:①肿瘤本身产生的抑制剂因子抑制食欲,肿瘤本身引起消化道梗阻,导致进食减少;②各种营养成分代谢紊乱,分解代谢增加,合成代谢减弱;③手术本身对消化道的切除与重建,影响患者食欲及消化吸收;④后续的放化疗产生一系列消化道症状,导致厌食、消化吸收障碍及能量代谢障碍。这一系列因素导致机体处于免疫抑制状态,因此进展期胃癌患者的营养状况不佳,免疫功能低下[5-7]。而机体免疫应答在肿瘤杀伤中起到重要作用,这种状态直接影响患者的治疗效果,降低患者的生活质量,最终可能影响患者的疗效和预后,因而中晚期胃癌患者的治疗效果差强人意[8-9]。对于存在体重下降,营养不良的非终末期肿瘤患者化疗期间应该给予肠内营养,以改善或维持营养状况,改善患者生活质量[10-11]。
目前,对于恶性肿瘤患者是否给予营养支持治疗仍存在较大的争议[12-13],加强肿瘤患者的营养支持有可能促进患者体内残余肿瘤细胞的增殖,但另一方面,由于营养不良也可降低机体的免疫功能,影响机体的抗肿瘤作用,并且营养不良的肿瘤患者如果应用合适的全肠外营养可迅速纠正NK细胞活性的低下[14-15]。也有报道[16-18]显示,对肿瘤患者给予营养支持可增加机体营养物质储备,提高机体的营养状况,增强机体免疫功能,增强患者的免疫抗病能力,提升患者对癌症治疗的耐受性,以促进针对肿瘤治疗的顺利完成,并且可以减轻化疗的毒副作用,可以提升患者对癌症治疗的耐受能力,提高患者的营养状况。
本研究对进展期胃癌患者化疗期间在正常营养指导的基础上给予肠内营养制剂,结果显示,两组患者化疗前后各项营养指标比较差异无统计学意义,而化疗后,实验组各项营养指标与对照组比较差异有统计学意义,如前清蛋白、转铁蛋白、清蛋白等。通过对淋巴细胞亚群进行分析显示,实验组患者化疗后CD4+、CD4+/CD8+较对照组改善,这说明,在化疗期间给予额外肠内营养制剂可改善机体营养状态,改善患者免疫功能,可使患者对化疗耐受度增加,可能取得更好的治疗效果[19-20]。通过两组化疗期间各项副反应情况,实验组患者的化疗副反应减弱,通过对患者的营养支持,可使进展期胃癌术后患者化疗期间临床受益,提高化疗耐受性,改善患者的生活质量[21-22]。
综上所述,恶性肿瘤患者化疗期间的营养支持对患者有益[23-24],本文显示,对于进展期胃癌的术后治疗,应加强患者的营养支持,在正常营养指导的基础上加用肠内营养制剂,可以明显提高患者的化疗耐受,避免避免体质下降,改善机体的免疫功能,使患者能耐受化疗,为完成后续治疗提供了良好的基础,使进展期胃癌术后后续治疗过程中临床获益。

