采摘期对川秋葵木质素代谢及相关酶活性的影响
辛松林,向泽攀,亢小勤,肖 川,秦 文*
(1.四川农业大学 食品学院,四川 雅安 625014;2.四川旅游学院 食品学院,四川 成都 610100)
秋葵又名补肾草、羊角豆,属于锦葵科秋葵属一年生草本植物[1],现多作为功能性蔬菜食用[2]。秋葵采后非常容易老化,在室温下仅能贮藏2~3 d,如果不能及时销售或加工,果实会由原来的细嫩、多汁变为质地生硬、粗糙、少汁,严重影响秋葵的商品性。木质素是由肉桂醇等单体通过聚合生成的具有复杂结构的酚类多聚体[3],是植物细胞壁在次生加厚过程中形成的主要结构物质[4],在维持细胞壁的物理特征、疏水性、输导性能和机械强度方面起着基础作用[5],而且在抵御病菌微生物侵害方面也具有非常重要的作用[6]。目前,已对枇杷[7]、琯溪蜜柚[8]、草莓[9]、枸杞[10]等开展了果实采前木质素在逆境抗性方面的研究,对南丰蜜橘[11]、砀山酥梨[12]、黑果枸杞[13]等开展了果实采后木质素在逆境抗性方面的研究,但关于秋葵果实木质素代谢的研究鲜有报道。秋葵果荚采摘前的木质素代谢程度会影响其采摘后在贮藏过程中的衰老进程[14]。本试验以川秋葵为材料,对采摘前秋葵果实木质素代谢、细胞壁成分,以及部分相关酶活性进行测定和分析,深入了解秋葵果实生长、成熟及老化过程中木质素代谢的特征和规律,阐明采摘期对秋葵果实木质素代谢及相关成分的影响,旨在为确定较合理的果实采收时间提供理论依据。
1 材料与方法
1.1 材料
2006—2015年,四川省植物工程研究院引种非洲黄秋葵成功,并从中选育出适合四川省栽培的黄秋葵新品种——川秋葵1号。本试验所用秋葵品种为四川省植物工程研究院提供的川秋葵1号。结果盛期,每天上午8:00从田间采收不同长度的果实,通过前期的观察及数据统计,以花自然掉落当天为0 d(即盛花期后0 d),在13 d果实完全老化、木质化,丧失商品价值无法食用,据此,将采收期分为8个时间点,每个时间点采收30个果实(表1、图1)。
试验所用主要仪器有UV-3200扫描型紫外/可见分光光度计(上海美谱达仪器有限公司)、冷冻高速离心机(美国Thermo公司)、恒温水浴锅、电子天平、培养箱等。
1.2 方法
1.2.1 木质素形成相关酶的测定
苯丙氨酸解氨酶(phenylalanine ammonia-lyase,PAL)活性测定参照Liu等[15]的方法,于290 nm处测定吸光度,酶活性以1 g样品1 h吸光度变化0.01为1个酶活性单位(U·g-1,以样品鲜质量计);肉桂酸-4羟化酶(cinaamate 4-hydroxylase,C4H)测定参照Lamb等[16]的方法,于340 nm处测定吸光度,酶活性以1 g样品1 min吸光度变化0.01为1个酶活性单位(U·g-1,以样品鲜质量计);4-香豆酰-辅酶A连接酶(4-coumarate-CoA ligase,4CL)活性测定参照朱明华等[17]的方法,于333 nm处测定吸光度,酶活以1 g样品1 min吸光度变化0.1为1个酶活性单位(U·g-1,以样品鲜质量计);肉桂醇脱氢酶(cinnamyl alcohol dehydrogenase,CAD)活性测定参照Morrison等[18]的方法,于340 nm处测定吸光度,酶活性以1 h吸光度变化0.01为1个活性单位,计算酶比活性(U·mg-1,以蛋白质含量计);过氧化物酶(peroxidase,POD)活性测定参照Jiang等[19]的方法,酶活性以1 g样品1 min在470 nm处吸光度变化0.01为1个酶活性单位(U·g-1,以样品鲜质量计);多酚氧化酶(polyphenoloxidase,PPO)活性测定参照Galeazzi[20]的方法,以1 g样品1 min在420 nm处吸光度增加0.01为1个酶活性单位(U·g-1,以样品鲜质量计)。
表1秋葵果实采摘时间
Table1Picking time for okra fruit
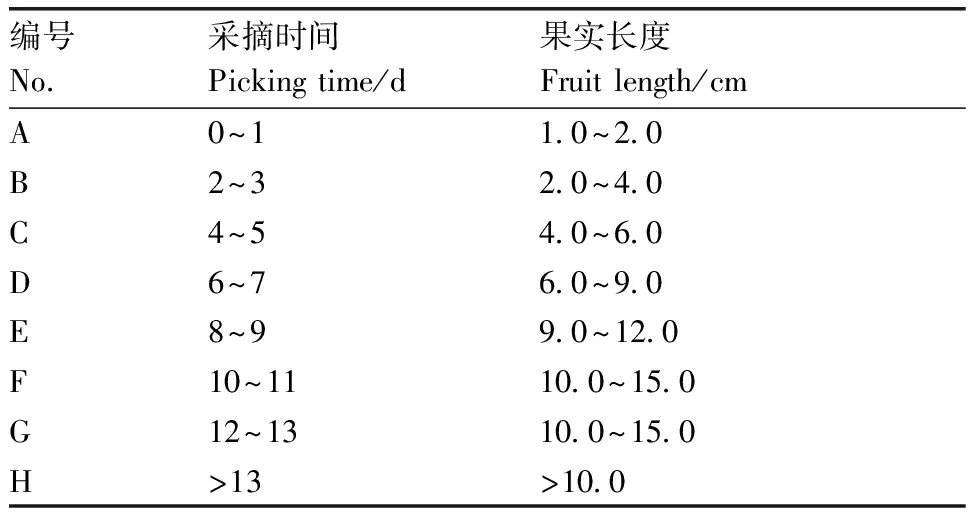
编号No.采摘时间Picking time/d果实长度Fruit length/cmA0~11.0~2.0B2~32.0~4.0C4~54.0~6.0D6~76.0~9.0E8~99.0~12.0F10~1110.0~15.0G12~1310.0~15.0H>13>10.0
盛花后长出果实计为0 d,此时果实长度为1.0~1.5 cm。
Marked 0 d as the pod appear after bloomed, the length was 1.0-1.5 cm at this time.

图1 不同采摘时间秋葵果实形态Fig.1 Appearance of okra pod picked at different time
1.2.2 秋葵果肉组织成分的测定
水溶性果胶和原果胶的测定参照曹建康等[21]的方法,用半乳糖醛酸做标准曲线,计算果肉组织中水溶性果胶和原果胶含量,以产生半乳糖醛酸的质量分数(%)表示;纤维素相对含量的测定参照袁莉[22]的方法,纤维素相对含量以单位样品(g)的D620值变化表示;木质素相对含量的测定参照Morrison[23]的方法,木质素相对含量以单位样品(g)的D280值变化表示;总酚和类黄酮相对含量的测定参照曹建康等[21]的方法,总酚相对含量用单位样品(g)的D280值变化表示,类黄酮相对含量用单位样品(g)的D325值变化表示。以上物质含量均以样品鲜质量计。
1.3 数据处理
所有样品平行测定5次,数据釆用Microsoft office excel和SPSS 22.0软件处理。
2 结果与分析
2.1 木质素合成关键酶活性
随着秋葵花后生长时间的延长,PAL最低活性出现在花后8~9 d,如图2-A所示,此时果实长度为9.0~12.0 cm,活性为112.7 U·g-1;PAL最高活性出现在盛花期后12~13 d,此时果实长度为10.0~15.0 cm,活性为559.05 U·g-1。PPO能够在酚类物质氧化过程中发挥作用,有助于木质素前体物质的形成。如图2-B所示,花后0~13 d,PPO酶活性呈现波动性变化,为0.12~0.72 U·g-1,并总体呈下降趋势,在花后0~1 d活性最高。POD是催化木质素单体合成木质素的重要酶类,影响组织的木质化。如图2-C所示,秋葵果实POD活性在花后0~5 d缓慢升高,并在花后4~5 d达到最高值,随后在6~7 d出现显著下降,并在8~9 d时出现再次升高,之后缓慢降低。
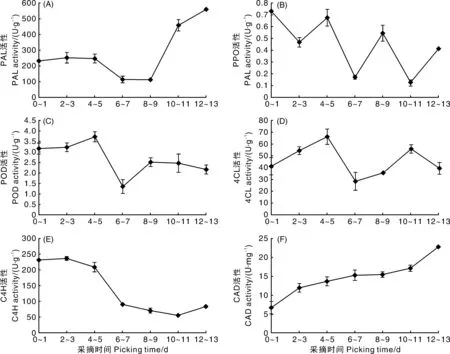
丙氨酸解氨酶、多酚氧化酶、过氧化物酶、4-香豆酰-辅酶A连接酶、肉桂酸-4羟化酶活性以鲜质量计;肉桂醇脱氢酶活性以蛋白含量计。Activities of PAL、PPO、POD、4CL、C4H were detected based on fresh weight. Activity of CAD was detected based on protein content.图2 不同采摘时间对秋葵苯丙氨酸解氨酶、多酚氧化酶、过氧化物酶、4-香豆酰-辅酶A连接酶、肉桂酸-4羟化酶、肉桂醇脱氢酶活性的影响Fig.2 Effects of picking time on the activities of PAL、PPO、POD、4CL、C4H、CAD in okra pod
秋葵果实4CL活性呈波动性变化趋势,在花后4~5 d 时达到最大值,为66.3 U·g-1,如图2-D所示,随着秋葵的成熟衰老,其4CL活性呈波浪式上升,盛花期后10~11 d时达到第2个高峰值,为55.7 U·g-1。如图2-E所示,秋葵果实C4H的活性呈现下降趋势,即随着秋葵果实长度的增加,C4H活性逐渐降低,C4H活性最高值为236.7 U·g-1,最低值为54.8 U·g-1,差异极显著(P<0.01)。如图2-F所示,随着秋葵在盛花期后时间的延长,CAD活性呈上升趋势,盛花期后12~13 d CAD活性最高,为22.8 U·mg-1,比CAD活性最低时高244%。
2.2 采摘时间与秋葵果实木质化相关指标的关系
2.2.1 采摘时间对秋葵木质素、纤维素相对含量的影响
随着采摘时间推迟,秋葵果实中木质素相对含量呈上升趋势,含量大幅度提高出现在花后3~5 d,如图3-A所示。木质素相对含量在8~9 d下降,之后又上升,在花后12~13 d达到高峰0.97 g-1。
纤维素和木质素变化趋势相似。如图3-B所示,随着秋葵生长期的延长及果实长度的增加,秋葵果实中纤维素相对含量不断增加,盛花期后3~5 d纤维素相对含量增加迅速,由0.25 g-1上升到0.60 g-1,增加了140%。
2.2.2 果实采摘时间与果实类黄酮、总酚相对含量的关系
酚类物质、黄酮类物质是木质素合成的前体物质,与木质素的合成密切相关。如图4所示,秋葵果实的总酚和类黄酮相对含量均呈先上升后下降的趋势,类黄酮相对含量在花后4~5 d达到峰值3.44 g-1,总酚相对含量在花后2~3 d达到峰值2.24 g-1,随后缓慢下降。

数据以鲜质量计。下同。Data were detected based on fresh weight. The same as bellow.图3 果实采摘时间对秋葵木质素、纤维素相对含量的影响Fig.3 Effects of picking time on relative contents of lignin and cellulose in okra pod
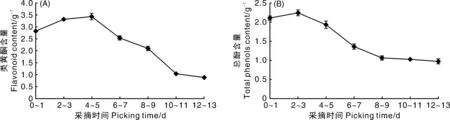
图4 果实采摘时间对秋葵类黄酮、总酚相对含量的影响Fig.4 Effects of picking time on relative contents of total phenolic and flavonoid in okra pod
2.2.3 果实采摘时间对原果胶、水溶性果胶含量的影响
随着采摘时间的增加,秋葵原果胶含量呈先上升后下降趋势(图5-A),水溶性果胶在整个采摘期均呈现上升趋势,并在花后10~11 d显著升高(图5-B)。

图5 果实采摘时间对秋葵原果胶、水溶性果胶含量的影响Fig.5 Effects of picking time on contents of protopectin and water soluble pectin in okra pod
3 结论与讨论
在秋葵果实发育过程中,木质素、纤维素相对含量大幅度提高出现在花后2~5 d,即果实长度2.0~6.0 cm,之后木质素相对含量上升缓慢;PAL和C4H活性在花后5 d之后显著下降,6~7 d比4~5 d分别降低53.4%和57.0%,4CL活性、POD活性、原果胶含量、类黄酮相对含量在花后4~5 d达到最大值。此外,PAL、C4H、4CL这3个关键酶在不同采收时间呈现较明显的对应变化关系,但出现峰值或谷值并不在同一时间点,这可能与秋葵木质素合成的前体物质或非酶类反应有关。从川秋葵果实营养价值、保健功能和食用品质角度考虑,认为川秋葵果实最佳采收时间为花后4~5 d(果实长度为4.0~6.0 cm)。
3.1 木质素合成途径酶的变化
木质素单体经过苯丙烷途径合成,PAL是苯丙烷代谢途径中催化第一步反应的酶,是木质素合成的限速酶[24-25],能催化和调控酚类、类黄酮等抗菌物质的合成;C4H是催化苯丙烷代谢途径第二步反应的酶,PAL酶促作用的产物肉桂酸是C4H的作用底物,而肉桂酸含量增加可诱导C4H活性增强[26-27];4CL是苯丙烷代谢途径中的最后一个酶,经过一系列反应最终生成酚类、木质素等物质[28];不同植物的4CL功能不尽相同,通常认为在木质素单体合成途径中4CL为限速步骤[29]。本研究发现,采摘期内PAL活性在花后6~9 d降到较低水平,之后显著升高,C4H呈现下降趋势,4CL呈现M型波动变化,其峰值出现在花后4~5 d,而这一时间段也是木质素和纤维素含量迅速升高的阶段,因此,可以推断花后4~5 d是秋葵品质形成重要时期。POD和PPO是苯丙烷代谢途径末端反应的相关酶,参与细胞壁的生长和交联化反应[30]。本试验结果表明,在木质素含量上升时,秋葵果实中POD和PPO活性却呈波动式下降趋势,间接表明秋葵木质素单体的聚合可能是一个非酶促的过程[31]。
3.2 采摘期与秋葵果实品质指标关系
果实质地主要取决于果胶、纤维素、木质素等细胞壁物质的质和量,它是果实品质的重要指标,又与果实的成熟衰老密切相关[7]。果胶物质有黏结细胞个体的作用,木质素可通过形成交织网使细胞相连,强化细胞壁,纤维素有支持细胞骨架和保护的作用[32]。纤维素和木质素含量随果荚长度的增加而增加,木质素和纤维素含量的变化直接影响果实的质地,其含量越高质地越老,口感粗糙,从而降低可食性[33]。未成熟的秋葵果实中果胶物质与纤维素结合以原果胶形式存在,秋葵果实原果胶含量较高,使得果实坚实、脆硬。随着秋葵果实的成熟,果胶物质逐渐与纤维素分离形成水溶性果胶,因此,果实长度较长的秋葵水溶性果胶含量较高。
3.3 采摘期与秋葵功能性成分变化关系
酚类、黄酮类作为功能性成分,其含量决定了植物营养及保健功能。此外,酚类、黄酮类物质作为苯丙烷类代谢途径的次级代谢产物[34],在植物的生长发育、抵御病虫害、抗逆反应等方面发挥着重要作用[35]。秋葵总酚含量在花后4~5 d达到峰值,而类黄酮含量则在花后2~3 d达到峰值。徐康[36]以“绿箭”为材料,发现秋葵果实总酚及黄酮含量在花后0~11 d逐渐升高,之后快速降低。本研究结果与此不一致,推测是不同品种植物的功能性成分变化有差异造成的。

