新形势下中药注射剂存在的问题及对策Δ
张 勇,周 燕
(内蒙古自治区人民医院药学处,内蒙古 呼和浩特 010017)
中药注射剂是传统药还是现代药?1985年7月1日起实施的《中华人民共和国宪法和药品管理法》即明确提出了国家发展现代医药和传统医药的要求。2017年8月29日,毕井泉同志在第十一届药典委员会成立大会上的讲话中,就现代药与传统药的基本概念、内涵和外延如何界定做了详细的介绍。
1 现代药与传统药的基本概念
1.1 传统药的定义
传统药是在传统的医学理论、传统的制备方法指导下,采取传统的剂型和使用方式、传统的适应证表述和传统的循证方法,有多年使用历史、公众认可的药品。
1.2 现代药的定义
现代药是以医学、化学和生物学等理论为基础;一般都具有明确的活性成分,并不断研究完善其作用机制;现代药有双盲、随机、大样本的临床试验证据,获益大于风险的适应证结论,产品均一、稳定的质量控制。
1.3 中药注射剂的传统药与现代药之争
《中药注射液学》中定义,“中药注射液是指中医药理论为指导,采用现代科学技术和方法,从中药或天然药物的单方或复方中提取有效物质制成的无菌溶液、混悬液或临用前配成溶液的灭菌粉末供注入体内的制剂”。中药、天然药物注射剂的给药途径不同于传统剂型,大多数情况下,传统用药经验对注射剂处方组成的配伍及配比的指导作用有限。中药、天然药物注射剂的开发需要通过研究充分说明其安全性、有效性及必要性,并保证其质量的可控性[1]。如果用现代医学、现代药学理论,现代制备方法和现代循证方法研究传统药,其成果应按现代药申报、审评和监管。一个无法回避的事实就是中药注射剂多在2002年之前按传统药被批准上市,受当时科技水平和研究条件所限,与现代药相比,产品自身研发不够充分,其有效性、安全性存疑。因此,目前我国上市的中药注射剂都应按现代循证方法进行有效性、安全性的再评价,使其符合现代药的要求。
2 中药注射剂存在的问题
2.1 中药注射剂批准文号及生产厂家较多,品种分类较混乱
截至2018年4月20日,在原国家食品药品监督管理总局网站中查询“药品”→“国产药品”→“中药”,再输入“注射剂”,可查到我国已上市中药注射剂通用名称共134个,涉及批准文号923个,部分品种过度重复现象严重,如鱼腥草注射液、香丹注射液的批准文号数量>100个。批准文号数量排序居前10位的中药注射剂品种见表1。
2.2 中药注射剂致药品不良反应分析
2001年11月至2017年12月,原国家食品药品监督管理总局共发布76期《药品不良反应信息通报》,其中15期涉及中药注射剂所致药品不良反应;通报中药注射剂20品次,其中清开灵注射液、双黄连注射液、葛根素注射液及穿琥宁注射液4种中药注射剂被通报2次。
表1批准文号数量排序居前10位的中药注射剂品种
Tab1Top10categoriesoftraditionalChinesemedicine
injectionsrankedbytheapprovenumber

排序药品通用名批准文号数量/个1鱼腥草注射液1252香丹注射液1203柴胡注射液784丹参注射液765板蓝根注射液446血塞通注射液437红花注射液358参麦注射液339黄芪注射液2710生脉注射液25
原国家食品药品监督管理总局发布的前11期《药品不良反应信息通报》中涉及的中药注射剂品种达8种之多,占通报中药总品种数的66%。2017年药品不良反应/事件报告中的中药监测情况见图1—3,其中,涉及怀疑药品142.9万例次,中药注射剂所致药品不良反应占全部药品不良反应的8.7%,占比较高,需要继续关注其安全用药风险。
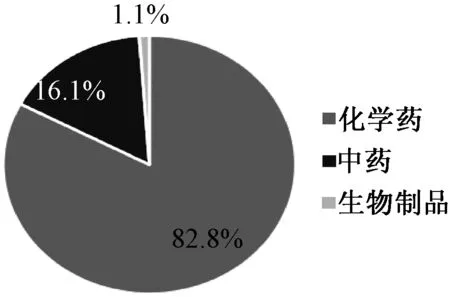
图1 2017年药品不良反应/事件报告涉及药品类别分布Fig 1 Distribution of drug categories related to adverse drug reaction/adverse drug event in 2017

图2 2017年中药致药品不良反应/事件报告的给药途径分布Fig 2 Distribution of routes of administration in adverse drug reaction/adverse drug event induced by traditional Chinese medicine injections in 2017
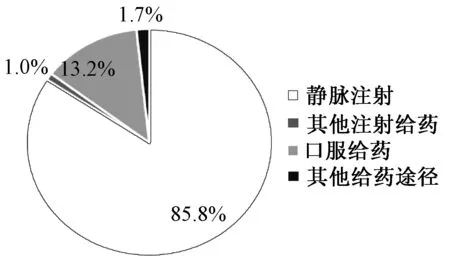
图3 2017年中药致严重药品不良反应/事件报告的给药途径分布Fig 3 Distribution of routes of administration in sever adverse drug reaction/adverse drug event induced by traditional Chinese medicine injections in 2017
2.3 中药注射剂临床应用中存在的问题
(1)药品说明书对临床合理用药指导不足:①适应证用中医术语描述,西医无能力辨证;②用法与用量的描述不够精准,缺乏可操作性(如药物浓度、滴注时间);③禁忌证不明确;④缺乏老年人、儿童及妊娠期妇女用药安全数据;⑤药物相互作用、药物过量数据缺乏;⑥药理毒理、药动学数据缺乏;⑦药品说明书长期不更新[2]。(2)临床使用环节存在问题:①未(无能力)辨证施治;②超说明书用药;③西医用中药;④未在有抢救措施的医疗机构使用[3]。
2.4 中药注射剂已上市品种存在的问题
上市后再评价问题:缺乏规范的、符合循证医学要求的临床研究数据,很难进入治疗规范、指南和临床路径[4]。有效性评价的研究对于中药注射剂非常重要。药品的属性要求药品首先要有效,在有效的基础上安全。中药注射剂由于历史原因,以往国家未要求进行药物代谢、药理等试验,虽然临床的应用数据显示出有效性,但大型、高质量的临床有效性研究极少,这也是导致很多中药无法走向国际市场的主要原因。进行再评价工作的中药注射剂品种数量较少,截至2017年8月31日,药物临床试验登记与信息公示平台网站公布已完成临床试验的中药注射液有16种,临床试验进行中的中药注射液有9种。
3 目前中药注射剂所处形势
党中央高度重视药品安全监管工作,多次作出重要指示,要求用“最严谨的标准、最严格的监管、最严厉的处罚、最严肃的问责”严把从实验室到医院的每一道防线。在这个标准下,中药注射液也面临行业严查。下一步的重点工作是“分期分批推进已上市注射剂有效性、安全性评价”。
2008年以后,监管部门批准上市的中药注射剂品种只有2个。《中华人民共和国药典》(2015年版)对中药注射剂安全性的控制收紧,在制药行业,注射剂型的工艺难度普遍高于口服剂型,注射剂型的技术要求和质量标准是最严格的,注射剂必须成分清晰、药品纯净度高、疗效有充分证据且毒副作用明确[5]。中药注射剂却有违这些基本原则,其安全性需要考量。中药注射剂需提升批次间的一致性[6]。部分生产企业偷工减料、使用假劣原料、擅自改变生产工艺,严重影响药品的安全性、有效性[7]。张铁军等[8]提出基于“五原则”(质量传递与溯源、成分特有性、成分与有效性关联、复方配伍环境和复方配伍环境)的复方中药质量标志物研究和发现的路径,并以代表性的研究实例,为中药质量标志物的研究和发现提供了系统的研究思路和范例。
医保方面的问题:部分价格昂贵的中药注射剂,未经循证医学评价和药物经济学评价即进入国家医保目录,造成医保费用的不合理增长,加重了医保费用支出的负担[9-10]。2017年2月23日,人力资源社会保障部印发了《2017年版国家基本医疗保险、工伤保险和生育保险药品目录》,对医保目录进行了调整,中药注射剂受到的冲击较大,有38个中药注射剂限用于二级及以上医疗机构,限用于重症。
4 对策:严格落实各方责任,依法依规作为
(1)企业(申办方)要认清形势,依法、依规对本企业中药注射剂品种进行有效性、安全性再评价。2017年举办的“中药新药及健康产品研发与国际化发展论坛”就中药、天然药物新药和健康产品研发的新理念、新思路、新方法、新成果和新经验等进行深入交流,共同研讨新产品研发及国际化发展的关键问题[11]。(2)国家药品监督管理部门严格按照药物非临床研究质量管理规范、药物临床试验质量管理规范、药品生产质量管理规范和药品经营质量管理规范对中药注射剂进行全过程监管。欧阳楠等[12]提出,对于中药制剂,应紧紧围绕保证中药制剂的质量这一核心,针对不同类别和特点的中药制剂采取不同的药材及饮片监管模式。王鑫等[13]指出,中药国际标准的研究制定是必然趋势,应在提高我国中药标准的国际认可度和参与中药国际标准的制定这2个方面多下功夫。(3)国家卫生健康委员会对所管辖医疗机构是否合理使用中药注射剂进行常态化监管。(4)医疗机构严格落实医师、药师和护士在使用中药注射剂过程中的责任,保证合理用药[14-15]。要求医护人员根据《关于进一步加强中药注射剂生产和临床使用管理的通知》(卫医政发〔2008〕71号),严格按照药品说明书用药,严格掌握药品的功能主治和禁忌证;加强用药监测,医护人员使用中药注射剂前,应严格执行用药查对制度,发现异常,立即停止使用,并按规定报告;临床药师要加强对中药注射剂临床应用的指导,确保用药安全。

