低氧训练对肥胖大鼠骨代谢的影响
路瑛丽,荆 文,冯连世,张 漓,徐建方
低氧训练对肥胖大鼠骨代谢的影响
路瑛丽1,荆 文2,冯连世1,张 漓1,徐建方1
1. 国家体育总局体育科学研究所, 北京 100061; 2. 山东师范大学 山东 济南, 250014
目的:探讨低氧训练降低体重的同时对肥胖大鼠骨代谢的影响。方法:3周离乳大鼠,高脂饲料喂养12周致肥胖,经过适应性训练后挑选肥胖大鼠40只,分成4组,常氧安静组、常氧训练组、低氧安静组、低氧训练组,每组10只。训练组用水平动物跑台进行耐力训练,训练强度为常氧下25 m/min,低氧下20 m/min(低氧浓度为13.6%,相当于3 500 m海拔高度),持续运动1 h/天、6 天/周、共4周。最后一次训练后恢复24 h取材,取材前大鼠禁食、禁水12 h,称重麻醉,量身长,计算Lee’s指数;腹主动脉取血分离血清,ELISA测血清骨代谢标志物骨钙素(OC)、骨碱性磷酸酶(BALP)、I型原胶原C端前肽(PICP)、I型原胶原N端前肽(PINP)、I型胶原交联C-末端肽(CTX)、I型胶原交联N-末端肽(NTX)、抗酒石酸酸性磷酸酶(TRACP)。取双侧肾周和附睾脂肪,称重,计算脂体比。分离左侧股骨和胫骨,称重,计算骨体比。双能X光检测大鼠股骨和胫骨两端以及中点的骨矿含量和骨密度,取3点的平均值作为股骨和胫骨的骨矿含量和骨密度。研究结果:1)与常氧安静组比较,低氧训练肥胖大鼠体重、lee’s指数及脂体比均显著降低(<0.01),骨体比显著升高(<0.05);2)股骨、胫骨的骨密度以及骨矿含量低氧训练与各组间均无显著差异(>0.05);3)低氧训练组肥胖大鼠血清骨形成标志物OC、PICP、PINP较常氧安静组和低氧安静组均显著升高(<0.05),其中PICP显著高于常氧训练组(<0.01),低氧训练组肥胖大鼠血清骨吸收标志物CTX、NTX和TRAP较常氧安静组和常氧训练组均显著升高(<0.05,<0.05,<0.01)。结论:1)4周低氧训练可降低肥胖大鼠体重、脂体比,增加骨体比;2)4周低氧训练促进肥胖大鼠骨形成和骨吸收,骨代谢处于动态平衡,尚未对股骨和胫骨骨密度产生明显影响。
低氧训练;肥胖大鼠;骨代谢
有研究认为,肥胖作为骨量的一种保护因素,可增加骨骼负重,促进骨形成,提高负重骨的骨密度,故而,肥胖者(尤其是承重骨)的骨密度较正常体型或消瘦者高[15]。在一定范围内,体重越大骨矿物质含量越高[20]。BMI是影响骨密度的一个重要指标,保持适当BMI对骨丢失有保护作用,轻度肥胖儿童(25>BMI≥23)的骨密度高于正常人群,BMI超过一定限度后(≥25)这种保护作用不复存在,骨密度不再增高,反而急剧下降,且骨密度与BMI负相关[7,8]。也有研究表明,肥胖青年承重骨骨量及骨密度与其体质量相关,在平衡体脂因素后肥胖者与对照组骨密度无显著性差异。提示,肥胖患者在进行体重控制的同时应加强运动来减少体质量减轻所造成的骨量流失[13]。在平衡饮食的基础上进行体育锻炼,有助于增加超重、肥胖儿童的骨量[35],而一项为期1年的随机对照试验表明,减重和运动干预使肥胖老年人骨转换增加,髋部骨量降低[22]。
低氧训练作为降低体重特别是脂肪重的有效手段,受到了越来越多的关注。低氧训练能够控制肥胖大鼠体重增长,降低肥胖大鼠体重指数和体脂,抑制脂肪酸合成,促进脂肪酸分解,增强脂肪酸氧化[12]。人体实验也证明了低氧训练能够降低肥胖青年的体重和体脂,且高原训练降体脂效果最好[1],表明高原训练对体成分有很好的改善作用。那么,低氧训练减重的同时,对肥胖机体的骨密度有什么影响呢?本研究旨在建立肥胖大鼠低氧训练模型,观察低氧训练降体重的同时对肥胖大鼠骨密度的影响,同时从骨形成和骨吸收标志物入手,探讨低氧训练对肥胖大鼠骨代谢的影响。
1 研究对象与方法
1.1 研究对象与材料
动物模型建立同荆文博士论文[10]。出生21天的离乳雄性SD大鼠100只,购自北京维通利华实验动物技术有限公司,体重56.46±3.59 g,分笼饲养,每笼5只。普通饲料(实验鼠生长维持颗粒饲料,玉米粉40%、面粉20%、豆粕20%、麸皮9%、鱼粉6%、酵母粉1%、豆油1%、食盐0.8%、磷酸钙2%、多种微量元素0.2%)饲养1周后(体重92.12±6.09 g),随机分为2组,普通饲料组10只大鼠依然普通饲料饲养,高脂饲料组90只大鼠高脂饲料饲养(普通饲料主要成分的68%、猪油10%、白糖10%、奶粉10%、豆油1.04%、食盐0.8%、磷酸钙2%、多种微量元素0.2%)。自然光照、室温21℃~23℃、湿度40%~60%,自由饮食饮水。
12周后,从高脂饲料组中体重大于普通饲料组平均体重的58只大鼠中随机选出10只,保证与剩余48只大鼠平均体重无显著差异。取材测试比较10只高脂饲料大鼠与10只普通饲料大鼠的体重、Lee’s指数、脂肪重(附睾脂肪+肾周脂肪)、脂体比{脂体比=[肾周脂肪重(g)+附睾脂肪重(g)]/体重(g)×100%}、血脂。结果发现,高脂饲料组大鼠体重(390.22±37.53 g)和Lee’s指数(304.26±8.47)较普通饲料组大鼠体重(363.11±33.09 g)和Lee’s指数(296.32±3.63)分别升高7.5%(>0.05)和2.7%(<0.05)。高脂饲料组大鼠脂肪重(14.82±5.50 g)和脂体比(3.73±0.9 8)较普通饲料组大鼠脂肪重(10.04±2.40 g)和脂体比(2.78±0.67)分别升高47.6%(<0.05)和34.2%(<0.05)。高脂饲料组大鼠血清TC(1.86±0.24 mmol/L)、LDL-C(0.43±0.10 mmol/L)较普通饲料组大鼠血清TC(1.29±0.22 mmol/L)、LDL-C(0.26±0.04 mmol/L)含量分别升高43.7%(<0.01)和66.1%(<0.01)。虽然高脂饲料组大鼠体重较普通饲料组没有显著升高,但是Lee’s指数、脂肪重、脂体比以及TC、LDL-C明显升高,表明高脂饲料饲养12周导致大鼠肥胖。
1.2 研究方法
剩余48只肥胖大鼠采用水平动物跑台进行2周适应性训练,2周内速度从16 m/min逐渐递增到25 m/min,时间从20 min/天逐渐递增到60 min/天。根据大鼠体重和适应性训练情况,选取体重、运动能力等基本一致的40只肥胖大鼠进入正式实验。随机分为4组,每组10只:常氧安静组(常氧环境生活24 h/天,不训练)、常氧训练组(常氧环境生活训练)、低氧安静组(13.6%氧浓度环境生活24h/天,不训练)、低氧训练组(13.6%氧浓度环境生活训练)。常氧训练组训练强度为25 m/min,低氧训练组训练强度为20 m/min(低氧浓度13.6%,相当于3 500 m海拔高度),持续运动1 h/天、6天/周、共4周。
常氧训练组、低氧训练组大鼠最后一次训练后休息24 h,与常氧安静组、低氧安静组一起取材。取材前大鼠禁食禁水12 h,称重,按0.3 ml/100 g体重剂量腹腔注射10%水合三氯乙醛溶液麻醉大鼠,测量体长(鼻尖至肛门的长度),计算Lee’s指数[Lee’s指数=体重(g)1/3×1 000/体长(cm)]。腹主动脉取血分离血清Elisa法测试骨代谢标志物。迅速取双侧肾周和附睾脂肪,在预冷的生理盐水中漂洗去血,滤纸吸干水分,称重,计算脂体比[脂体比=(肾周脂肪重(g)+附睾脂肪重(g))/体重(g)×100%]。分离大鼠左侧股骨和胫骨,称重,计算骨体比[骨体比=(股骨重(g)+胫骨重(g))/体重(g)×100%]。双能X线骨密度仪[HOLOGIC型号Discovery A(S/N86171)]进行骨质密度指标测试。用扇形束分别测试股骨和胫骨两端和中点的骨矿密度(bone mineraI densitometr,BMD g/cm2)和骨矿含量(bone mineral content,BMC g),取3点测试结果的平均值作为股骨和胫骨的骨质密度。骨形成标志物:血清骨钙素(osteocalcin,OC)、血清骨碱性磷酸酶(bone alkaline phosphatase,BALP)、血清I型原胶原C端前肽(procollagen type I C propeptide,PICP)、血清I型原胶原N端前肽(procollagen type I N propeptide,PINP)。骨吸收标志物:血清I型胶原交联C-末端肽(C-terminal crosslinking telopeptide of type I collagen,CTX)、血清I型胶原交联N-末端肽(N-terminal crosslinking telopeptide of type I collagen,NTX)、血清抗酒石酸酸性磷酸酶(tartrate resistant acid phosphatase,TRACP)。
实验结果用平均值±标准差(±)表示,利用单因素方差分析进行数据统计,<0.05为显著性差异,<0.01为高度显著性差异。
2 结果
与常氧安静组比较,常氧训练组、低氧安静组和低氧训练组大鼠的体重、Lee’s指数及脂体比均有不同程度降低,体重分别降低11.8%(<0.01)、8.2%(<0.05)和12.7%(<0.01);Lee’s指数分别降低1.6%(>0.05),3.6%(<0.01)、3.9%(<0.01);脂体比分别降低17%(<0.05)、9.4%(>0.05)、31.3%(<0.01)。低氧训练组大鼠较常氧训练组大鼠体重、Lee’s指数以及脂体比分别下降了1.0%(>0.05)、2.3%(<0.05)、17.2%(>0.05)。与低氧安静组比较,低氧训练组大鼠体重降低4.9%(>0.05)、Lee’s指数基本没有变化(>0.05),脂体比降低24.1%,具有高度显著性差异(<0.01)。
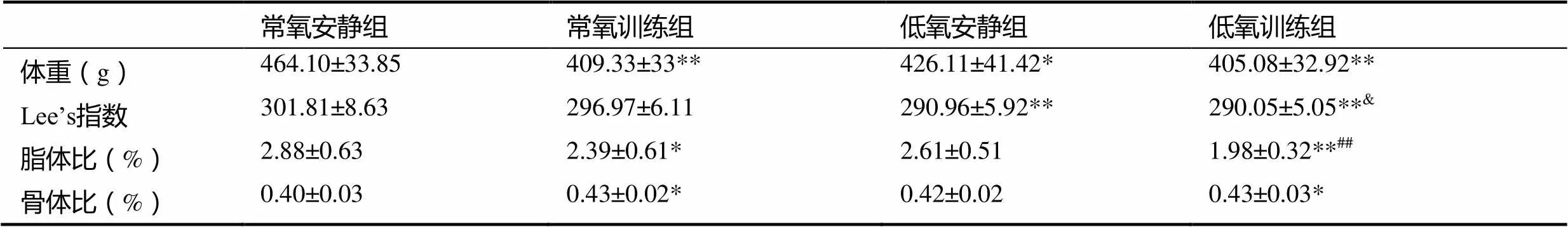
表1 肥胖大鼠体重及体成分变化
注:*表示与常氧安静组相比<0.05,**表示与常氧安静组相比<0.01;##表示与低氧安静组相比<0.01;&表示常氧训练组相比<0.05;下同。
与常氧安静组比较,常氧训练组、低氧安静组和低氧训练组肥胖大鼠的骨体比均升高,常氧训练组升高7.0%,低氧安静组升高3.7%,两者均无显著性差异(>0.05),低氧训练组显著性升高7.4%(<0.05)。低氧训练组骨体比与常氧训练组较为接近(升高0.4%,>0.05),与低氧安静组比较,低氧训练组骨体比提高了3.6%(>0.05)。

表2 肥胖大鼠骨密度的变化
胫骨、股骨的骨含量和骨密度,4组之间没有明显变化,大致表现为常氧训练组稍高于常氧安静组,低氧训练组稍高于低氧安静组,低氧安静组稍低于常氧安静组,低氧训练组和常氧训练基本相当,各组之间均无显著性差异(>0.05)。
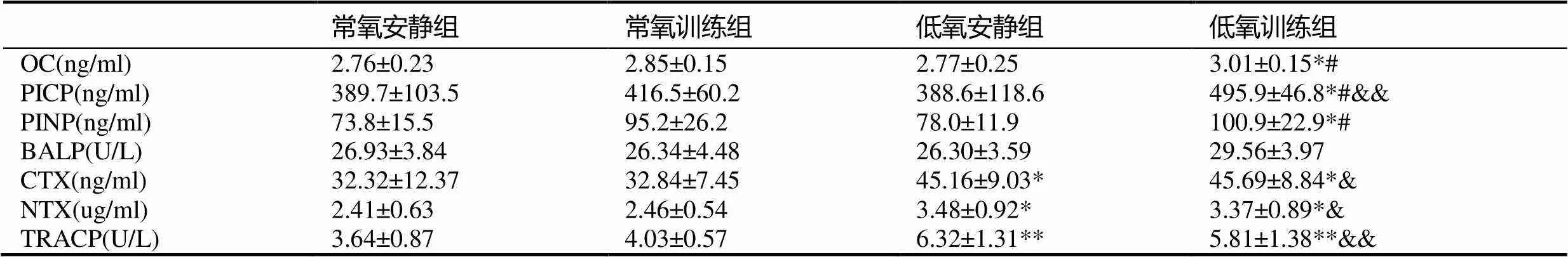
表3 肥胖大鼠骨代谢标志物的变化
注:#表示与低氧安静组相比<0.05;&&表示与常氧训练组相比<0.01;下同。
与常氧安静组比较,常氧训练组和低氧安静组肥胖大鼠血清骨形成标志物OC、PICP、PINP、BALP均无显著性变化(>0.05);低氧训练组肥胖大鼠血清骨形成标志物OC、PICP、PINP较常氧安静组和低氧安静组均显著升高(<0.05),其中,PICP显著高于常氧训练组(<0.01),低氧训练组BALP与各组比较均无显著性差异(>0.05)。
与常氧安静组比较,常氧训练组肥胖大鼠血清骨吸收标志物CTX、NTX和TRAP均无明显变化(>0.05),低氧安静组和低氧训练组肥胖大鼠血清CTX、NTX和TRAP均显著升高(<0.05,<0.05,<0.01),且低氧训练组较常氧训练组肥胖大鼠血清CTX、NTX和TRACP也出现显著升高(<0.05,<0.05,<0.01)。
3 分析与讨论
3.1 运动对骨代谢的影响
研究表明,青春早期体力活动量与BMC呈正相关[16],运动能增加青年峰值骨量。持续12周每周3次中等强度有氧运动能够提高30~60岁受试者骨密度,增强骨形成标志物骨钙素和骨碱性磷酸酶,降低骨吸收标志物,促进骨形成,减少骨吸收,防止骨质流失,达到预防骨质疏松的效果[25]。运动还能够有效缓解老年人减重带来的骨量丢失[34],有氧结合抗阻运动甚至可以在减重的同时增加BMD、BMC[26,30]。运动方式、运动负荷、运动时间等是影响骨量和骨密度变化的重要因素。骨量和骨强度主要取决作用于骨的负荷,该负荷不仅指体重,还包括骨骼肌作用于骨的力及其效应,而骨骼肌作用于骨的负荷可能存在一个阈值,超过这一阈值骨重构或者成骨相关基因的表达才会被启动,继而成骨作用加强[27]。中等强度到较大强度运动负荷可以显著增加骨形成,减少骨吸收,促进骨密度的提高,改善骨质疏松风险人群的骨质状况。用最大心率百分比或最大力量百分比量化运动强度来提升骨强度,骨强度的增加与运动强度的增加成正比[17]。不同的运动在一定程度上都具有成骨效应,但不同运动形式产生的效果不尽相同。相对而言,抗阻力练习和冲击力项目增加机体骨密度的效果更好[18]。关于运动引起骨密度增加需要的时间,基本可以概括为两种情况:1)对于骨质疏松防治的人群,骨密度升高改善通常需要12周及以上的时间[24];2)对于正处于成骨活跃的青少年而言,活动时间充足,活动方式多样,短时间(4周)的训练同样可以引起骨密度的变化[3]。动物实验表明,9周的常氧运动特别是中负荷运动(26.8 m/min,60%~70%最大吸氧量,30 min/次,5天/周)可促进生长期大鼠成骨细胞的骨形成、抑制破骨细胞的骨吸收,对生长期大鼠骨量增长有益[21]。本研究结果显示,常氧训练组在降低体重、Lee’s指数及脂体比的同时,骨体比有所升高,但无显著性差异;胫骨、股骨的骨含量和骨密度稍高于常氧安静组,但没有明显变化,说明有氧运动减重的同时并没有降低肥胖大鼠的骨密度。至于肥胖大鼠的骨密度也没有升高,很可能是因为4周的运动时间较短,血清骨形成标志物和骨吸收标志物均无显著变化,尚不足以引起骨密度的增加。
3.2 低氧对骨代谢的影响
3.2.1 低氧对骨密度的影响
本研究显示,低氧安静组肥胖大鼠的体重、Lee’s指数及脂体比降低的同时,骨体比有所升高,但无显著性差异。胫骨、股骨的骨含量和骨密度稍低于常氧安静组,无显著性差异。虽然有研究表明,低氧环境可引起骨代谢异常,并加速骨质疏松发展的进程,但本研究表明,低氧(13.6%O2)4周并未对骨密度产生明显影响。乔林等[14]观察低氧4周大鼠腰椎骨密度值变化不明显,12周有所下降但无显著性差异,低氧24周大鼠腰椎骨密度显著降低。高文魁等[4]发现了与乔林等同样的结果,但对于去势大鼠的研究却有不同之处,12周时,两者都发现高原和平原去势大鼠骨密度均显著下降,且高文魁等[4]的研究显示,高原去势大鼠骨密度明显低于平原去势大鼠,而乔林等[14]的研究显示两组之间无显著性差异。由此可见,本研究低氧未对骨密度产生显著影响的原因可能是低氧时间不够长。相同的受试者,相同的低氧时间出现不同的结果,推测原因与低氧浓度有关,进一步查阅文献发现,高文魁等[4]的研究选用的是3 000 m低氧环境,而乔林等[14]的研究报道中没有提及低氧浓度,究竟是不是由于低氧浓度导致的研究结果出现差别,有待更多研究的验证。
人体研究也表明,海拔高度(低氧程度)、高原环境生活(低氧暴露)时间的长短、受试者性别、年龄等因素,都会对骨密度的变化产生不同的影响。傅晨等[2]报道,生活在海拔2 800 m的高原男性居民骨密度值显著降低,而生活在海拔1 500 m的高原居民骨密度值无明显降低。同时还发现,生活在海拔2 800 m的高原居民中年龄<29岁及在高原生活时间<5年者,骨密度值降低尤为显著。而高原生活时间超过11年以上的居民,骨密度与对照组之间的差异随之消失。还有研究表明,26~36岁高原防守官兵海拔高度5 000 m防守12个月骨密度T值和Z值显著高于平原(<0.05),防守6个月时尚无显著性差异,海拔高度4 000 m组骨密度T值和Z值则无显著性差异,认为原因可能是海拔越高,紫外线照射时间较长,骨质含量相应增高[19]。高原居民老年后受高原缺氧影响明显,与平原地区相比较,骨量丢失显著,导致骨质疏松的发病危险性增加。也有研究表明[18],在高原地区(海拔4 200 m)和中度海拔地区(海拔 2 260 m)移居20年,经DEXA确诊为骨质疏松的绝经期汉族妇女,其腰椎、大转子及股骨颈BMD,与平原地区绝经期汉族妇女无显著性差异。
3.2.2 低氧对骨生成的影响
本研究结果显示,低氧安静组肥胖大鼠血清骨形成标志物OC、PICP、PINP、BALP均无显著变化。低氧条件下培养的初生大鼠颅盖骨成骨细胞增殖、碱性磷酸酶活性、骨钙素水平及茜素红结节形成数量均明显低于常氧组,说明缺氧条件抑制成骨细胞的增殖分化,降低成骨功能[5,6]。在体外2%氧浓度下培养小鼠成骨细胞24 h,成骨细胞的增殖率增加,分泌碱性磷酸酶的能力增强,成骨细胞表达RunX2和骨钙素的水平增加,形成矿化结节的数量也增加,表明体外短时间的低氧条件能促进成骨细胞的增殖分化和矿化[11]。但是,极低氧浓度也会影响成骨细胞骨结节的形成。1%氧浓度中培养成熟的成骨细胞24 h后再恢复到正常氧浓度,骨结节形成不受影响,而暴露于无氧环境再恢复到正常氧浓度后,成骨细胞骨结节的形成则会受到抑制[31]。对成骨细胞分化的影响,不仅与低氧浓度有关,还与低氧时间有关。短时间低氧可以促进成骨细胞分化,而长时间缺氧则会抑制成骨细胞分化和成熟[32]。氧浓度越低,低氧时间越长,越会抑制成骨。本研究属于在体实验,氧浓度(13.6%O2)明显高于细胞培养的氧浓度(1%~2%O2),相对于常氧安静组,低氧安静组肥胖大鼠血清骨形成标志物OC、PICP、PINP、BALP均无显著变化(>0.05),表明4周低氧(13.6%O2)尚未影响骨形成标志物的变化。
3.2.3 低氧对骨吸收的影响
本研究表明,低氧安静组肥胖大鼠血清CTX、NTX和TRAP较常氧安静组显著升高,表明13.6%O2低氧4周促进骨吸收。8周龄C57BL/6雄性小鼠低氧(8%~11%O2每日8 h,每周6天,连续8周)可以增强骨再吸收作用和破骨细胞的活性,主要表现为血清中TRACP-5b水平高[31],与本实验的结果一致。体外细胞培养也得到了相似的结果。研究表明,低氧可以刺激破骨细胞生成[29]。体外培养小鼠长骨单核前体细胞,2%氧浓度时破骨细胞数目增加4倍[28]。低氧暴露不仅影响破骨细胞的生成,还可以增加破骨细胞的吸收能力,2%氧浓度暴露24 h,骨吸收能力增加2~4倍[28]。Utting等[33]通过体外培养外周血单核细胞发现,低氧时骨吸收能力为常氧时的10倍。氧浓度及缺氧时间对小鼠破骨细胞生成和骨吸收功能发生显著影响,氧浓度逐渐降低,前破骨细胞向破骨细胞分化逐渐增多,与常氧环境相比,破骨细胞体积增大,核数增多,破骨细胞骨吸收功能逐渐增强,以3%氧浓度增强最明显。尤其在3%氧浓度时,破骨细胞骨吸收功能达到高峰,以后随着氧浓度降低骨吸收功能相对减弱。随着缺氧时间延长,破骨细胞生成逐渐增多,以缺氧第5天增加最明显,以后随着缺氧时间延长破骨细胞生成相对减弱[10]。
3.3 低氧训练对骨代谢的影响
本研究显示,低氧训练大鼠的体重、Lee’s指数及脂体比均有不同程度降低,Lee’s指数较常氧训练组大鼠下降,脂体比较低氧安静组显著降低。低氧训练肥胖大鼠的骨体比显著性升高。胫骨、股骨的骨含量和骨密度,低氧训练组稍高于低氧安静组,和常氧训练基本相当,各组之间均无显著性差异。低氧训练组肥胖大鼠血清骨形成标志物OC、PICP、PINP较常氧安静组和低氧安静组均显著升高(<0.05),其中,PICP显著高于常氧训练组;低氧训练组肥胖大鼠血清CTX、NTX和TRAP显著升高且高于常氧训练组。由此可见,低氧训练减脂的同时,还升高了骨体比,但骨密度没有明显变化,可能是因为低氧训练既促进了骨生成又增加了骨吸收,两者处于动态平衡。目前,低氧训练对骨代谢影响的研究较少。一项高住低练的研究显示,低氧(14.7%O2)结合运动的高住低练降低大鼠骨生成标志物,升高大鼠骨吸收标志物,但是,对照组不管是单纯低氧还是常氧运动都促进成骨细胞的骨形成、抑制破骨细胞的骨吸收[21]。以肥胖青少年为研究对象的一项研究显示,为期4周,每周6天的平原训练、低氧训练(模拟海拔2 300 m低氧10 h/天,有氧运动2 h/天)、高原训练(青海多巴居住运动),运动形式多样,中低强度有氧运动减脂,结果常氧组、低氧组和高原组全身总BMD均显著升高,各组之间无显著性差异[3]。肥胖青少年不管是低氧训练还是高原训练4周减脂后,骨密度升高,可能和研究对象是青少年,本身处在成骨活跃时期,再加上活动时间充裕,活动形式多样,除了快走、慢跑等有氧项目,还有跳绳、羽毛球、健美操等有益于骨健康的项目,所以减重的同时出现全身BMD、BMC不同程度增加。低氧训练对骨代谢影响报道较少,其规律还有待进一步探讨。
4 结论
4周低氧训练降低肥胖大鼠体重、脂体比,增加骨体比。4周低氧训练同时促进肥胖大鼠骨形成和骨吸收,骨代谢处于动态平衡,尚未对股骨和胫骨骨密度产生明显影响。
[1] 冯连世,张漓,高炳宏,等.不同环境下有氧运动对超重和肥胖青少年体重与体脂含量的影响[J].体育科学,2013,33(11):58-65.
[2] 傅晨,刘兴炎,葛宝丰,等.西北高原地区居民骨密度研究[J].中国骨伤,2002,15(4):198-201.
[3] 高欢.低氧及高原耐力训练对超重和肥胖青少年身体成分、静息代谢和运动能力的影响[D].上海:上海体育学院,2013.
[4] 高文魁,白峰,王伟,等.高原低氧环境下骨质疏松大鼠模型的骨代谢生化指标观察[J].中华骨质疏松杂志,2011,17(11):941-944.
[5] 高文魁,王德元,李智钢,等.低氧条件下成骨细胞的增殖与分化[J].中国组织工程研究与临床康复,2011,15(46):8591-8594.
[6] 顾九君,盛俊东,梁伟东.缺氧大鼠成骨细胞增殖、分化及基因表达[J].中国组织工程研究,2012,16(42):7819-7824.
[7] 黄际远,宋文忠,陈明曦,等.年龄、身高、体重、体重指数、体表面积对成都地区中老年人腰椎骨密度的影响[J].中国老年学杂志,2007,27(8):768-770.
[8] 黄邀,傅君芬,李筠,等.肥胖男童骨密度变化与骨代谢指标及胰岛素抵抗的关系探讨[J].临床儿科杂志,2009,27(2):152-155.
[9] 荆文.低氧训练对高脂饮食大鼠肝脏microRNA表达及脂代谢的调节研究[D].上海:上海体育学院,2014.
[10] 郎红梅.离体条件下低氧环境对破骨细胞生成及功能影响的实验研究[D].重庆:第三军医大学,2007.
[11] 刘晓东.成骨细胞的低氧感应机制及其在代谢性骨病中的调控作用[D] .上海:上海交通大学,2007.
[12] 路瑛丽,谢敏豪,冯连世,等.高住高练对肥胖大鼠腓肠肌脂肪酸氧化的影响[J].中国运动医学杂志,2014,33(11):1060-1068.
[13] 吕明丽,余飞,陆思琦,等.肥胖青年骨密度状况分析[J].同济大学学报(医学版),2012,33(4):90-93.
[14] 乔林,白峰,赵轶男,等.低氧环境下去势大鼠骨质疏松模型的骨吸收标志物观察[J].科学技术与工程,2014,14(7):126-128,135.
[15] 汤参娥,雷闽湘,吴静,等.中青年女性肥胖与骨密度的关系[J].湖南医科大学学报,2003,28(3):313-314.
[16] 王玲,陈裕明,肖新才,等.青春早期女童体力活动与骨量关系的研究[J] .中华预防医学杂志,2007,41(5):396-398.
[17] 王正珍.ACSM运动测试与运动处方指南[M].北京:北京体育大学出版社,2018:304.
[18] 魏春梅,罗银花,曹敏英,等.高海拔地区与平原地区围绝经妇女骨密度的对比观察[J].高原医学杂志,2009,19(3):22-24.
[19] 岳增文,徐莉,史润泽,等.驻高原官兵骨密度检测分析研究[J].中国疗养医学, 2014,23(10): 865-866.
[20] 张亨菊,管晓丽,李耀.济南市7~13岁儿童骨矿物质含量及其影响因素分析[J].预防医学文献信息,2000,6(1):9-10.
[21] 张红品,王维群,张林,等.平原条件下训练与低氧舱睡眠对生长期大鼠骨形成及骨吸收相关因子的影响[J].中国临床康复, 2006, 10(13):73-75.
[22] 周丽斌,陈名道.减重和运动干预对肥胖老年人骨代谢和骨量的影响:一项为期一年的随机对照试验[J].中华内分泌代谢杂志,2008,24(4):447-449.
[23] 朱再胜,戴爽,郑靖宇,等.番茄红素对慢性低氧小鼠骨密度和RANKL/OPG的影响[J].温州医科大学学报,2015,45(3):185-189.
[24] 邹军,章岚,任弘,等.运动防治骨质疏松专家共识[J].中国运动医学杂志,2015,21(11):1291-1302,1306.
[25] ALGHADIR A H, ALY F A, GABR S A.Effect of moderate aerobic training on bone metabolism indices among adult humans[J]. Pak J Med Sci,2014,30 (4):840-844.
[26] CAMPOS R M,DE MELLO M T, TOCK L,. Aerobic plus resistance training improves bone metabolism and inflammation in adolescents who are obese[J]. J Strength Cond Res,2014, 28(3): 758-766.
[27] FROSTT H M. On our age-related bone loss: Insights from a new paradigm[J]. J Bone Miner Res, 1997, 12(10): 1539-1546.
[28] KNOWLES H J. Hypoxic regulation of osteoclast differentiation and bone resorption activity[J]. Hypoxia,2015,3: 73-82.
[29] KNOWLES H J, THANASAU N A.Hypoxia-inducible factor is expressed in giant cell tumour of bone and mediates paracrine effects of hypoxia on monocyte-osteoclast differentiation viainduction of VEGF[J].J Pathol, 2008,215(1):56-66.
[30] LIM J S, JANG G C, MOON K R,. Combined aerobic and resistance exercise is effective for achieving weight loss and reducing cardiovascular risk factors without deteriorating bone health in obese young adults[J]. Ann Pediatr Endocrinol Metab,2013, 18(1): 26-31.
[31] SALIM A,NACAMULI R P,MORGAN E F,.Transient changes in oxygen tension inhibit osteogenic differentiation and runx2 expression in osteoblasts[J]. J Biol Chem,2004, 279(38): 40007-40016.
[32] UTTING J C,ROBINS S P,BRANDAO BURCH A,.Hypoxia inhibits the growth,differentiation and bone forming capacity of rat esteoblasts[J].Exp Cell Res,2006,312(10):1693-1702.
[33] UTTING J C,FLANAGAN A M,BRANDAO-BURCH A,.Hypoxia stimulates osteoclast formation from human peripheral blood[J].Cell Biochem Funct, 2010,28(5):374-380.
[34] VILLAREAL D T, CHODE S, PARIMI N,. Weightloss, exercise, or both and physical function in obese older adults[J]. N Engl J Med, 2011, 364(13): 1218-1229.
[35] YU C C,SUNG R Y,SO R C,.Effects of strength training on body composition and bone mineral content in children who are obese[J].J Strength Cond Res,2005,19(3):667-672.
Effects of Hypoxic Training on Bone Metabolism in Obese Rats
LU Ying-li1, JING Wen2, FENG Lian-shi1, ZHANG Li1, XU Jian-fang1
1. China Institute of Sport Sciense, Beijing 100061, China; 2. Shandong Normal University, Jinan 250014, China.
Objective: To investigate the effects of hypoxic training on bone metabolism in obese rats. Methods: Forty Sprague-Dawley obese rats were assigned into one of the following groups (n=10 each): normoxic living group, hypoxic living group, normoxic training group, hypoxic training group. Rats were kept continuous exercise 1 hour per day, 6 days per week for 4 weeks on a rat treadmill at a speed of 25 m/min in normoxic conditions or 20 m/min in hypoxic conditions (13.6% O2). After 4 weeks, bone formation markers (OC, BALP, PICP, PINP) and bone resorption markers (CTX, NTX, TRACP) in serum were tested using Elisa. BMC and BMD were measured by dual x-ray absorptiometry. Results: Conpared to normoxic living, hypoxic training for 4 weeks resulted in lower body weight Lee’s. fat/body weight ratio (<0.01) and higher bone/body weight ratio. There were no significant differences in BMC and BMD between the groups. Compared to normoxic living and hypoxic living, hypoxic training for 4 weeks resulted in higher OC, PICP, PINP in serum(<0.05), and PICP in hypoxic training group were higher than that in normoxic training group. Compared to normoxic living and normoxic training, hypoxic training for 4 weeks resulted in higher CTX, NTX and TRAP in serum(<0.05,<0.05,<0.01). Conclusion: Hypoxic training for 4 weeks decreased body weight. Fat/body weight ratio and improved bone/body weight radio. Hypoxic training for 4 weeks resulted in promoting bone formation and resorption, with no effect on BMD.
1002-9826(2018)05-0088-06
10.16470/j.csst.201805013
G804.7
A
国家体育总局体育科学研究所基本科研业务费资助项目(基本14-11)
路瑛丽,女,副研究员,博士,主要研究方向为低氧训练的理论与方法, Email:luyingli@ciss.cn。
冯连世,男,研究员,主要研究方向为低氧训练的理论与方法、体育健康促进,Email: fengls98@126. com。

