纤维素酶辅助水蒸气蒸馏提取柠檬果皮精油工艺优化
辜雪冬肖 娟周 康胡 滨苏 赵
(1. 西藏农牧学院食品科学学院, 西藏 林芝 860000;2. 四川农业大学食品学院,四川 雅安 625014)
精油又称挥发油,是一类具有芳香味油状液体的总称。精油在植物界分布很广,主要存在于芸香科、菊科等芳香植物中[1]。柠檬又称柠果、益母果等,属于芸香科柑橘属植物,果实为淡黄色柑橘类水果,原产于马来西亚、印度、北非等国家,目前在全世界广泛种植。近年来,中国柠檬种植面积不断增加,产量逐渐增加,尤其四川安岳作为中国最大的柠檬主产区,2015年安岳柠檬总产量已达到6.0×105t[2]。柠檬除直接作为鲜果销售外,还可以加工成柠檬产品,如柠檬果酒、柠檬果醋、柠檬果汁饮料等。由此在柠檬加工过程中产生了大量皮渣等副产物,尤其柠檬皮中含有丰富的精油[3]。柠檬精油具有广泛的生物活性,在食品、化工和医学领域有大量应用[4]。
目前,柠檬精油提取的方法有压榨法、有机溶剂提取法、水蒸气蒸馏法、超临界流体萃取法等[5-6]。但是直接压榨法提取率通常较低;有机溶剂提取法在去除溶剂时容易导致挥发性成分的散失;超临界流体萃取法耗时虽短,但仪器设备成本较高,在生产实践中应用还有一定局限性;水蒸气蒸馏法是《中国药典》的推荐方法,但耗时较长。因此,探索操作简单、提取率高、成本低廉的柠檬精油提取方法,依然是柠檬产品综合利用的关键,而采用酶法辅助水蒸气蒸馏提取柠檬精油的工艺还未见报道。该方法是根据植物原料细胞壁的构成特点,利用酶反应的高度专一性,选择相应的酶在水蒸气蒸馏提取前将细胞壁的组分进行降解,使被束缚在细胞内的有效成分溶出,从而达到快速提取的目的[7]。
本试验拟以四川安岳的尤力克柠檬果皮为原料,通过单因素和响应面试验研究纤维素酶辅助水蒸气蒸馏提取柠檬精油的最佳工艺条件,并采用气相色谱-质谱法(GC-MS)对其化学成分进行分析,再利用扫描电镜对柠檬果皮的微观结构变化进行观察,为柠檬精油的综合开发利用提供参考。
1 材料与方法
1.1 试验材料
新鲜柠檬:尤力克,采集于四川省安岳县农贸市场,取果皮,切片,真空干燥至质量恒定,备用;
纤维素酶:酶活≥40 000 U/mg,最适酶解温度40~60 ℃,pH 4.0~5.5,上海如吉生物科技发展有限公司;
果胶酶:酶活≥30 000 U/mg,最适酶解温度30~55 ℃,pH 3.5~5.5,上海如吉生物科技发展有限公司;
半纤维素酶:酶活≥10 000 U/mg,最适酶解温度30~55 ℃,pH 4.0~5.5,上海如吉生物科技发展有限公司;
氢氧化钠、盐酸等:分析纯,成都科龙化工试剂厂。
1.2 主要仪器与设备
挥发油测定器:上海臻浔金属制品有限公司;
电子天平:20002型,诸暨市超泽衡器设备有限公司;
真空干燥箱:DZF-6020型,上海齐欣科学仪器有限公司;
pH计:PHS-25型:天津市华仪盛达实验仪器有限公司;
水浴恒温振荡器:DSHZ-300型,太仓市科学仪器有限公司;
电热套:PTHW型,上海贝仑仪器设备有限公司;
气相色谱—质谱联用仪:7890A-5975C型,安捷伦科技有限公司;
扫描电子显微镜:JSM-7500F型,日本电子株式会社。
1.3 试验方法
1.3.1 水蒸气蒸馏提取 根据《中国药典》I部(2010年)附录XD中测定法进行提取。取50 g经真空干燥后的柠檬果皮置于圆底烧瓶中,加一定体积水与数粒玻璃珠,振摇混合后,连接挥发油测定器和回流冷凝管,从冷凝管上端加水至挥发油测定器的刻度部分,并溢流入烧瓶为止。再将提取装置于电热套中加热至微沸,并保持微沸5 h,至挥发油测定器中油量不再增加时,停止加热,放置片刻,开启挥发油测定器下端活塞,将水缓慢放出,使油层下降到其上端与0刻度线齐平,读取出油量,按式(1)计算精油提取率;其中柠檬精油相对密度测定按GB/T 11540—2008《香料 相对密度的测定》进行。按式(1)计算提取率。
(1)
式中:
c——提取率,%;
m1——精油体积,mL;
ρ——精油密度,g/mL;
m2——柠檬皮质量,g。
1.3.2 酶辅助水蒸气蒸馏提取 称取一定质量经真空干燥后的柠檬果皮置于圆底烧瓶中,加入一定体积蒸馏水,再加入一定量的酶,盖塞,调节pH和温度,在水浴恒温振荡器中进行酶解;酶解处理完成后,再连接挥发油测定器和冷凝管,采用电热套加热至微沸,进行水蒸气蒸馏提取。精油提取率按式(1)计算。
1.3.3 单因素试验
(1) 酶的种类:为了确定最优的水解酶,参考厂家提供纤维素酶、果胶酶和半纤维素酶的最适酶解条件,分别研究其对提取率的影响。具体酶解条件分别为:纤维素酶添加量1%(以柠檬果皮质量计),pH 5.0,温度45 ℃,液料比13∶1 (mL/g),酶解时间60 min,蒸馏时间180 min;果胶酶添加量1%,pH 4.0,温度50 ℃,液料比13∶1 (mL/g),酶解时间60 min,蒸馏时间180 min;半纤维素添加量1%,pH 4.5,温度40 ℃,液料比13∶1 (mL/g),酶解时间60 min,蒸馏时间180 min。
(2) 纤维素酶的添加量:将试验条件设置为pH 5.0,温度45 ℃,液料比13∶1 (mL/g),酶解时间60 min,蒸馏时间180 min,以确定适宜酶添加量。
(3) 酶解温度:将试验条件设置为酶添加量1.2%,pH 5.0,液料比13∶1 (mL/g),酶解时间60 min,蒸馏时间180 min,以确定适宜的酶解温度。
(4) pH值:将试验条件设置为酶添加量1.2%,温度50 ℃,液料比13∶1 (mL/g),酶解时间60 min,蒸馏时间180 min,以确定适宜的pH值。
(5) 液料比:将试验条件设置为酶添加量1.2%,温度50 ℃,pH 5.0,酶解时间60 min,蒸馏时间180 min,以确定适宜的液料比。
(6) 酶解时间:将试验条件设置为酶添加量1.2%,温度50 ℃,pH 5.0,液料比为16∶1 (mL/g),蒸馏时间180 min,以确定适宜的酶解时间。
(7) 蒸馏时间:将试验条件设置为酶添加量1.2%,温度50 ℃,pH 5.0,液料比为16∶1 (mL/g),酶解时间70 min,以确定适宜的蒸馏时间。
1.3.4 响应面试验 在单因素试验基础上,选择对提取率影响较大的酶添加量、液料比、酶解时间和蒸馏时间4个因素为自变量,以提取率为响应值,按照响应面(Response surface methodology,RSM)试验中的Box-Behnken Design(BBD)原理设计试验。根据试验结果进行优化分析,以得到最优提取工艺条件。
1.4 柠檬精油的化学成分检测
采用GC-MS法对柠檬精油的化学成分进行分析。其中GC条件:HP-5MS弹性石英毛细管柱(柱长:30 m,膜厚:0.25 μm,内径:0.25 mm);载气为氦气,流速为1 mL/min。进样量0.5 μL,进样口温度250 ℃,不分流进样,解析时间5 min;升温程序:起始温度50 ℃,3 ℃/min升温至220 ℃,保持2 min[8-9]。
MS条件:电子轰击离子源(EI),电子能量70 eV,GC与MS接口温度280 ℃;离子源温度230 ℃;电子检测器检测电压350 V;质量扫描范围10~450 amu。
1.5 扫描电镜观察
将未经处理、水蒸气蒸馏提取和酶辅助水蒸气蒸馏提取后的柠檬果皮作为原材料,经冷冻干燥后再作喷金处理,在放大倍数500倍,工作距离8 mm,分辨率>20 nm条件下,利用扫描电镜观察其表面微观结构的变化。
2 结果与分析
2.1 单因素试验
2.1.1 酶的种类对提取率的影响 由图1可知,在酶添加量相同的情况下,纤维素酶的提取率最高。这主要是由于植物细胞壁是以纤维素为骨架结构,当纤维素被水解后,细胞中的精油成分能够快速游离出来,增加提取率。孟利娜等[10]在研究酶法辅助提取北苍术挥发油的工艺时,比较了纤维素酶、果胶酶和半纤维素酶对挥发油提取率的影响,结果表明纤维素酶的提取率明显高于果胶酶和半纤维素酶。因此本试验选用纤维素酶辅助提取柠檬精油。
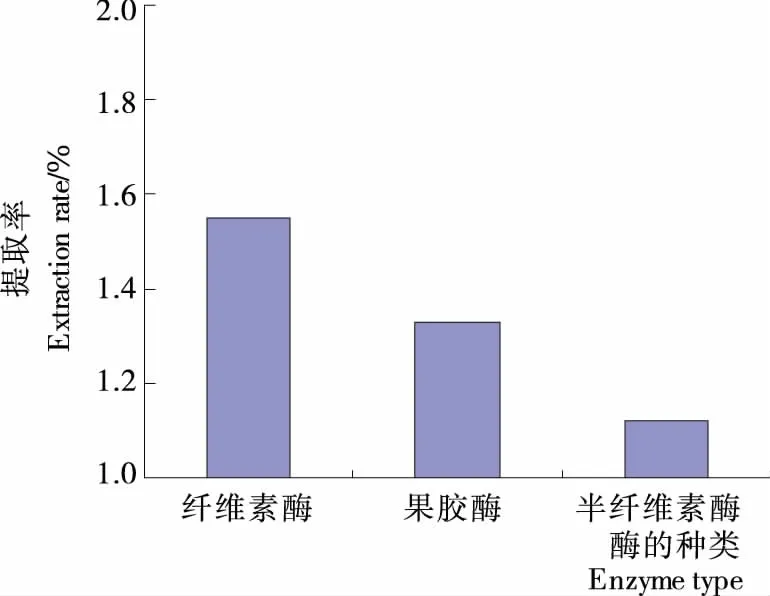
图1 酶的种类对提取率的影响Figure 1 Effect of enzyme type on extraction rate
2.1.2 酶添加量对提取率的影响 由图2可知,酶添加量由0.3%增加至1.2%时,提取率明显增加;当酶添加量超过1.2% 后,提取率增幅不显著。这是由于随着纤维素酶量的增加,细胞壁被充分降解,精油提取率快速增加;但当纤维素酶增加到一定浓度后,与底物的结合已经饱和,继续增加酶量,已没有多余的底物与其结合,提取率不再增加。张辰露等[11]在采用纤维素酶提取紫苏叶挥发油时也证实,随着纤维素酶用量增加,提取率先增加,然后增幅不明显。因此,综合考虑生产成本和提取率等因素,本试验适宜的纤维素酶添加量为1.2%。
2.1.3 酶解温度对提取率的影响 由图3可知,当酶解温度从40 ℃上升到50 ℃时,提取率明显增加;在50~55 ℃时,提取率增幅不明显;超过55 ℃后,提取率降低。这是由于在酶促反应过程中,温度增加能够促进反应进行。但温度过高会导致纤维素酶失活,从而降低酶促反应速度。而在50~55 ℃时,提取率较高,这是由于酶都有最适的温度范围,当纤维素酶保持在此温度范围时,温度对其活性没有影响。吕晓玲等[12]在采用纤维素酶提取迷迭香挥发油时也发现,温度过高或过低提取率都相应下降,可能是低温抑制酶的活性,而高温导致酶失活。因此,本试验适宜酶解温度为50~55 ℃。
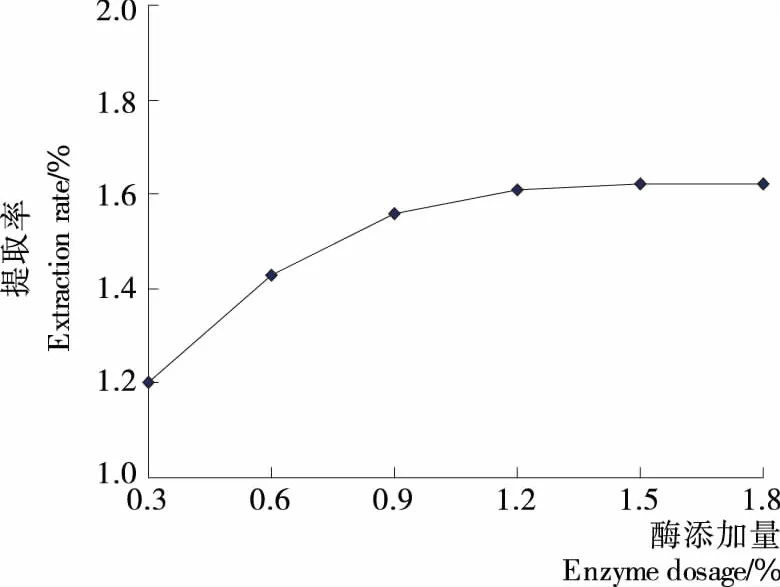
图2 酶添加量对提取率的影响Figure 2 Effect of enzyme dosage on extraction rate
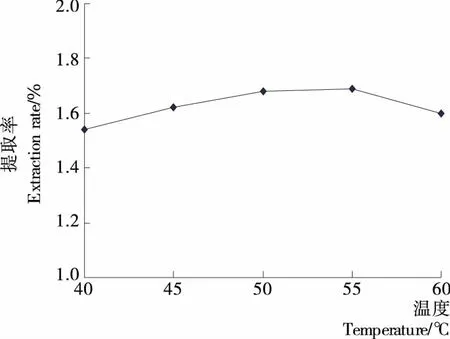
图3 酶解温度对提取率的影响Figure 3 Effect of enzyme temperature on extraction rate
2.1.4 pH对提取率的影响 由图4可知,当pH从3.5上升到5.0时,提取率明显增加;pH在5.0~5.5时,提取率增幅不显著;当pH超过5.5后,提取率降低。通常酶都有其适宜的pH范围,pH值过高或过低都影响酶的活性,导致酶促反应速率降低。这与回瑞华等[13]在采用纤维素酶辅助提取卷柏挥发油时得出的结论相似。因此,本试验适宜的酶解pH为5.0~5.5。
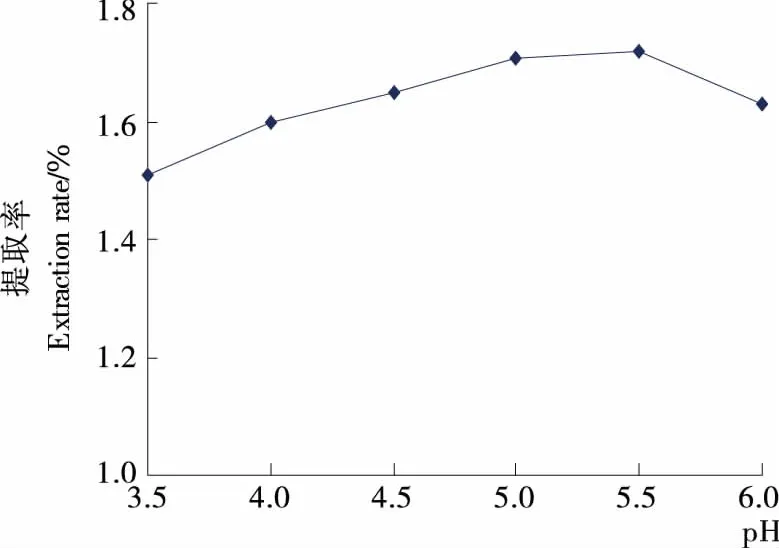
图4 酶解pH对提取率的影响Figure 4 Effect of enzyme pH on extraction rate
2.1.5 液料比对提取率的影响 由图5可知,液料比在7∶1~16∶1 (mL/g)时,提取率随着液料比上升而增加;当液料比超过16∶1 (mL/g)时,提取率逐渐下降。这是因为一定体积的水作为反应介质,对酶解反应具有促进作用。若液料比较低,酶解液的黏度较大,影响了酶的流动性,不利于酶解反应进行;而液料比过大,酶浓度和底物浓度均下降,降低了酶与底物的碰撞机率,导致酶的作用效果降低,提取率下降。冷进松等[14]在研究酶法辅助提取啤酒花精油时,也证实精油提取率随着液料比增加而上升,当液料比增加至一定程度后,提取率随着液料比增加而下降。因此,本试验选择适宜液料比为16∶1 (mL/g)。
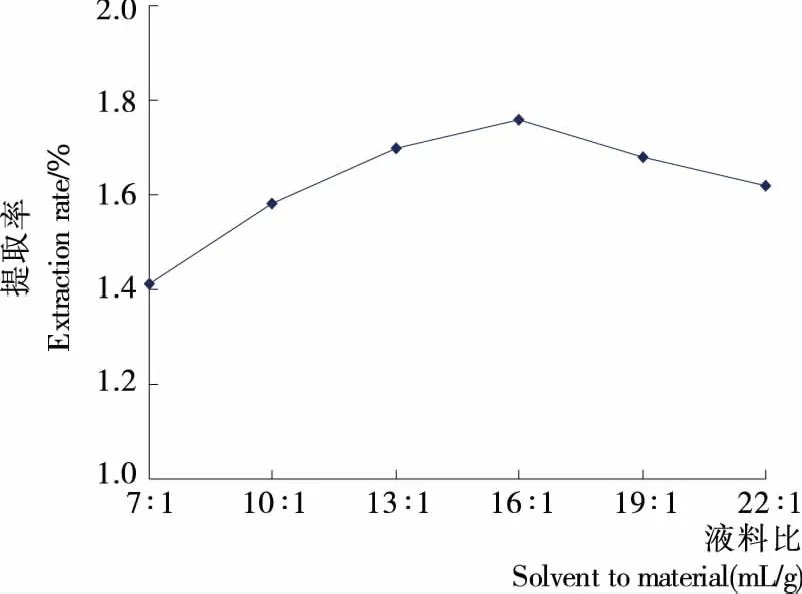
图5 液料比对提取率的影响Figure 5 Effect of solvent to material on extraction rate
2.1.6 酶解时间对提取率的影响 由图6可知,当酶解时间从25 min延长到70 min时,提取率明显增加;当酶解时间超过70 min后,提取率不再增加。这是由于随着酶解时间的延长,酶与底物结合后充分进行反应,提取率相应增加。但是酶解反应进行一定时间后,由于底物浓度减少,酶解反应已经基本完成,提取率不会进一步增加。此外,如果酶解反应时间过长,还会增加能耗。丁兴红等[15]在采用纤维素酶辅助提取温莪术挥发油时也得出了类似的结论。因此,本试验选择适宜的酶解时间为70 min。
2.1.7 蒸馏时间对提取率的影响 由图7可知,当蒸馏时间从60 min延长到150 min时,提取率明显上升;当蒸馏时间超过150 min后,提取率不再增加。这可能是随着蒸馏时间延长,柠檬果皮细胞中的精油不断游离出来,使提取率上升;当蒸馏时间超过150 min后,精油已经基本溶出,提取率不再增加,继续延长蒸馏时间对提取率影响不大。而且蒸馏时间过长也会增加能耗。这与包怡红等[16]研究蒸馏时间对艾叶精油提取率影响的结果一致。因此,本试验较适宜蒸馏时间为150 min。
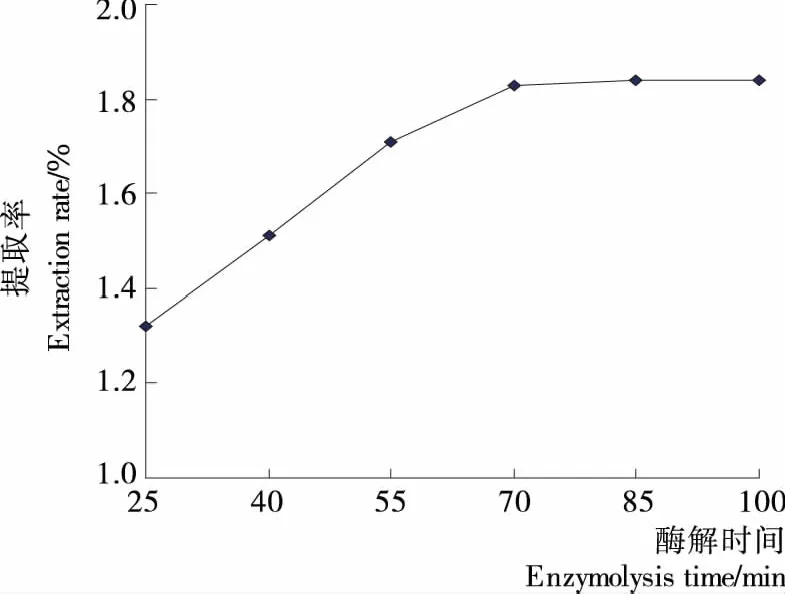
图6 酶解时间对提取率的影响Figure 6 Effect of enzymolysis time on extraction rate
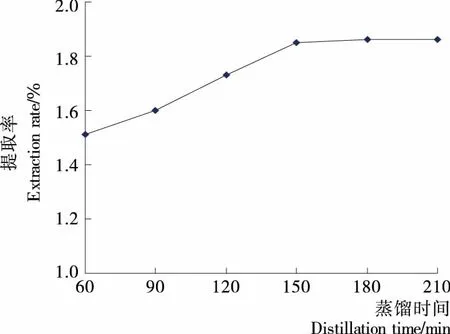
图7 蒸馏时间对提取率的影响Figure 7 Effect of distillation time on extraction rate
2.2 响应面试验
2.2.1 响应面模型的建立 单因素试验结果表明,酶解温度和pH值分别保持在50~55 ℃和5.0~5.5时,对提取率影响不显著。因此,响应面试验选择对精油提取率影响较显著的酶添加量、液料比、酶解时间和蒸馏时间4个因素为自变量,以提取率为响应值,按照Design-expert 11.0软件中Box-Behnken Design(BBD)设计响应面试验(response surface methodology,RSM),各因素的具体取值见表1,RSM的结果见表2。
采用Design-expert 11.0软件对表2的试验结果进行优化分析,得出了提取率与酶添加量、液料比、酶解时间和蒸馏时间的二次回归方程模型:
Y=1.82+0.14A+0.08B+0.14C+0.06D+0.04AB+0.08AC+0.05AD+0.03BC+0.06BD+0.02CD-0.13A2-0.08B2-0.09C2-0.09D2。
(2)
2.2.2 响应面模型的显著性检验 将二次回归方程模型进行方差分析,对模型系数进行显著性检验,结果见表3。
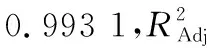
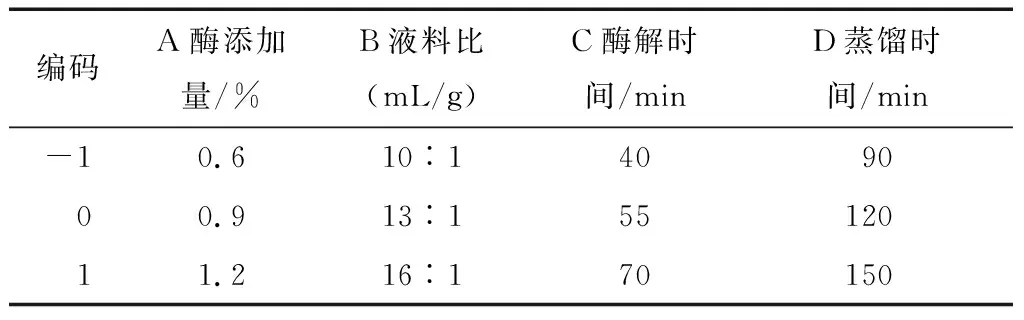
表1 BBD设计因素水平编码表Table 1 Factors and levels of BBD
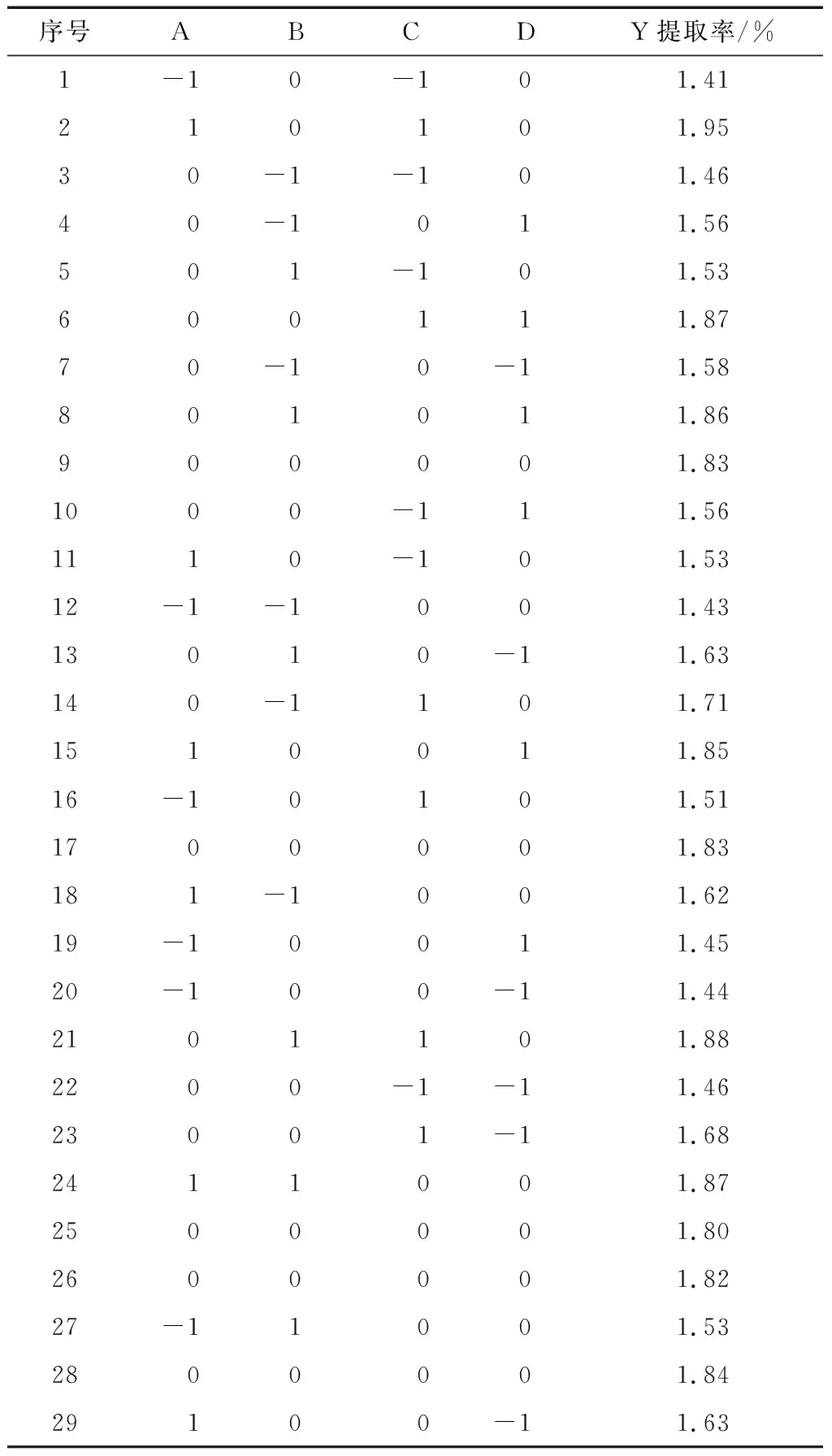
表2 BBD设计及结果Table 2 Experiment design and results of BBD
2.2.3 各因子间交互作用的响应面分析 各因子间交互作用的响应面分析见图8。
由图8可知,将酶添加量、液料比、酶解时间和蒸馏时间中的任意2个因素固定在中心点位置时,其他2因素对提取率均存在显著或极显著交互作用。
2.2.4 验证实验 采用Design-expert 11.0软件对回归方程模型进行预测,得出理想的提取工艺为:酶添加量1.13%,液料比15.78∶1 (mL/g),酶解时间62.47 min,蒸馏时间139.67 min,理论提取率2.23%。考虑到实际操作的可行性,将提取工艺参数修正为酶添加量1.1%,液料比16∶1 (mL/g),酶解时间63 min,蒸馏时间140 min。按照上述修正条件下进行3次验证实验,实际提取率的平均值为2.12%,与理论预测值基本吻合。表明该模型可以预测试验结果,具有较好的应用价值。

表3 回归方程的方差分析†Table 3 Variance analysis of regression equation
† *表示差异显著,P<0.05;**表示差异极显著,P<0.01。
2.3 柠檬精油的化学成分分析
水蒸气蒸馏和纤维素酶辅助水蒸气蒸馏提取柠檬精油的总离子流图见图9。
采用GC-MS对提取的柠檬精油进行定性定量分析,利用NIST11质谱数据库进行对照解析,取匹配度85%以上数据,相对质量分数在0.1%以上的化合物27种列于表4。
由表4可知,2种不同方法提取的柠檬精油化学成分基本相同,表明纤维素酶在辅助提取柠檬精油的过程中,没有对柠檬精油的化学组成产生影响,保留了其原有成分。纤维素酶辅助提取的柠檬精油共鉴定出27种化学成分,占总成分的97.05%。其中烯类化合物15种,醛类化合物5种,酯类化合物3种,萜类化合物2种和醇类化合物2种,尤其柠檬烯含量较高。Al-Jabri等[18]采用GC-MS对水蒸气蒸馏提取的柠檬果皮精油进行检测,证实柠檬烯、β-蒎烯、月桂烯等是其主要特征组分。Vaio等[17]和秦轶等[4]分别以乙醇提取和压榨提取得到的柠檬果皮精油,经GC-MS检测也得到了类似结论。
2.4 2种提取方法比较
柠檬精油2种提取方法测定结果见表5。

图8 两因子交互作用对提取率影响的响应面图Figure 8 Response surface of mutual-influence of two factors on extraction rate
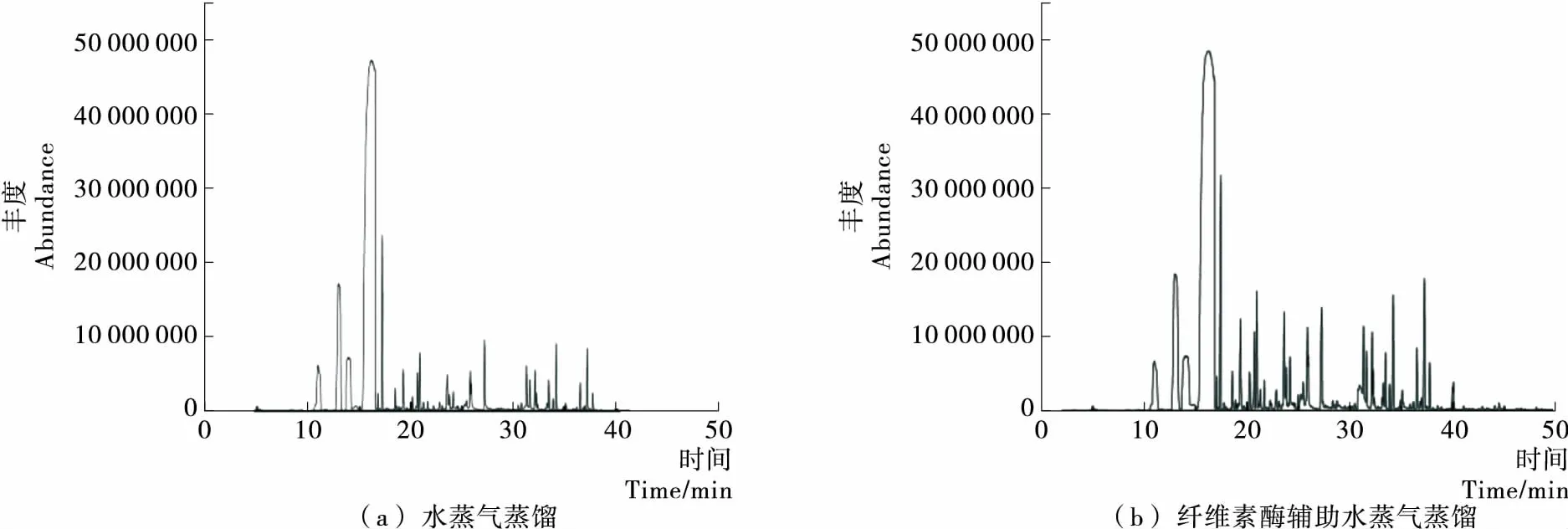
图9 水蒸气蒸馏和纤维素酶辅助水蒸气蒸馏提取柠檬精油的总离子流图Figure 9 Total ion current of essential oil of lemon fromhydrodistillation and cellulase-assisted hydrodistillation extraction表4 2种不同方法提取柠檬精油的化学成分分析

序号化合物名称水蒸气蒸馏提取保留时间/min相似度/%含量/%纤维素酶辅助水蒸气蒸馏提取保留时间/min相似度/%含量/%1α-蒎烯10.96943.2310.96952.492樟脑萜11.68900.1011.68890.123β-蒎烯12.97989.2512.979710.134月桂烯13.95955.2213.96934.785柠檬烯16.159861.8116.159863.526罗勒烯16.93890.1916.93900.167萜品烯17.35903.3117.36923.428异松油烯18.52880.5518.53870.419芳樟醇19.32891.0919.33900.9510樟脑未检出20.23890.1811(R)-氧化柠檬烯未检出20.92870.4512香茅醛21.67870.2221.68850.3113a-松油醇90未检出23.53880.5214癸醛24.16930.6224.17920.7115(Z)-3,7-二甲基-2,6-辛二烯醛25.84941.8625.85931.6716柠檬醛27.23921.8327.24921.91173,7-二甲基-1,6-辛二烯-3-醇甲酸酯25.57850.1025.58870.1118十一醛28.73860.1228.74860.1319α-荜澄茄油烯30.46850.1130.47870.1320乙酸橙花酯31.26920.9431.27901.05212-莰烯31.87870.1031.88860.1022乙酸香叶酯32.09900.6432.10890.73231-石竹烯33.43930.5433.44950.5924α-法尼烯34.16941.2834.17921.3225(E)-β-金合欢烯35.87870.1238.88900.1926巴伦西亚橘烯36.45880.5836.46930.6227氧化石竹烯40.02920.2740.03930.35合计94.0897.05

表5 2种提取方法提取率的比较Table 5 Comparisons of extraction rate of two extraction methods
由表5可见,纤维素酶辅助水蒸气蒸馏提取的柠檬精油提取率不仅略高于水蒸气蒸馏提取率,而且纤维素酶辅助水蒸气蒸馏提取法明显减少了提取时间。这是由于在水蒸气蒸馏前采用纤维素酶对柠檬果皮进行预处理,使得柠檬果皮的细胞结构被有效水解,促进了精油成分能够在水蒸气蒸馏时快速溶出,从而缩短了提取时间。Sowbhagya等[19]在提取孜然精油时证实,采用酶预处理后进行水蒸气蒸馏提取,不仅提高提取率,还明显缩短水蒸气蒸馏时间。Hosni等[20]在采用酶预处理后进行水蒸气蒸馏提取百里香精油和迷迪香精油时,也得出了类似结论。由此可见,纤维素酶辅助水蒸气蒸馏提取法的提取率不仅与水蒸气蒸馏提取法相类似,而且还能缩短提取时间而减少能耗。
2.5 2种提取方法对柠檬皮超微结构的影响
采用扫描电镜对未经处理、水蒸气蒸馏、纤维素酶辅助提取后的柠檬果皮超微结构进行观察,结果见图10。
由图10可以观察到,未经处理的柠檬果皮表面结构与水蒸气蒸馏和纤维素酶辅助水蒸气蒸馏提取的柠檬果皮有明显差异。未经处理的柠檬果皮表面结构平滑和完整;水蒸气蒸馏提取后的柠檬果皮表面部分结构遭到破坏,出现了部分空洞和间隙;纤维素酶辅助水蒸气蒸馏提取后的柠檬果皮表面结构破坏严重,出现了大量不规则的脆片、裂痕和间隙。通常植物原料中有效成分的提取,与原料细胞结构的破坏程度密切相关[21]。在纤维素酶辅助水蒸气蒸馏提取过程中,纤维素酶对柠檬果皮细胞进行了水解,使得细胞表面结构被严重破坏,但是这促进了细胞中精油成分的快速溶出。Baby等[22]在提取豆蔻精油和茴香精油时证实,经酶预处理后的原料表面结构破坏严重,促进了精油的快速提取。李明月等[23]在采用酶辅助提取沉香精油时,也得出了类似结论。
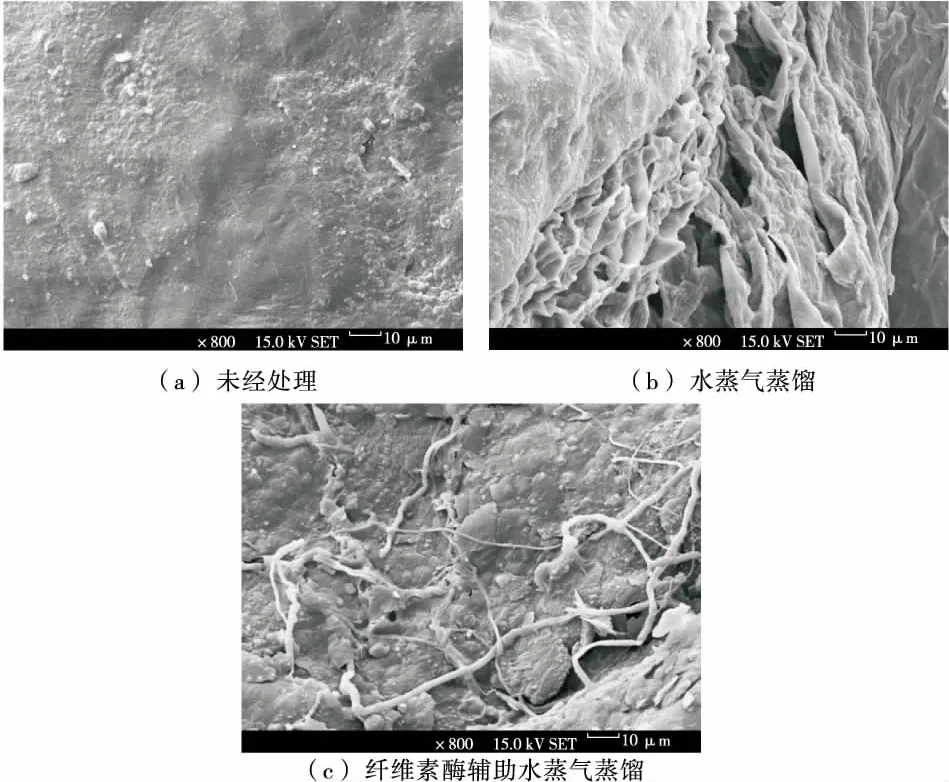
图10 未经处理、水蒸气蒸馏、纤维素酶辅助水蒸气蒸馏提取后的柠檬皮扫描电镜观察
Figure 10 Scanning electron micrographs of lemon peel: lemon peel without treatment, lemon peel byhydrodistillation, lemon peel by cellulase-assisted hydrodistillation extraction
3 结论
本试验通过单因素和响应面试验确定了纤维素酶辅助水蒸气蒸馏提取柠檬果皮精油的最佳工艺条件为:酶解温度50 ℃,酶解pH 5.0,酶添加量1.1%,液料比16∶1 (mL/g),酶解时间63 min,蒸馏时间140 min,提取率为2.12%,所得精油为淡黄色液体,其香气接近鲜柠檬果香。该柠檬精油共鉴定出27种化学成分,占总成分的97.05%,其主要成分为柠檬烯、β-蒎烯和月桂烯。此外,扫描电镜观察表明,纤维素酶通过对原料细胞结构的水解,促进了精油的快速释放。本工艺与传统水蒸气蒸馏提取相比,提取率相近,但明显减少了提取时间,降低了能耗。所以,纤维素酶辅助水蒸气蒸馏提取柠檬精油是一种有效的精油提取方法。

