北极黄河站生态环境考察与研究进展
何剑锋 李承森 姚轶锋 彭方 王能飞 金海燕 张芳马玉欣 张庆华 那广水 孙立广 袁林喜 贾楠
北极黄河站生态环境考察与研究进展
何剑锋1李承森2姚轶锋2彭方3王能飞4金海燕5张芳1马玉欣6张庆华7那广水8孙立广9袁林喜9贾楠9
(1国家海洋局极地科学重点实验室, 中国极地研究中心, 上海 200136;2中国科学院植物研究所, 北京 100093;3武汉大学, 湖北 武汉 430072;4国家海洋局第一海洋研究所, 山东 青岛 266061;5国家海洋局第二海洋研究所, 浙江 杭州 310012;6上海海洋大学, 上海 200433;7中国科学院生态环境研究中心, 北京 100085;8国家海洋环境监测中心, 辽宁 大连 110023;9中国科学技术大学, 安徽 合肥 230022)
北极黄河站位于北极斯瓦尔巴群岛新奥尔松地区, 是生态系统对全球变化响应监测与研究的理想之地。我国自2004年建站以来, 开展了系统的王湾海域生态断面和陆地植被样方的长期监测与研究, 同时开展了环境污染和鸟类种群变迁等方面的考察与研究。结果表明: 冰川退缩迹地上的物种更替明显, 而范氏藓等可很好地反映该地区同时期的气温变化; 从北极黄河站周边区域的海底沉积物、土壤、湖沉积物和冰川冰碛中分离获得了3个北极新属和21个北极新种, 并发现了部分活性菌株; 王湾海域微型浮游生物存在较高的生物多样性, 其表层水存在潜在氮限制; 微藻对温度有较好的适应性, 具有通过自身调节来适应北极环境变化的能力; 苔原植物对重金属具富集能力, 大气传输是持久性有机污染物(POPs)污染来源的最主要途径; 鸟类方面, 在距今9 400年海鸟就已在该地区生活繁衍, 种群数量存在明显波动并在距今7 650年左右达到最大。未来应坚持监测断面和样方的长期监测, 进一步掌握生物群落的变化趋势; 融合我国在该地区的大气、冰川、样方和海洋监测, 开展大气-冰雪-陆地-海洋相互作用研究, 聚焦科学问题并形成我国在该地区的研究特色。
北极 黄河站 生态 环境 研究进展
0 引言
中国北极黄河站是目前我国唯一位于北极地区的综合科学考察站, 于2004年7月28日落成启用。黄河站所在的新奥尔松地区由王湾、周边陆地和山地冰川组成。受冰川季节性融水和湾外大西洋海水的双重影响, 王湾的海水环境和动植物群落存在明显的梯度变化[1]。由于地处高纬, 当地生态系统受人为的扰动较少, 而相对恶劣的环境使得生态系统比低纬度地区的更为简单, 对全球气候环境变化也更为敏感。随着北极气温的持续上升, 冰川融化和冻土层减薄都将导致陆地生态系统和陆源物质循环的变化, 并通过陆源物质对海洋输送特性的变化影响海洋生态系统; 目前禁锢在冰雪和土壤中的污染物也将被释放至空气、水体和陆地, 进而影响生态系统。因而利用我国在北极黄河站已有的监测基础, 通过整合进行跨学科监测与研究, 对于揭示该地区生态系统对环境变化的响应特征和过程具有重要意义。
在斯瓦尔巴科学论坛(Svalbard Science Forum)的基础上, 新奥尔松地区逐步推出了针对大气、陆地、冰川和海洋的4个旗舰计划: 王湾系统、大气研究、陆地系统和冰川学旗舰计划, 指导各国在该地区的监测与研究。斯瓦尔巴科学论坛资料显示, 新奥尔松地区正在实施的各国科研项目中, 生物圈相关课题占有优势。我国于2004年7月黄河站落成时进行了首次考察, 在王湾海域建立了从湾底到湾口的海洋监测断面, 开展海洋环境和浮游生物群落监测与研究, 2011年以来陆续建立了陆地植被监测样方。初始阶段的研究任务主要来自国家自然科学基金委等资助的项目, 从“十二五”时期开始实施了“南北极环境综合考察与评估”专项, 对黄河站的基础环境和生态系统进行了相对系统的考察, 为我国深入研究北极生态环境提供了良好条件。
我国参与北极黄河站生态环境考察与研究的主要机构包括: 中国极地研究中心、国家海洋局第二海洋研究所、国家海洋局第三海洋研究所、国家海洋局第一海洋研究所、国家海洋环境监测中心、中国科学院海洋研究所、中国科学院植物研究所、中国科学院微生物研究所、中国科技大学、武汉大学、山东大学、华东师范大学、同济大学等。
1 陆地与水生植物组成及变化
1.1 陆地植被样方监测
北极黄河站植被样方监测始于2011年7月, 现已建立了11个样方(图1), 分别代表了该地区冰川退缩迹地、风化冰碛圈、人类活动区以及苔原湿地等不同环境, 获得样方内物种多样性和群落结构年际变化数据。其中, 对东洛温冰川(Austre Lovénbreen冰川, 以下简称A冰川)前沿不同年代冰缘线附近植被样方的分析显示, 初始阶段样方内仅出现先锋植物挪威虎耳草(), 而后植物种类和个体数明显增多, 植被群落以木本植物极柳()和草本植物黄葶苈()为主, 地衣以寒生肉疣衣()和鸡皮衣(sp.)等壳状地衣为主; 随着冰川迹地形成时间更长, 植被发展趋向成熟, 样方内极柳占绝对优势, 地衣的物种多样性和盖度显著增加, 出现雪黄岛衣()和刺岛衣()等叶状地衣(图2), 显示冰川退缩迹地上的物种更替明显, 群落结构发生了显著变化[2]。

图1 北极黄河站周边植被样方和海洋监测点分布示意图
Fig.1. Vegetation quadrat and marine monitoring sites near the Yellow River Station

图2 冰川退缩迹地不同演替阶段的维管植物和地衣组成[2]
Fig.2. Compositon of vascular plants and lichens in glacier retreat area at different succession stages[2]
图2中, 维管植物种类有: 1—苔草(), 2—黄葶苈(), 3—仙女木(), 4—冰岛蓼(), 5—米努草(), 6—长毛马先蒿(), 7—北极早熟禾(), 8—珠芽蓼(), 9—漆姑草(), 10—极柳(), 11—零余虎耳草(), 12—丛生虎耳草(), 13—挪威虎耳草(), 14—无茎蝇子草(.); 地衣种类有: 1—盖度合计, 2—壳状地衣(未定种), 3—寒生肉疣衣(), 4—鸡皮衣(sp.), 5—藓生茶渍衣(), 6—橙衣(sp.), 7—脐鳞衣(sp.), 8—雪黄岛衣(), 9—刺岛衣()。
1.2 苔原植物花粉形态多样性研究
运用光学显微镜和扫描电子显微镜对20种苔原植物的花粉形态进行了观察研究。这20种植物分属十字花科、石竹科、莎草科、杜鹃花科、灯心草科、罂粟科、禾本科、蓼科、毛茛科、蔷薇科、杨柳科和玄参科等12科[3-4]。研究结果表明, 这些植物的花粉包括球形、近长球形和长球形等多种形态(图3a)。萌发孔类型有3-(-5)-沟、3-(-4)-孔沟、5-孔、远极单孔和散孔。外壁表面纹饰包括光滑、条纹-穿孔、网状、微刺、粗糙、颗粒状、颗粒-穿孔等类型[3]。而对8种虎耳草属植物花粉形态的观察结果表明: 花粉长球形或近长球形, 具3沟, 极轴(P)长15.4—44.4 µm, 赤道轴(E)长11.4—34.6 µm, 极轴与赤道轴比例(P/E)1.19—1.40(图3b)。根据花粉外壁纹饰特征, 可识别出4种花粉类型: 挪威虎耳草型、零余虎耳草型、雪虎耳草型、簇状虎耳草型。聚类分析表明虎耳草属的花粉性状在属以下的分类具有一定意义[4]。

图3 北极部分苔原植物花粉形态[3-4]. a) a—c: 北极鼠耳草, d—f: 无茎蝇子草, g—i: 蝇子草, j—l: 仙女木; b)a—f: 挪威虎耳草, g—l: 山羊臭虎耳草
Fig.3. Pollen patterns of a part of Arctic tundra plants[3-4]. a)a—c:, d—f:, g—i:, j—l:b)a—f:, g—l:
1.3 藓类与环境研究
对2007年采集的范氏藓()标本的研究发现, 该藓类生长具有明显的季节特征: 夏季生长的茎上具浓叶和长侧枝, 而冬季生长的茎上只有疏叶并且无侧枝。根据主茎在冬、夏两季生长的长度分别是0.07 mm和0.68 mm,推测该藓类在水体中生长年限不超过8年。该藓类夏季生长特征能很好地反映该地区同时期的气温变化, 生长趋势与气温变化趋势相一致(图4)[5]。

图4 范氏藓生长与气温对照[5]. a)范氏藓标本(箭头a, c分别代表夏季生长的开始, 箭头b代表冬季生长的开始); b)2007年5月1日至9月30日新奥尔松地区温度变化曲线图; c)2007年夏季范氏藓叶(实心)和侧枝(空心)生长柱形图
Fig.4. Camparison of air temperature and growth of[5]. a) specimen of(arrows of a, b, c represent starting point of growth in summer, winter and summer ); b) air temperatures between 1st May and 30th September, 2017; c) growth of leaf (solid) and lateral branch (hollow) ofin summer 2007
1.4 淡水微藻生物量和群落变化
我国尚未开展该地区湖泊浮游微藻的直接研究。Jiang等[6]通过对湖泊沉积定年和色素组成分析表明, 近百年来在小冰期(LIA)期间微藻产量较低, 而~1890 AD以来(表层5 cm)藻类生长迅速, 与小冰期后的升温相一致。生物硅含量较低, 而蓝溪藻黄素乙在百年间持续增加。显示该地区湖泊的微藻中硅藻的比例有限, 而蓝绿藻的持续增加可能与人类活动导致的营养盐变化等有关。
2 近岸海洋环境及浮游生物群落变化特征
2.1 王湾水团组成对营养盐分布的影响
夏季王湾水体可以划分为表层水(SW)、中层变异水(TIW)、本地变异水(TLW)和大西洋变异水(TAW)(图5)[7], 其中TLW和TIW主要来自于前一年夏末湾内水体。营养盐结构随着深度的增加逐渐变化, 逐渐由潜在的氮限制转变为潜在的磷限制与硅限制[8]。200 m以深的TAW, 其营养盐来源主要是大西洋水与北极水的混合, 大西洋水中氮硅比值通常在2以上, 导致了王湾区域氮硅比值的高值。大西洋变异水的营养盐浓度相比于王湾外陆架大西洋水营养盐要低许多, 表明TLW底部高值是与水体颗粒物营养盐的再生有关[7]。

图5 王湾调查站位T-S图及其水团划分[7]
Fig.5. Temperature-salinity diagram and water mass division[7]
2.2 陆源输入对王湾上层营养盐分布的影响
春夏季冰川融水等淡水输入使得王湾水域存在较强的层化现象, 而且强烈影响上层海洋营养盐浓度与结构。新奥尔松地表径流水中, 湖水营养盐浓度总体较低, 对王湾水体贡献很小, 而冰川融水中硝酸盐与硅酸盐浓度较高, 其通量占淡水总输入量的一半以上, 携带大量氮、硅营养盐输入湾内。而王湾海域内表层水(SW)营养盐浓度值较低, 表层水呈现低氮磷的营养盐特征(硝酸盐和磷酸盐最低值分别为0.7和0.13 μmol·L–1)[7], 平均硝酸盐和硅酸盐浓度均低于地表径流水, 这部分陆源淡水输入将影响王湾表层水营养盐的平衡。
2.3 营养盐分布对生物活动的影响
观测发现, 夏季王湾海域存在强烈的层化, 使得水体垂直混合困难, 深层高浓度营养盐很难输送到上层水体(图6); 而上层浮游植物生长对营养盐的消耗, 使得表层水中氮磷营养盐浓度进一步降低。王湾表层水中氮磷比值基本低于5, 而氮硅比小于0.5, onglvaava这表明存在潜在氮限制。同时在王湾海域次表层存在硅酸盐的低值。硅藻是王湾的主要浮游植物类群[9], 硅藻在真光层的生物生产大量消耗硅酸盐。表层海水中, 陆源淡水较高的硅酸盐输入(约>5.0 μmol·L–1)对表层消耗的硅酸盐有一定的补充, 而在次表层则硅酸盐的消耗远远大于补充, 使得在次表层存在显著的硅酸盐低值区域。

图6 王湾海域营养盐、Chl a、N/P和N/Si比的断面分布图[7]
Fig.6. Transect profiles of nutrients, Chl a, N/P and N/Si ratios in Kongsfjorden[7]
2.4 王湾微型生物群落特征
浮游细菌主要包括变型菌门(α-, β-, γ-)、直杆菌门、放线菌门、疣微菌门、蓝细菌门和未鉴定细菌等6大类, 表层优势为α-变形菌和蓝细菌, 深层为γ-和α-变形菌; 而真核生物主要包括囊泡虫类、不等鞭毛类、古虫界和后生动物等4大类, 其中不等鞭毛类在表层占有优势, 其次是后生动物。腰鞭毛藻、硅藻和微微型青绿藻为浮游植物优势种[10-12]。浮游甲藻具有较高的生物多样性[13]。沉积物真菌优势目为肉座菌目和酵母菌目, 常见属为毕赤酵母属、镰刀霉属、链格孢属和马拉色霉菌属, 其中多数真菌可能来源于陆地并且内湾和外湾存在明显差异[14]。夏季水体内共发现挪威棘口虫()、水晶薄铃虫()、贫齿拟网纹虫()、巨拟网纹虫()、钝笛杯虫()、领细壳虫属种类(spp.)、细小拟铃虫()和拟铃虫属种类(spp.)等8类砂壳纤毛虫, 丰度为< 1 ind·L–1至2 435 ind·L–1不等[15]。
研究表明, 异养微型鞭毛类和细菌在夏季王湾微生物群落中起着重要作用, 浮游群落结构与环境参数的结合可以作为进入王湾的大西洋入流水变异的一个指示[12,16-17], 多样性和特定类群丰度均显示陆地细菌群落对近岸海洋浮游细菌存在一定的影响[18], 因而王湾海域浮游生物群落受大西洋入流水和夏季冰川融水的双重影响。
2.5 表层沉积物中溶解有机质的来源与转化历史
对王湾表层沉积物的溶解有机质(DOM)分析结果显示, 受由海流和冰川相互作用引起的沉积过程差异的影响, 其组成和来源存在着高度的空间变异性[19]。在湾顶海域以新近自生源为主, 主要来自生物碳泵对颗粒有机质输移作用的贡献, 而在湾中和湾口附近则以较老的腐殖质占优, 主要源于微型生物碳泵和生物碳泵对溶解有机质的转化和输移耦合作用的贡献。
3 微生物群落分布与结构特征
3.1 新属和新种的发现
从北极黄河站周边区域的海底沉积物、土壤、湖沉积物、冰川冰碛中分离发现了3个北极新属:(黄河菌属)、(适冷居冰菌属)、(副芽殖单胞菌); 21个北极新种:(土壤黏液杆菌)、(北极科恩氏菌)、(北极土地杆菌)、(珞珈苍黄杆菌)、(北极黄河菌)、(湖沉积碘杆菌)、(北极成对杆菌)、(北极适冷居冰菌)、(北极薄层菌)、(北极螺状菌)、(黄河土地杆菌)、(冰土地杆菌)、(北极土生单胞菌)、(北极副芽殖单胞菌)、(北极苍黄杆菌)、(多颗粒鞘氨醇橙色菌)、(北极玫瑰单胞菌)、(北极水杆菌)、(冷金黄杆菌)、(北极链霉菌)、(黄河站极杆菌)[20-39], 其中的一个新属和两个新种以黄河站命名。对具有特殊胞外附属物的新种进行了全基因组测序[40], 并对该属的特性进行了修订(图7)。
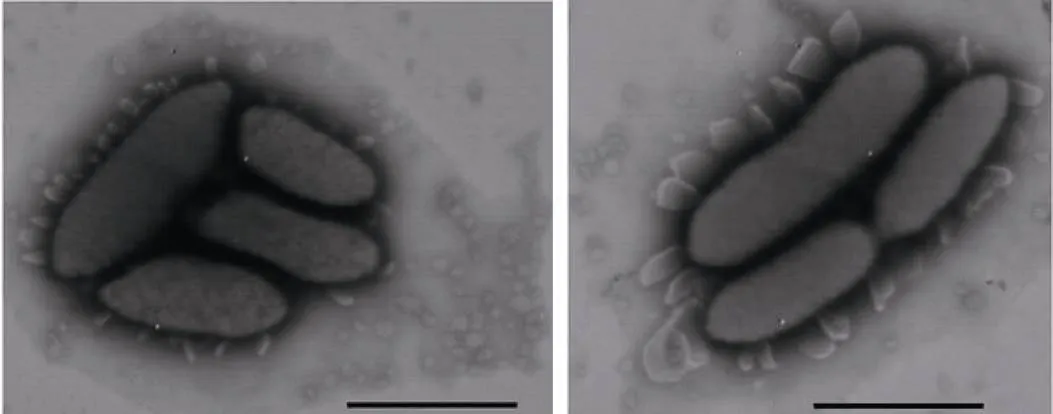
图7 新种Pedobacter arcticus的电镜照片(含有特殊泡状胞外附属物)[40]
Fig.7. Electron microscope picture of new species(some extracellularappendages occurred)[40]
3.2 微生物多样性分析
从7种常见植物根际土壤样品中分离获得53株放线菌, 分别属于8个属, 除了优势菌链霉菌属和节杆菌属外, 还发现了红球菌、糖丝菌、拉塞氏杆菌、微球菌、诺卡氏菌和克里贝拉等6种稀有菌[41]。而对王湾沿岸潮间带和土壤进行分离纯化获得真菌65株, 分属25个属, 其中数量多的是青霉属, 其次为丛赤壳属和节枝孢属[42]; 2012年北极黄河站考察分离得到60株真菌, 分属于4个纲15个属, 其中数量最多的为被孢霉属和地丝霉属[43-44], 表明北极地区具有丰富的真菌物种多样性。从王湾褐藻海带样品中分离获得9个属的65株细菌, 其中嗜冷杆菌属、冷单胞菌属和极地杆菌属为主要菌群[45]。
对A冰川冰芯样本构建16S核糖体核糖核酸(16S rRNA)基因的克隆文库, 262个克隆属于59个种系, 归为细菌域的10个谱系, 其中拟杆菌、放线菌、α-变形菌和蓝藻最为丰富[46]。对地衣优势共生藻研究表明, 北极新奥尔松地区和南极乔治王岛共生藻均为绿藻种——詹氏共球藻(), 因此认为该基因型与地衣物种及采集地没有明确的对应关系[47]。
3.3 功能微生物研究
从王湾褐藻海带样品中分离获得菌株中筛选获得了21株分泌藻酸盐裂解酶的菌株, 其中嗜冷杆菌属、维诺格拉得斯基氏菌属()、冷单胞菌属和极地杆菌属是首次被发现能产生藻酸盐裂解酶, 有的菌株酶活性可达200 U·mL–1 [45]。而对真菌的研究中也发现了一些能够产生β-葡萄糖苷酶转化龙胆苦苷的青霉属菌株[42]。另外, 从此区域海洋沉积物、湖泊沉积物及土壤中分离获得的151株微生物中发现12.4%的菌株有抗菌活性, 6.2%菌株有抗肿瘤活性, 其中3株同时具有抗菌、抗肿瘤活性[48]; 从海底沉积物样品中分离纯化、驯化、筛选获得北极3株假交替单胞菌属耐冷石油降解菌, 能利用多种石油烃组分作为碳源生长并可降解多环芳烃, 对碳源的利用具有广谱性[49]。研究表明, 极地蕴藏有良好的微生物可利用资源。
3.4 微生物群落的环境相关性研究
对新奥尔松地区典型植物根际土壤微生物群落的研究显示, 在本底水平上纤维杆菌几乎没有, 与南极存在明显差异。有机碳、氮、溶解氮、磷酸盐、硅酸盐和pH均对山蓼根际土的影响较大(图8), 其中硅酸盐和pH是负影响, 说明蓼科植物喜欢生长在土壤有机质丰富的环境。而其他植物根际土菌群结构受pH的影响较小[44]。而对土壤真菌的分析表明, pH是影响群落结构最主要的环境因子, pH为8—9、7—8和6—7的土壤中优势目分别为瓶口衣目(Verrucariales)、粪壳菌目(Sordariales)和粉口衣目(Coniochaetales)[50]。

图8 各样品与理化因子的主成分分析[44]. soil_1—soil_3:北极柳根际土; soil_4—soil_6:发草根际土; soil_7—soil_9:蓼科植物根际土; soil_10—soil_12:本底水平
Fig.8. Principal Component Analysis of samples and environmental variables[44]. soil_1—soil_3: soil near root of; soil_4—soil_6: soil near root ofsp.; soil_7—soil_9:soil near root ofsp.; soil_10—soil_12:soil of background
4 北极微藻的环境适应性研究
4.1 对温度变化的生理适应性研究
对分离自该地区的1种硅藻(玛氏骨条藻)和2种绿藻(小球藻和衣藻)的实验研究表明, 微藻对不同温度(0℃、4℃和8℃)的适应性因种而异, 玛氏骨条藻在4℃具有最快生长速率, 小球藻是8℃, 而衣藻生长情况相差不大, 总体而言3种藻对3个温度均有较好的适应性[51-52]。胡萝卜素(Caro)和叶绿素c分别与玛氏骨条藻在4℃和0℃下高细胞活性和初级生产力正相关; 而叶绿素a(Chl a)对小球藻3个培养温度下的细胞活性均具有积极效应, Caro在0℃下表现为较高的正效应[53]。对甲藻冰川极地藻()的梯度温度培养实验显示, 4℃环境下藻细胞内生长指示蛋白—— 二磷酸核酮糖氧合酶/羧化酶(Rubisco)的表达量基本恒定, 而温度上升至15℃、20℃时藻株则处于胁迫状态[54]。表明极地微藻在一定的温度范围内(如8℃以下)均有较好的适应性。
4.2 北极微藻对光照的生理适应性及荧光特性研究
利用流式细胞术(FCM)、全荧光光谱法和脉冲调制法(PAM)对两种北冰洋微藻: 柔弱伪菱形和海链藻的研究显示, 柔弱伪菱形藻的丰度、基础荧光(F0)、光合系统II(PS II)光化学的有效量子产量(Φ PS II)及光合电子传递效率(ETR)均高于海链藻的相应值[55-56]。光应芝等[57]利用PAM对10种极地微藻的叶绿素荧光分析显示, PS II潜在活性值v/0值大小顺序为海链藻>金色藻>短孢角毛藻>衣藻>柔弱伪菱形藻>北极异帽藻>四棘藻>塔胞藻。其中短孢角毛藻、四棘藻和海链藻的非光化学淬灭(NPQ)值均大于2.0, 表明其光保护能力较强。崔世开(Cui)等[58-59]开展的浮游植物群落低光照/低盐度适应性现场培养实验结果显示, 浮游植物具有较强的暗适应能力, 并在提供光源后能恢复生长。
4.3 微藻对紫外辐射的生理适应性研究
彭小伟等[60]对分离自北极冰川融水的淡水微藻——小球藻(sp)的研究显示, 在低强度紫外线B(UVB)辐射下(45 μW·cm–2), Chl a和Caro含量先升后降, 且在4 h时有最大值; 高强度UVB辐射下(76 μW·cm–2), Chl a和Caro含量随辐射时间延长基本呈下降趋势; 而超氧阴离子和丙二醛(MDA)含量基本随辐照时间的延长和辐照强度的增大而提高, 表明UVB辐射、尤其是高强度UVB辐射会对北极冰川微藻带来不利的影响。
5 污染物分布及人类活动影响
5.1 重金属
夏重欢和谢周清[61]对湖泊沉积的分析表明, 沉积物表层5 cm汞(Hg)、硒(Se)、镉(Cd)等重金属的污染主要源于20世纪该地区的煤炭开采, 5 cm以下部分则属于自然沉积; 而湖泊藻类的吸收和沉降是导致表层出现峰值的一个重要因素[62]。姜珊等[63]对含有苔藓植物残体沉积剖面的分析显示, 工业革命以来Hg含量明显上升, 人类污染的比例由30%上升至表层的90%, 而当地Hg的输入主要来源于远距离大气输送。袁林喜等[64]和Wang等[65]对3种苔原植物的分析表明, 该地区苔藓体内污染水平显著低于邻近的北欧等工业区, 但采矿过程导致Hg、Cd和硫(S)污染严重。对王湾表层沉积物中重金属的分析表明, 除了锌(Zn)外, 其他重金属元素含量均明显低于全球页岩均值, 整体而言研究区域中重金属元素属于无污染水平[66]。Lu等[67]的研究显示, Hg存在一定程度的人类污染, 而铅(Pb), 锌(Zn)和Cd人类污染则很有限; 而Hao等[68]对土壤的研究则显示, Pb、Cr、Cd、Hg含量受人类活动的影响明显。总体而言, 该地区重金属污染程度较低, 污染主要源于大气传输, 而开矿等人类活动对矿区重金属浓度有一定的影响。
5.2 持久性有机污染物(POPs)
5.2.1 多氯联苯(PCBs)
对北极新奥尔松地区地表沉积物、苔藓和动物粪便的分析表明, PCBs的浓度范围在0.20—3.25 ng·g–1(平均0.84 ng·g–1)。PCBs主要由四氯、五氯和六氯代PCBs同类物组成, 分别占总量的23.8%、26.7%和32.3%。大气传输是新奥尔松地区环境中PCBs污染来源的主要途径之一[69-70]。氯苯-11(CB-11)在PCBs中占优优势, 植被中生物积累因子<1[71]。对手性PCBs的研究表明, 手性CB-195, -136和-149在所有样品中均有检出; CB- 174和CB- 183在除鹿粪之外的样品中均有检出; CB-176在大多数样品中有检出。CB-95的对映体分数值(EFs)值均显著小于理论值0.5, 而其他手性PCBs均在0.5上下浮动(图9)。土壤中微生物作用以及植物的选择性吸收可能会对不同介质中的组成产生影响。
5.2.2 有机氯农药(OCPs)
对土壤、苔藓和动物粪便等介质的分析显示, OCPs能被普遍检出, 平均浓度的大小分别为5.01、6.72和5.12 ng·g–1(dw)。六氯环己烷(HCHs)和滴滴涕(DDTs)为主要污染物, 平均浓度分别为2.24 ng·g–1和0.55 ng·g–1, 其中HCHs主要以α-HCH和β-HCHs两种异构体为主, 占HCHs总量的81.6%, 而DDTs的残留主要以pp’-DDD为主[70,72]。Jiao等[73]分析了6个湖泊沉积物和海边沉积物中有机氯农药的污染水平, 结果表明沉积物中HCHs、DDTs均可检出, 其浓度分别为0.21—7.0 ng·g–1(dw)、0.07—5.9 ng·g–1(dw); α/γ HCH>1的比值表明该地区可能存在新污染源的输送, 即林丹的使用。
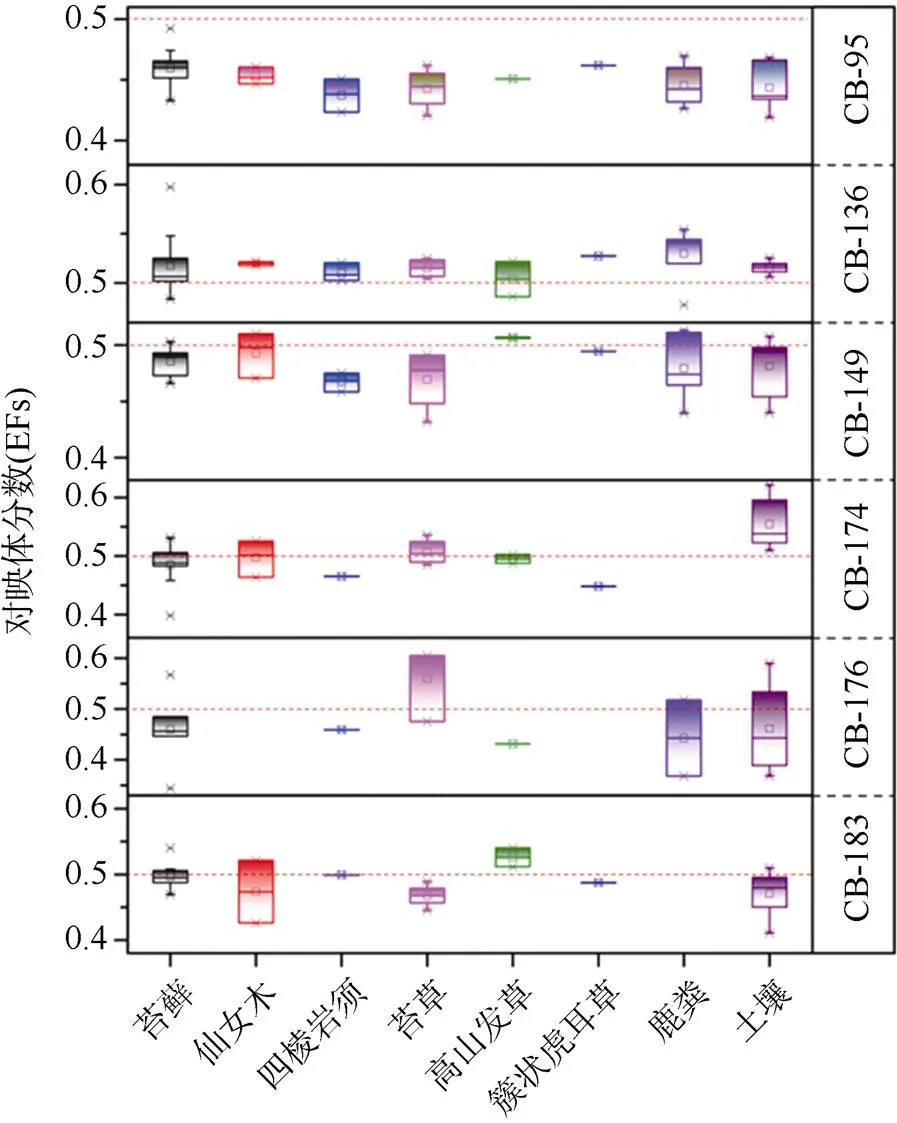
图9 北极样品中不同手性PCBs的EFs值(红线代表外消旋混合物的理论EFs值0.5)
Fig.9. EFs of different chiral PCBs in Arctic samples
5.2.3 多溴联苯醚(PBDEs)
土壤、植物及鹿粪中PBDEs的浓度比PCBs低一个数量级, 其浓度范围分别为1.7—416、36.7—495以及28.1—104 pg·g–1(dw)[71]。PBDEs中BDE-47浓度最高, 其次为BDE-99, BDE-183和BDE-154。而Wang等[74]的分析显示, 土壤、苔藓和鹿粪中的PBDEs平均浓度分别为42、122和72 pg·g–1(dw), 其理化特性是表征PBDEs在不同介质中分布的合适参数。对6个湖泊沉积物和海边沉积物中PBDEs的分析表明, 其浓度水平很低(0.024—0.97 ng·g–1(dw)), 湖中沉积物的PBDEs浓度高于海边沉积物; BDE-47在所有沉积物样品中均为最主要的检出单体, 低溴代的BDE-3、7、17、28也是浓度较高的单体, 而BDE- 209则均未检出[73]。
5.2.4 多环芳烃(PAHs)
对土壤、苔藓和鹿粪样品PAHs的分析表明, 土壤中低环PAHs(萘、苊、苊烯和芴)的比例较小, 而在苔鲜和鹿粪中的比例较大, 与之相反, 中环和大环PAHs在土壤中的比例较大。土壤中的PAHs主要来自颗粒物的干湿沉降, 苔鲜中PAHs主要来自气态PAHs[72]; 上述3个环境相中PAHs以2、3环为主, 5、6环PAHs含量相对较低, PAHs个体的物理化学性质可用于表征其在土壤、苔藓和鹿粪中的分布规律[75]。而湖泊和海边沉积物中PAHs的浓度浓度范围为11—1 100 ng·g–1(dw), 距离煤矿较近的点位PAHs的含量偏高, 海边沉积物中PAHs的浓度低于湖泊沉积物中的浓度。萘和菲是所有沉积物样品中最主要的PAHs同类物[73]。
5.2.5 得克隆类物质(Decs)
大气中ΣDecs含量为3.638—24.692 pg·m–3(均值10.920 pg·m–3), 高于南极大气中的含量(0.98—23.9 pg·m–3, 均值6.9 pg·m–3); 苔藓中ΣDecs的浓度水平为0.2—3.7 pg·g–1(均值为1.7 pg·g–1),其中得克隆(Dechloraneplus, DP)的两种异构体(顺式syn-和反式anti-)检出率为100%, Dec 603和Dec 604的检出率分别为25%和87%; 王湾表层海水中ΣDecs的浓度范围是69—303 pg·L–1, Dec 602、Dec 604、syn-DP和anti-DP检出率为100%; 王湾表层沉积物中ΣDecs的浓度范围为116—885 pg·g–1, DP两种异构体普遍检出, 浓度均值为270和73 pg·g–1。表层海水和沉积物中ΣDecs分布表现出湾口高于湾内, 冰川融水的稀释作用是其主要成因。通过各环境介质中syn-DP和anti-DP比值分析, 大气远距离传输和动物迁徙是该区域Decs的主要来源[76]。
6 北极环境与鸟类群落的历史变迁
6.1 9 400年前:海鸟登陆北极新奥尔松
2004年7月, 在一个一级海岸阶地发现一处早期的顶盖已被侵蚀的海蚀凹槽, 采集到厚约118 cm的沉积物, 其中还夹杂着大量贝壳残体和一些砾石。经分析其中的总有机碳(TOC)、总氮(TN)、d13C、d15N, 结合加速器质谱定年方法(AMS14C), 准确识别出沉积物中的有机质主要是通过海鸟的捕食和排泄等生物地球化学过程将海洋源的有机质转移到该海蚀凹槽中沉积下来的(图10)。进一步, 对来自于凹槽沉积物底部的两个贝壳残片的放射性14C年龄分别为9 820±50和9 795±25 a BP, 经过海洋储库校正(440 a)的年龄分别为9 380±50和9 355±25 a BP。据此可以推断, 海鸟早在距今9 400年就已经登陆并生活繁衍[77-80], 这是对北极新奥尔松全新世海鸟登陆确切时间的首次报道。

图10 北极不同营养级海洋生物的氮同位素值的变化范围
Fig.10. Nitrogen isotope ranges of different Arctic trophic level marine organisms
6.2 9 400年前: “后天”在北极上演
对其中70—118 cm层位的贝壳残体采用AMS14C定年法来测定这些贝壳的死亡年龄, 8个挑选出的贝壳残体的储库校正年龄为距今9 350—9 450年, 平均年龄为约距今9 400年。在δ18Oaragonite-PDB- δ18Owater-VSMOW和温度等值线的图解中, 得到凹槽中贝壳表示的古温度范围为-0.52—4.78℃, 总体而言比现代环境水体温度高出约1℃。这样惬意安详的海洋环境是怎样被打破的呢?研究显示在早全新世暖期(距今11 000—9 000年), 北极地区出现了一次较为明显的突然降温事件, 时间发生在距今9 400年, 持续时间约100年左右, 但是降温幅度达约2℃。这次突然而快速的降温事件, 重创了北极生态系统, 导致浅水嗜温贝类海螂()的大量突然死亡。这个家族盛极而衰, 元气大伤, 历经9 400年, 仍未能走出灾难的阴影[80-81]。
6.3 9 400—1 800年前: “后天”之后的海鸟繁荣史
对海蚀凹槽沉积物的70—118 cm层位的化学元素、TOC、TN以及碳、氮同位素的综合分析, 重建了9 355—1 860 a BP的海鸟数量变化曲线(图11)。海鸟自距今9 400年登陆新奥尔松至距今1 860年期间, 其种群数量经历了2个主要阶段: (1)登陆之初, 海鸟种群数量逐渐增长, 在距今7 650年左右达到最大种群数量; (2)随后的5 800年时间里, 海鸟种群数量经历了3次剧烈波动: 7 650—6 280 a BP、6 280—4 580 a BP、4 580—2 540 a BP。将海鸟种群数量变化与斯瓦尔巴群岛西海岸的海表面温度(SST)、北大西洋冰筏事件强度变化、表征湾流强度的深海沉积物冰岛玻璃含量对比发现(图11), 海鸟种群数量与SST的关系并不明显, 但与北大西洋冰筏事件强度变化具有显著的同步性, 尤其与表征高尔夫湾流强度的深海沉积物冰岛玻璃含量具有显著的相关性。由此可以推测, SST并不是新奥尔松海鸟生态的显著性限制因素, 北大西洋气候, 尤其是高尔夫湾流的变化会对海鸟生态形成决定性的影响。
6.4 1 900 AD: “后天”再次来袭
对10—70 cm层中的砾石形态进行观察发现, 在该层位中, 砾石表面有明显的擦痕, 很可能是冰川作用的结果。结合岩性特征、粒径特征, 推断10—70 cm层的砾石堆积可能是冰碛物。年代学分析显示, 这些砾石堆积是发生在1 550—1 920 AD期间的北极小冰期冰进形成的。这表明北极小冰期冰进明显, 到达了现在西海岸的边缘, 也很可能是这次小冰期的冰进破坏了海蚀凹槽中沉积的贝壳鸟粪层, 致使1 860 a BP到小冰期开始之间的贝壳鸟粪沉积缺失。
6.5 1900 AD至今: 人类拓荒北极的蛛丝马迹
对北极新奥尔松的煤、煤矸石、土壤、苔藓中的锑(Sb)分布特征进行了系统研究, 发现新奥尔松地区煤和煤矸石样品中Sb的含量很低, 平均值仅为0.1 mg·kg–1, 这不仅远低于世界其他许多地区的煤和煤矸石中的水平, 也低于当地表层土壤中的Sb水平(0.313 mg·kg–1), 因此过去矿区开采等人类活动不会对当地人类或其他生物体产生毒害作用。不同于Sb在土壤中的分布特征, 苔藓中Sb含量(0.108 mg·kg–1)受地势、风向等自然因素的影响更为显著。由于苔藓对Sb的吸收主要源于大气, 且表现出一定程度上的生物累积作用, 因而相对于表层土壤而言, 苔藓对于历时更久的Sb污染源的反映更敏感。苔藓对低Sb地区的污染监测而言, 有很大的应用前景[82]。

图11 新奥尔松9 355—1 860 a BP期间的海鸟种群数量变化与斯瓦尔巴群岛西部海平面平均温度、北大西洋深海沉积物中的冰岛玻璃质含量和赤铁矿沾染颗粒物含量变化的比较
Fig.11. Comparison of bird abudances in New-Ålesund during 9 355—1 860 a BP with SST, Icelandic glass and hematite-stained grain
7 展望与结语
通过十多年的北极黄河站生态环境监测与研究, 我国已在北极新奥尔松地区建立了一条王湾海洋生态环境监测断面和11个陆地植被监测样方, 对土壤、植被、湖泊、冰川(冰川融水)、海洋、沉积物等开展了一系列的研究, 取得了一批较好的研究成果, 加深了对北极生态环境及变化特征的了解。但该地区的考察与研究也存在较大的挑战, 一是由于黄河站所在的新奥尔松地区聚集了挪威、德国、英国、法国、意大利、日本、韩国和印度等其他国家的考察站, 在有限的区域内开展考察, 在考察内容上难免会有所重叠, 二是我们在黄河站每年的考察人次有限, 因而很难有机会开展一些较为深入的如季节变化研究。为了能进一步突出我国在该地区的特色, 在未来的监测与研究方面, 一是要坚持监测断面和样方的长期监测, 进一步掌握生物群落的变化趋势, 开展生态系统气候变化响应的研究; 二是要逐步把我国的冰川监测、样方监测和海洋监测逐步融合成一个断面, 开展大气-冰雪-陆地-海洋综合监测, 揭示相互作用, 形成我国在该地区的研究特色; 三是鉴于环境和环境变化的相似性, 黄河站的监测与研究可以与我国南极长城站的监测相结合, 开展南、北极生态环境的对比研究, 进一步推进我国极地站基生态环境监测与研究的发展; 四是鼓励把我国在黄河站所做的工作分别纳入旗舰计划的相关内容, 确保考察研究与国际上同步。
1 HOP H, FALK-PETERSEN S, SVENDSEN H, et al. Physical and biological characteristics of the pelagic system across Fram Strait to Kongsfjorden[J]. Progress in Oceanography, 2006(2): 182—231.
2 姚轶锋, 曹叔楠, 彭方, 等. 北极新奥尔松Austre Lovénbreen冰川退缩迹地不同演替阶段的植物组成与植被群落特征分析[J]. 极地研究, 2014, 26(3): 362—368.
3 YAO Y, ZHAO Q, BERA S, et al. Pollen morphology of selected tundra plants from the high Arctic of Ny-Ålesund, Svalbard[J]. Advances in Polar Science , 2013, 23(2): 103—115.
4 YAO Y. Pollen morphology in Saxifraga(Saxifragaceae) from Ny-Ålesund, Svalbard, Arctic, and its taxonomic significance[J]. Advances in Polar Science, 2014(2): 105—112.
5 GUO C Q, OCHYRA R, WU P C, et al. Warnstorfia exannulata, an aquatic moss in the Arctic: seasonal growth responses to global climate change[J]. Climatic Change, 2013, 119(2): 407—419.
6 JIANG S, LIU X, XU L, et al. The change of pigment contents and their environmental implications in the lake sediments of Ny- Ålesund, Svalbard, the Arctic [J]. Chinese Journal of Polar Science, 2010, 21(1): 60—70.
7 季仲强, 高生泉, 金海燕, 等. 北极王湾2010年夏季水体营养盐分布及影响因素[J]. 海洋学报, 2014, 36(10): 80—89.
8 李宏亮, 陈建芳, 刘子琳, 等. 北极楚科奇海和加拿大海盆南部颗粒生物硅的粒级结构[J]. 自然科学进展, 2007, 17(1): 72—78.
9 KECK A, WIKTOR J, HAPTER R, et al. Phytoplankton assemblages related to physical gradients in an Arctic, glacier-fed fjord in summer[J]. ICES Journal of Marine Science, 1999, 56: 203—214.
10 ZENG Y, ZHENG T, LI H. Community composition of the marine bacterioplankton in Kongsfjorden (Spitsbergen) as revealed by 16S rRNA gene analysis[J]. Polar Biology, 2009, 32(10): 1447—1460.
11 LUO W, LI H, CAI M, et al. Diversity of microbial eukaryotes in Kongsfjorden, Svalbard[J]. Hydrobiologia, 2009, 636(1): 233—248.
12 GUO C Y, HE J F, ZHANG F, et al. Spatial heterogeneity of a microbial community in Kongsfjorden, Svalbard during late summer 2006 and its relationship to biotic and abiotic factors[J]. Advances in Polar Science, 2011, 22(1): 58—69.
13 LUO W, Dai C J, LI H, et al. Phylogenetic diversity of dinoflagellates in polar regions[J]. Advances in Polar Science, 2011, 22(1): 35—41.
14 ZHANG T, WANG N F, ZHANG Y Q, et al. Diversity and distribution of fungal communities in the marine sediments of Kongsfjorden, Svalbard (High Arctic)[J]. Scientific Reports, 2015, 5(1).
15 FENG M, ZHANG W, XIAO T. Spatial and temporal distribution of tintinnid (Ciliophora: Tintinnida) communities in Kongsfjorden, Svalbard (Arctic), during summer[J]. Polar Biology, 2014, 37(2): 291—296.
16 JIANG X, HE J, CAI M. Abundance and biomass of heterotrophic microbes in the Kongsfjorden, Svalbard[J]. Acta Oceanologica Sinica, 2005, 24(6): 143—152.
17 WANG G, GUO C, LUO W, et al. The distribution of picoplankton and nanoplankton in Kongsfjorden, Svalbard during late summer 2006[J]. Polar Biology, 2009, 32(8): 1233—1238.
18 乔宗赟, 曾胤新, 董培艳, 等. 2011年夏季北极王湾细菌群落结构分析及浮游细菌丰度检测[J]. 极地研究, 2015, 27(3): 246—254.
19 蔡明红, 肖宜华, 王峰, 等. 北极孔斯峡湾表层沉积物中溶解有机质的来源与转化历史[J]. 海洋学报, 2012, 34(6): 102—113.
20 ZHOU Z, JIANG F, WANG S, et al.sp. nov., a facultative psychrophile isolated from Arctic soil and emended descriptions of the genus,,,,and. International Journal of Systematic and Applied Microbiology, 2012, 62: 1963—1969.
21 JIANG F, DAI J, WANG Y, et al.sp. nov., isolated from Arctic tundra soil on the Svalbard islands, Norway (78°N). International Journal of Systematic and Applied Microbiology, 2012a, 62: 817—821.
22 JIANG F, LI W, XIAO M, et al.sp. nov., isolated from Arctic tundra soil, and emended description of the genus Luteolibacter[J]. International Journal of Systematic and Applied Microbiology, 2012, 62: 2259—2263.
23 JIANG F, DAI J, WANG Y, et al.sp. nov., isolated from Arctic tundra soil[J]. International Journal of Systematic and Applied Microbiology, 2012, 62: 1630—1635.
24 JIANG F, XIAO M, CHEN L, et al.gen. nov., sp. nov., a bacterium of the family Cytophagaceae isolated from Arctic tundra soil on the Svalbard Archipelago, Norway (78°N) [J]. International Journal of Systematic and Applied Microbiology, 2013, 63: 696—702.
25 JIANG F, QIU X, CHANG X, et al.sp. nov., isolated from Arctic tundra soil[J]. International Journal of Systematic and Applied Microbiology, 2014, 64: 3798—3803.
26 CHEN L, JIANG F, XIAO M, et al.sp. nov., isolated from high Arctic soil on the Svalbard Archipelago, Norway[J]. International Journal of Systematic and Applied Microbiology, 2013, 63: 1616—1620.
27 SU W, ZHOU Z, JIANG F, et al.sp. nov., isolated from Arctic lake sediment[J]. International Journal of Systematic and Applied Microbiology, 2013, 63: 1464—1470.
28 CHANG X, ZHENG J, JIANG F, et al.sp. nov., isolated from glacial till[J]. International Journal of Systematic and Applied Microbiology, 2014, 64: 2113—2118.
29 CHANG X, JIANG F, WANG T, et al.sp. nov., isolated from high Arctic glacial till[J]. International Journal of Systematic and Applied Microbiology, 2014, 64: 2233—2237.
30 QU Z, JIANG F, CHANG X, et al.a gen. nov., sp. nov., isolated from Arctic glacial foreland soil[J].International Journal of Systematic and Applied Microbiology, 2014, 64: 1817—1824.
31 LI H, ZHANG X Y, LIU C, et al.sp. nov., isolated from Arctic fjord sediment, and emended description of the genus[J]. International Journal of Systematic and Applied Microbiology,2014, 64: 973—978.
32 LI X, CHANG X, ZHANG Y, et al.sp. nov., isolated from Arctic Alpine soil[J]. International Journal of Systematic and Applied Microbiology, 2016, 66: 2797—2802.
33 QIU X, JIANG F, QU Z, et al.sp. nov. andsp. nov., isolated from Arctic glacier foreland[J].International Journal of Systematic and Applied Microbiology, 2014, 64: 2431–2436.
34 QIU X, QU Z, JIANG F, et al.sp. nov., isolated from arctic glacial foreland soil[J]. International Journal of Systematic and Applied Microbiology, 2016, 66: 1218—1223.
35 REN L, CHANG X, JIANG F, et al.gen. nov., sp. nov., a bacterium isolated from high Arctic glacial till[J]. International Journal of Systematic and Applied Microbiology, 2015, 65: 260—266.
36 KIM M C, PARK S H, RIM S G, et al.sp. nov., isolated from high Arctic tundra soil, and emended description of the genus[J]. International Journal of Systematic and Applied Microbiology, 2015, 65: 1922—1928.
37 KIM M, KANG O, ZHANG Y, et al.gen. nov., sp. nov., isolated from high Arctic tundra soil, emended description of the genera,and[J]. International Journal of Systematic and Applied Microbiology, 2016, 66: 91—100.
38 KIM T R, KIM M C, KANG O C, et al.sp. nov., isolated from high-Arctic tundra soil, and emended descriptions ofand[J]. International Journal of Systematic and Applied Microbiology, 2016, 66: 609—615.
39 ZHANG L, RUAN C, PENG F, et al.sp. nov., isolated from frozen soil[J]. International Journal of Systematic and Applied Microbiology, 2016, 66: 1482—1487.
40 YIN Y, YUE G, GAO Q, et al. Genome sequence ofsp. nov., a sea ice bacterium isolated from tundra soil[J]. Journal of Bacteriology, 2012 194(23): 6688.
41 滕海波, 唐学玺, 肖慧, 等. 北极黄河站植物根际土壤放线菌分离培养及其鉴定[J]. 极地研究, 2009, 21(1): 33—42.
42 许丹, 马吉飞, 苗祯, 等. 北极Ny-Alesund地区真菌多样性分析及龙胆苦苷转化菌株的筛选[J]. 极地研究, 2012, 24(4): 372—383.
43 丁慧, 王能飞, 臧家业, 等. 北极黄河站地区不同基底中真菌的分离培养及初步鉴定[J]. 海洋学报, 2014, 10: 124—130.
44 王能飞. 南北极近岸土壤微生物群落的结构分析—— 以南极菲尔德斯半岛和北极新奥尔松地区为例[D]. 中国海洋大学, 2014.
45 DONG S, YANG J, ZHANG X Y, et al. Cultivable alginate lyase-excreting bacteria associated with the Arctic brown alga Laminaria[J]. Marine Drugs, 2012, 10(11): 2481—2491.
46 ZENG Y X, YAN M, YU Y, et al. Diversity of bacteria in surface oce of Austre Lovénbreen glacier, Svalbard[J]. Archives of Microbiology, 2013, 195(5): 313—322.
47 李慧, 曹叔楠, 邓红, 等. 对南北极地衣优势共生藻的初步探究[J]. 极地研究, 2013, 25(1): 53—60.
48 那广水, 周传光, 叶亮, 等. 北极微生物的分离及抗菌抗肿瘤活性筛选[J]. 水产科学, 2008, 27: 414—416.
49 那广水, 张月梅, 陈彤, 等. 北极耐冷石油降解菌BJ1、BJ9 和BJ19 的降解特性[J]. 大连海事大学学报, 2010, 36(1): 77—82.
50 ZHANG T, WANG N F, LIU H Y, et al. Soil pH is a key determinant of soil fungal community composition in the Ny-Ålesund region, Svalbard (High Arctic)[J]. Frontiers in Microbiology, 2016, 7: 227.
51 夏利花, 何剑锋, 高岩, 等. 三种北极微藻对不同环境温度适应性的研究[J]. 极地研究, 2009, 21(4): 279—287.
52 XIA L, HE J, ZHANG F, et al. The adaptability of three Arctic microalgae to low temperature[J]. Chinese Journal of Polar Science, 2010, 21(2): 193—203.
53 ZHANG F, HE J, XIA L, et al. Applying and comparing two chemometric methods in absorption spectral analysis of photopigments from Arctic microalgae[J]. Journal of Microbiological Methods, 2010, 83: 120—126.
54 郑淑娴, 何剑锋, 王桂忠, 等. 快速升温后极地甲藻的生理响应[J]. 极地研究, 2013, 25(1): 61—70.
55 ZHANG F, HE J, GUANG Y. Preliminary investigations on Arctic microalgae by joint application of fluorescent instruments[J]. Advances in Polar Science, 2012, 23(2): 128—132.
56 张芳, 光应芝, 张前前, 等. 两种北极微型浮游植物的荧光差异性分析[J]. 海洋与湖沼, 2013, 44(5): 1189—1193.
57 光应芝, 张芳, 张前前, 等. 10种极地微藻叶绿素荧光特征分析[J]. 极地研究, 2011, 23(3): 25—30.
58 CUI S, HE J, ZHANG F, et al. The adaptation of Arctic phytoplankton to low light and salinity in Kongsfjorden (Spitsbergen)[J]. Advances in Polar Science, 2012, 23(1): 19—24.
59 崔世开, 何剑锋, 何培民, 等. 北极王湾海域浮游植物对光照和盐度变化的适应性研究[J]. 极地研究, 2014, 26 (2): 230—237.
60 彭小伟, 何剑锋, 罗玮, 等. UV-B短期照射对北极冰川小球藻sp.的生物学效应[J]. 极地研究, 2010, 22(2): 164—173.
61 夏重欢, 谢周清. 北极新奥尔松地区环境演变的沉积记录[J]. 中国科学技术大学学报, 2007, 37(8): 1003—1008.
62 JIANG S, LIU X, CHEN Q. Distribution of total mercury and methylmercury in lake sediments in Arctic Ny-Ålesund[J]. Chemosphere, 2011, 83(83): 1108—1116.
63 姜珊, 刘晓东, 刘楠, 等. 北极新奥尔松地区过去200年Hg污染记录及来源[J]. 环境科学, 2010, 31(9): 2220—2227.
64 袁林喜, 龙楠烨, 谢周清, 等. 北极新奥尔松地区现代污染源及其指示植物研究[J]. 极地研究, 2006, 18(1): 9—20.
65 WANG X, YUAN L, LIU H, et al. Source of and potential bio-indicator for the heavy metal pollution in Ny- Ålesund, Arctic[J]. Chinese Journal of Polar Science, 2007, 18(2): 110—121.
66 林静. 北极王湾与南极菲尔德斯半岛沉积物、土壤中重金属的分布、污染评价及来源研究[D]. 厦门大学, 2011.
67 LU Z, CAI M, WANG J, et al. Levels and distribution of trace metals in surface sediments from Kongsfjorden, Svalbard, Norwegian Arctic[J]. Environmental Geochemistry & Health, 2013, 35(2): 257—269.
68 HAO Z L, WANG F, YANG H Z. Baseline Values for Heavy Metals in Soils on Ny-Alesund, Spitsbergen Island, Arctic: The Extent of Anthropogenic Pollution[J]. Advanced Materials Research, 2013, 779-780: 1260—1265.
69 马新东, 王艳洁, 那广水, 等. 北极新奥尔松地区有机氯农药和多氯联苯在不同环境样品中的浓度及特性[J]. 极地研究, 2008, 20(4): 329—337.
70 MA X, WANG Y, NA G, et al. Distribution of organochlorine pesticides and polychlorinated biphenyls in Ny-Ålesund of the Arctic[J]. Chinese Journal of Polar Science, 2009, 20: 48—56.
71 ZHU C, LI Y, WANG P, et al. Polychlorinated biphenyls (PCBs) and polybrominated biphenyl ethers (PBDEs) in environmental samples from Ny-Ålesund and London Island, Svalbard, the Arctic[J]. Chemosphere, 2015, 126: 40—46.
72 马新东, 王震, 那广水, 等. 多环芳烃在北极土壤、苔鲜和鹿粪中的分布特征[C]. 持久性有机污染物论坛暨第三届持久性有机污染物全国学术研讨会论文集, 北京, 2008.
73 JIAO L, ZHENG G J, MINH T B, et al. Persistent toxic substances in remote lake and coastal sediments from Svalbard, Norwegian Arctic: levels, sources and fluxes[J]. Environmental Pollution, 2009, 157: 1342—1351.
74 WANG Z, NA G, MA X, et al. Characterizing the distribution of selected PBDEs in soil, moss and reindeer dung at Ny-Ålesund of the Arctic[J]. Chemosphere, 2015, 137: 9—13.
75 WANG Z, MA X, NA G, et al. Correlations between physicochemical properties of PAHs and their distribution in soil, moss and reindeer dung at Ny-Åesund of the Arctic[J]. Environmental Pollution, 2009, 157: 3132—3136.
76 NA G, WEI W, ZHOU S, et al. Distribution characteristics and indicator significance of Dechloranes in multi-matrices at Ny-Ålesund in the Arctic[J]. Journal of Environmental Sciences, 2015, 28: 8—13.
77 袁林喜, 罗泓灏, 孙立广. 北极新奥尔松古海鸟粪土层识别[J]. 极地研究, 2007, 19(3): 181—193.
78 孙立广, 袁林喜. 北极的“后天”故事[J]. 科学, 2011, 63(5): 11—14.
79 YUAN L, SUN L, LONG N, et al. Seabirds colonized Ny-Ålesund, Svalbard, Arctic ~9,400 years ago[J]. Polar Biology, 2010, 33: 683—691.
80 YANG Z K, YUAN L X, WANG Y H, et al. Holocene climate change and anthropogenic activity records in Svalbard: a unique perspective based on Chinese research from Ny-Ålesund[J]. Adv Polar Sci, 2017, 28 (2): 81—90, doi: 10.13679/j.advps.2017.2.00081.
81 YUAN L, SUN L, WEI G, et al. 9,400 yr BP: the mortality of mollusk shell () at high Arctic is associated with a sudden cooling event[J]. Environmental Earth Sciences, 2011, 63: 1385—1393.
82 JIA N, SUN L, HE X, et al. Distributions and impact factors of antimony in topsoils and moss in Ny-Alesund, Arctic[J]. Environmental Pollution, 2012, 171: 72—77.
THE PROGRESS OF ECOSYSTEM AND ENVIRONMENT STUDIES NEAR CHINESE ARCTIC YELLOW RIVER STATION
He Jianfeng1,Li Chengsen2, Yao Yifeng2, Peng Fang3, Wang Nengfei4, Jin Haiyan5, Zhang Fang1, Ma Yuxin6, Zhang Qinhua7, Na Guangshui8, Sun Liguang9, Yuan Linxi9, Jia Nan9
(1SOA Key Laboratory for Polar Science, Polar Research Institute of China, Shanghai 200136, China;2Institute of Botany, The Chinese Academy of Sciences, Beijing 100093, China;3Wuhan University, Wuhan 430072, China;4The First Institute of Oceanography, SOA, Qingdao 266061, China;5The Second Institute of Oceanography, SOA, Hanzhou 310012, China;6Shanghai Ocean University, Shanghai 200433, China;7Research Center for Eco-Environmental Sciences, Chinese Academy of Sciences, Beijing 100085, China;8National Marine Environmental Monitoring Center, Dalian 110023, China;9University of Science and Technology of China, Hefei 230022, China;)
The Chinese Yellow River Station in Ny-Ålesund, Arctic Svalbard, is an ideal area for monitoring and studying the response of ecosystems to global change. Since its foundation in 2004, Chinese scientists have established a marine transect in Kongsfjorden and 11 terrestrial vegetation quadrats for monitoring, and projects on pollution and bird population evolution. Key research findings include: (1) species replacement is obvious in areas of glacial retreat, with mosses likewell reflecting variations in air temperature at the same period; (2) Bacterial strains have been isolated and 3 new genus and 21 new species have been discovered; (3) Kongsfjorden nanoplankton diversity is high, and during summer limited by surface-water nitrogen levels; (4) microalgae is highly adapted to temperature, and, by self-regulation, capable of adapting to environmental change; (5) tundra plants accumulate heavy metals, with atmospheric transmission the main pathway for persistent organic pollutant (POPs) population; and (6) since arriving in Ny-Ålesund 9 400 years ago, bird abundance has fluctuated with the maximum arriving 7 650 year ago. In the coming decades, the monitoring of marine transect and vegetaion quadrats shouldcontinue in order to know the trandency of population variations; meanwhile, combine the monitoring of atmosphere, glacier, plants and marine, carry out the study on atmosphere-ice-land-marine interation and form unique research feature.
Arctic, Yellow River Station, ecosystem, environment, study progress
2016年9月收到来稿, 2017年12月收到修改稿
南北极环境综合考察与评价专项(CHINARE2016-02-01, CHINARE2016-03-05)和国家自然科学基金(41476168)资助
何剑锋, 男, 1968年生。研究员, 主要从事极地生态环境监测与研究。E-mail: hejianfeng@pric.org.cn
10. 13679/j. jdyj. 20160048

