长链非编码RNA在系统性红斑狼疮和类风湿关节炎中的作用
王 忞,杨华夏,张 烜
系统性红斑狼疮(systemic lupus erythematosus,SLE)和类风湿关节炎(rheumatoid arthritis,RA)是自身免疫性疾病的经典代表,表观遗传学修饰在疾病发病机制中发挥重要作用。表观遗传学修饰是指不改变DNA序列但对遗传有可逆性潜在影响的遗传学改变,包括DNA甲基化、组蛋白修饰、微小RNA(microRNA)和长链非编码RNA(long non-coding RNA,lncRNA)的调控作用等,其中lncRNA是近期研究的热点[1]。LncRNA为长度超过200个核苷酸的非编码蛋白RNA[2],随着二代测序技术,尤其是RNA测序技术的进步,新的lncRNA不断被发现,但目前只有其中少数lncRNA的功能得到明确。传统的基因-mRNA-蛋白质-功能研究模式使lncRNA很容易被忽略,因此lncRNA在自身免疫疾病中的作用机制研究尚且不多[3]。本文对lncRNA在SLE和RA这两种常见自身免疫疾病中作用的研究进展,为进一步探讨表观遗传修饰在自身免疫性疾病发病机制中的作用提供依据和思路。
1 LncRNA的分类、功能和作用模式
依据NONCODE数据库可知,目前人类和小鼠中共有92 343和67 628个lncRNA基因,这一数目超过目前人类蛋白编码基因。因为lncRNAs数目众多,目前还没有完善的分类体系。根据基因组上与邻近蛋白编码基因的位置关系,lncRNAs可分为几类[4](表1)。
既往认为lncRNA可能是转录过程中的噪音,但是目前的研究证实lncRNA有许多重要但尚未阐明的生物功能,且目前只有少部分lncRNA的生物学功能被报道。研究提示,lncRNA能够影响基因寿命中的各个阶段,包括表观遗传调控、染色质重构、转录、转录后调控和蛋白代谢等。lncRNA可通过RNA-RNA、RNA-DNA、RNA-蛋白、RNA-染色质产生作用,发挥信号分子、诱饵分子、引导分子和骨架分子等不同的功能[5]。
LncRNA存在于细胞核和细胞质中,作用模式有所不同(图1)。多数lncRNA分布于细胞核中,通过以下两种模式发挥作用:一是结合调节染色质修饰和招募表观遗传修饰的酶或蛋白复合体调控基因的转录,如lnc RNA Xist[6];二是结合核内的转录因子调控基因转录,通过顺式或者反式元件发挥作用,如HOTTIP发挥顺式调控[7],NeST发挥反式调控[8]。此外,lncRNA在细胞核内可参与mRNA的选择性剪切,从而影响基因表达的转录后调控,如lncRNAMALAT1[9]。细胞质中的lncRNAs作用模式更为复杂,主要有以下三种:第一是竞争性内源性RNA(competitive endogenous RNA,ceRNA)模式,即lncRNA与内源性miRNA竞争性结合,从而释放靶mRNA并促进其翻译,充当“海绵”作用[10]。第二是结合STAU1蛋白通过ALU element结合其他mRNA 3′UTR促进其降解[11]。第三,lncRNA直接结合信号转导分子影响其蛋白修饰(如磷酸化),如lnc-DC与信号分子STAT3结合后阻止STAT3进一步与酪氨酸磷酸酶SHP1介导的去磷酸化,促进树突细胞成熟[12]。LncRNA在细胞核和细胞质中的作用见图1。
2 LncRNA与RA
2.1 RA中差异性表达的lncRNA
RA多为中小关节受累,表现为滑膜炎和骨侵蚀,发病机制包括多种免疫细胞、滑膜成纤维细胞、炎性细胞因子及抗体介导相关的免疫自稳的破坏。目前研究发现,RA患者体内有差异性表达的lncRNA如下:(1)LncRNA LOCl00652951和LOCl00506036:Lu等[14]研究发现,lncRNA LOCl00652951和LOCl00506036在RA患者外周血T淋巴细胞呈高表达,并通过靶向作用抑制其表达,证明LOCl00506036可以抑制活化T细胞核因子(neclear factor of activated T1 cells,NFAT1)去磷酸化和肿瘤坏死因子α(tumor necrosis factor-α,TNF-α)产生的鞘磷脂磷酸二酯酶(coleolipid phosphodies-terase 1,SMPD1)的表达,调节RA的免疫炎症反应。(2)LncRNAH19:RA滑膜中lncRNAH19的表达明显升高,外周血单核细胞表达升高,但在血浆中表达无显著差异[15-16]。(3)LncRNA Hotair:LncRNA Hotair是一种HOX转录反义RNA,在RA外周血单核细胞和血清外泌体中呈高表达,在破骨细胞和滑膜细胞的表达却明显降低。Hotair通过上调金属基质蛋白酶(metal matrix protease,MMP)-2、MMP-13活性而参与RA的发病[16]。(4)滑膜成纤维细胞中表达异常的lncRNA:LncRNA ENST00000483588在RA的成纤维样滑膜细胞中表达上调,而ENST00000438399、uc004afb.1和ENST00000452247表达下调[17]。(5)LncRNAC5Tl:位于RA易感基因TRAFl-C5 3′UTR区域,可能通过调控RA相关基因C5的表达促进疾病的发生[18]。综上所述,lncRNAs作为RA诊断的特异标志物的研究逐渐增多,但其在RA发病机制中的作用尚需进一步验证。
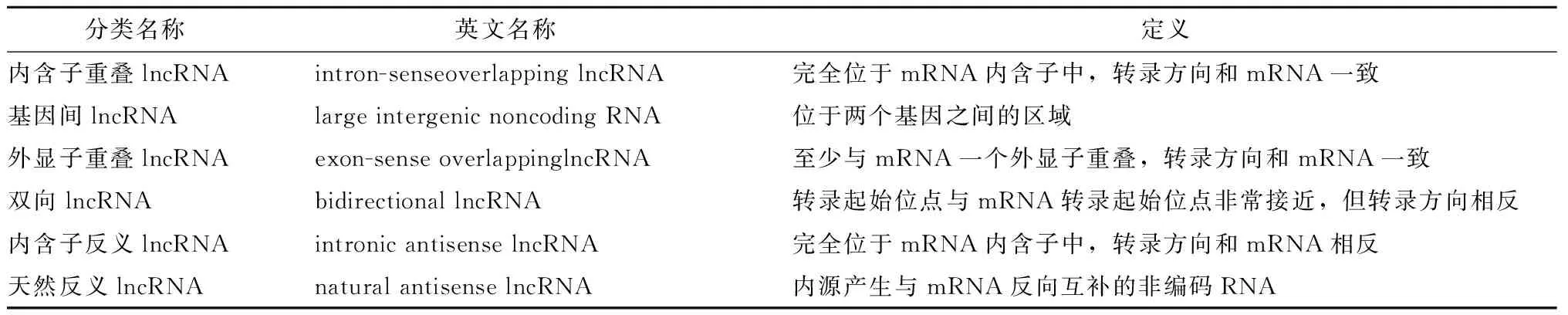
表1 lncRNAs分类[4]Table 1 Classification of lncRNAs[4]
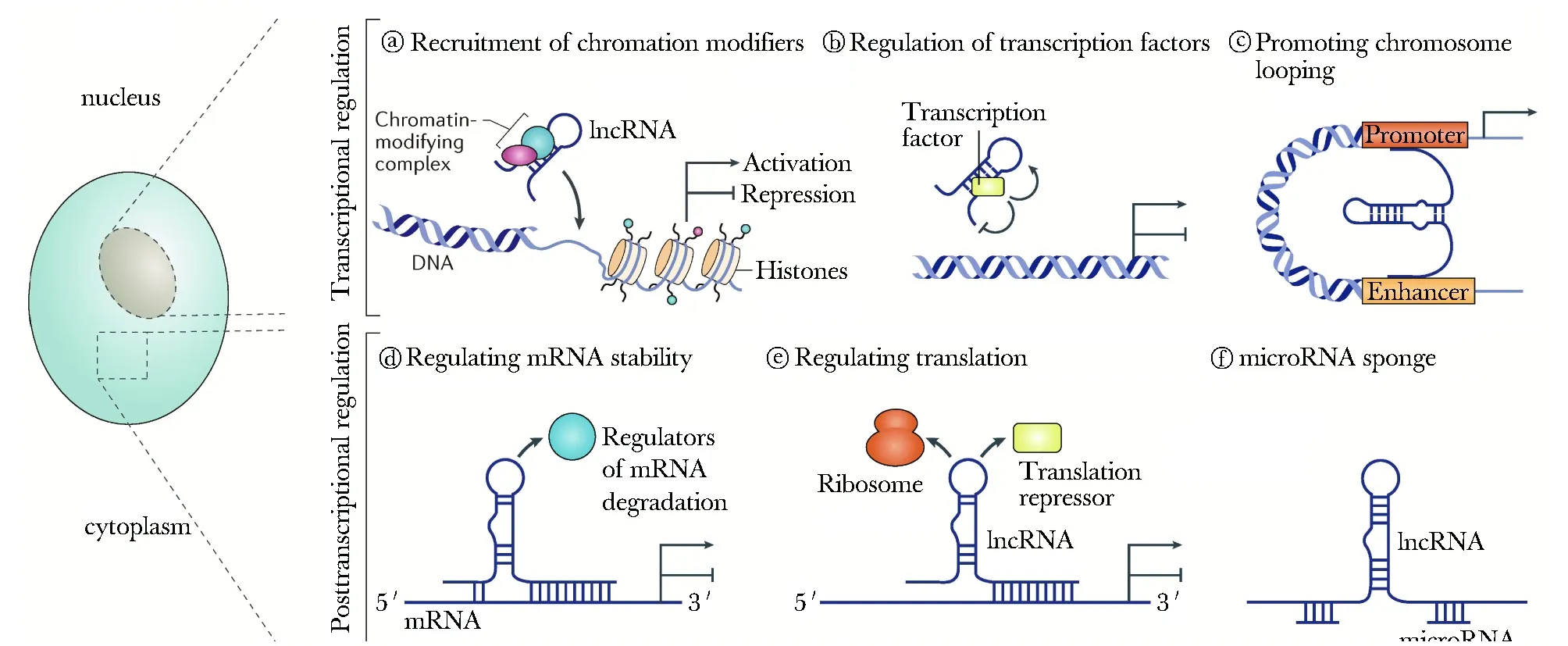
图 1 LncRNA在细胞核和胞质中的作用[13]Fig 1 Effects of lncRNA in nucleus and cytoplasm[13]
a:LncRNAs可通过调节染色质修饰和招募表观遗传修饰的酶调控基因的表达; b:LncRNAs可直接通过激活或者阻断DNA而结合或调控转录因子; c:增强子LncRNAs可以结合增强子和启动子区域的基因,形成环装结构增强基因的转录;LncRNAs在细胞质中的作用模式可参考d~f; d:LncRNAs通过招募一些影响mRNA降解的蛋白而调节mRNA的稳定性; e:LncRNAs可通过招募mRNA的靶向阻遏物而抑制mRNA翻译,或者通过与多核糖体互相作用促进mRNA翻译; f:LncRNAs作为miRNA的海绵体而抑制miRNA的功能
2.2 LncRNA在RA发病机制中的作用
参与RA关节炎症的重要信号通路包括核因子κB(nuclear factor-κB,NF-κB)通路、Toll样受体(Toll like receptors,TLRs)通路的活化及Th17/调节型T细胞(Treg)的失衡,从而导致免疫自稳的破坏(图2)[19],LncRNA在其过程中发挥重要的调控作用。
NF-κB信号通路通过上调白细胞介素(interleukin,IL)-1、IL-6、IL-17和TNF-α参与RA关节炎症、软骨破坏和滑膜增生等过程。lncRNA通过干扰NF-κB 上游信号及与NF-κB 或其转录物的相互作用而调控靶基因的表达[20]。 研究发现,甲氨蝶呤的作用机制之一是通过lincRNA-p21抑制T细胞中NF-κB通路的活化,从而起到抗炎作用[21]。环氧化酶2 lncRNA (cyclooxygenase-2 lncRNA,lncRNA-COX2)在受到细菌脂多糖(lipopolysaccharides,LPS)刺激后作为巨噬细胞NF-κB通路的激活因子通过SWI/SNF(switch/sucrose nonfermentable)介导的染色质重塑而形成lincRNA-COX2/SWI/SNF,调控巨噬细胞上晚期炎症基因的转录[22]。另一个lncRNA Lethe通过与NF-κB亚基RelA相互作用而抑制RelA DNA结合和靶基因活性,以负反馈的方式抑制巨噬细胞中氧化应激产物COX2的表达[23]。还有研究发现,在人原代上皮细胞和单核细胞-巨噬细胞系中,p50相关COX2交换RNA lncRNA(p50-assisted COX-2 exchange RNA lncRNA,lncRNA PACER) 与NF-κB的抑制性转录因子p50相结合,抑制复合物p50/p50二聚体转化成p50/p65二聚体,从而促进COX-2的表达[24]。
除NF-κB信号通路外,TLR信号通路与RA的发病也密切相关。TLR信号通过抑制RA患者单核细胞、巨噬细胞和滑膜细胞中的TLR-2与TLR-4通路的接头蛋白MYD88而有效抑制TNF-α、IL-6和MMPs的表达[25]。一些lncRNA对于TLRs信号通路有调控作用,研究发现,Pam3CSK4刺激小鼠骨髓源性巨噬细胞的TLR-2通路后可敲低lncRNA-COX2,降低促炎症因子(如IL-6、IL-23等)的表达[22,26]。还有研究发现,人单核/巨噬细胞株THP-1用TLR2激动剂刺激后,LncRNA THRIL形成RNA-蛋白复合物并调节TNF-α启动子区域,负性调控TNF-α的表达。敲低lncRNA THRIL的表达可明显抑制患者体内炎症因子TNF-α和IL-6的产生[27]。研究表明炎症细胞因子TNF-α和IL-6可以引起RA患者成纤维样滑膜细胞(fibroblast likesynoviocytes,FLS)蛋白酪氨酸磷酸化程度增加,增强FLS的炎症反应,在RA的病理过程中起重要作用[28]。
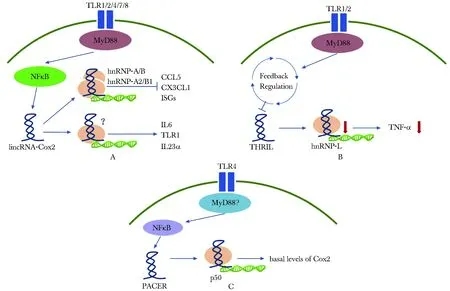
图 2 LncRNAs在TLRs通路中的作用机制[19]Fig 2 Machanism of LncRNAs in RLRs signal pathway[19]
目前研究发现,一些lncRNA通过竞争性抑制miRNA与靶基因的结合,参与调控炎症因子和信号通路的异常表达。Xu等[29]研究发现,母系表达基因3 lncRNA (maternal expression gene 3 lncRNA,lncRNAMEG3)在骨关节炎的关节软骨中表达明显下调,在IL-1β诱导的软骨细胞中通过相互竞争而抑制miR-16和miR-16靶基因SMAD7的表达,参与抗增生和凋亡相关的炎症反应。另有研究发现,血小板减少性紫癜患者外周血CD4+T细胞中的lncRNAMEG3通过调控miR-125a的表达而上调FoxP3的表达,下调Th17的表达[30]。目前虽然没有关于lncRNA MEG3在RA中的研究报道,但已明确lncRNA MEG3调控的这两个miRNAs在RA患者外周血中都异常升高[31]。 miR-16及其参与调控的IL-1β炎症因子和miR-125及其参与调控的Th17/Treg通路都是RA发病机制中重要的信号通路[32],因此推测lncRNA MEG3在RA的发生和进展过程中参与疾病重要通路的调控。此外,还有很多lncRNAs参与相应靶基因的调控,在RA发病机制中的作用仍需深入探索。
3 LncRNA 与SLE
3.1 SLE患者差异表达的lncRNAs
SLE是一类多系统受累的自身免疫性疾病,主要累及育龄妇女,临床表型丰富且患者血中存在多种多样的自身抗体以及异常活化的免疫细胞。SLE发病机制复杂,涉及遗传、表观遗传、雌激素水平变化和环境因素等。当受到环境因素如阳光、药物或感染的刺激时,SLE患者的遗传易感性可能被激活[33]。目前关于LncRNA与SLE关系的研究尚不多,研究发现与SLE相关的LncRNA如下:(1)生长阻滞特异性转录因子5(growth-arrest-specific transcript 5, GAS5)LncRNA:在BXSB自发性狼疮小鼠模型中证实,LncRNA GAS5与疾病的易感性有关,GAS5启动子区具有多样性,Sp1蛋白结合位点的缺失导致GAS5表达下调,抑制细胞进入凋亡途径,从而导致自身抗原暴露,产生自身抗体[34]。SLE患者的CD4+T细胞和B细胞中GAS5表达水平均下调[35]。研究提示,GAS5能竞争性地结合糖皮质激素受体的启动子区域的效应元件,诱导糖皮质激素离开受体结合位点,从而抑制受体功能[36]。(2)Linc0949:研究提示,Linc0949的表达与SLE的临床活动度和SLE肾炎有关,患者得到治疗后Linc0949表达明显回升,提示Linc0949可能是SLE的新型诊断标志物[37]。(3)核富含丰富的转录本1(NEAT1):研究发现NEAT1与SLE临床表现的严重程度呈正相关,其通过激活MAPK通路而引起TLR4介导的免疫炎症[38]。(4)血浆中异常表达的LncRNA:可通过实时荧光定量PCR筛选出LncRNA、GAS5、linc0949、linc0597、HOTAIRM1和Lnc-DC在SLE中的异常表达,实验研究提示,SLE中GAS5和 Lnc-DC呈低表达,linc0597则为高表达,且Lnc-DC与SLE肾炎明显相关[39]。
3.2 LncRNA在SLE发病机制中的作用
肌醇磷脂3-激酶(phosphoinositide 3-kinase,PI3K)信号通路和I型干扰素(type I interferon,IFN-I)在SLE发病过程中发挥重要作用[40]。同源性磷酸酶-张力蛋白(phosphatase and tensin homologue,PTEN)负性调节PI3K/Akt通路,参与SLE中B细胞的过度活化和障碍的清除。少数lncRNA以竞争性抑制miRNA的方式与PTEN结合,从而抑制过度活化的PI3K信号通路。LncRNA-GAS5通过抑制子宫内膜癌细胞中miR-103与PTEN的结合而诱导PTEN的表达[41],或通过下调宫颈α癌细胞中的miR-205而抑制肿瘤的发生[42],也可通过调节miR-21/PTEN轴而影响化疗药物对非小细胞肺癌治疗的敏感性[43]。目前参与调控PTEN的lncRNA尚未在SLE中得到确认。还有研究发现,浆细胞样树突细胞(plasmacytoid dendritic cells, pDC)可诱导α干扰素(inferon α,IFN-α)的产生,后者对SLE中Th1细胞的作用进行调控,如抑制Treg的分化,促进滤泡辅助T细胞的发育,也可促进B细胞活化和抗体的分泌[44]。目前SLE与IFN-α相关的LncRNA尚未被证实,但有研究证实,病毒性肝炎的肝脏中单磷酸胞苷激酶2 LncRNA(cytidine monophosphate kinase 2,LncRNA CMPK2)呈高表达,并通过JAK-STAT通路影响IFN-α的抗病毒功能[45],推测可能有LncRNA通过调控IFN-α参与SLE的发病机制。
4 lncRNA在自身免疫性疾病中作用研究展望
已有许多研究证实lncRNA参与免疫应答,在炎性免疫反应中作为调控因子发挥重要作用。lncRNA广泛参与细胞发育过程,具有细胞特异性、组织特异性和时空特异性,因此可以作为疾病诊断的标志物或者治疗的潜在靶点。但其在组织中的特异性和保守性低,因此深入研究其作用机制存在一定的难度。目前对于lncRNA在自身免疫性疾病中作用的研究多局限于利用高通量测序技术以找到差异表达的lncRNAs,但对于其在细胞中的定位以及细胞表型和作用机制研究不多,今后还需要将lncRNA结合自身免疫性疾病的发病机制进行深入研究,以探索表观遗传在自身免疫性疾病中的作用,为寻找疾病诊断和治疗新靶点提供依据。

