小鼠腺胃常规显微制片的技术优化
苏 璐 秦鹏蕊 郑 翔△
(四川大学, 1 华西公共卫生学院, 2 华西基础医学与法医学院, 成都 610041)
基于石蜡制片和H-E染色的常规显微制片技术在临床病理诊断及基础医学的教学科研中应用十分广泛。高质量的显微切片应能最大程度维持组织的形态,做到切片完整,厚度均匀,无显著人工假象,染色对比清晰等[1]。要想从根本上提高制片质量,须依靠技术方法的标准化和制片条件的优化。以小鼠腺胃常规制片为例。小鼠的腺胃与人类的胃在层次结构和组织学特点上近似[2],常用于教学和科研观察。但小鼠胃制片时常见腺体结构不完整、标本显微结构不清晰、收缩较严重以及平滑肌层过度分离等人工假像。针对这些问题,本实验通过比较不同种类固定液的固定效果、改变pH值、渗透压等条件,确定小鼠胃最佳固定液配方;此外,对于胃不同取材部位,处死后取材延搁时间以及胃排空前后状态等制作条件下小鼠胃显微形态结构进行比较;减轻了胃显微制片中常见的人工假象,优化了制片流程。对于其他标本的显微制片具有普遍的借鉴意义。
1 材料和方法
1.1 实验动物
健康雄性昆明(KM)小鼠32只,2月龄,体质量30g±3.6g,由四川大学实验动物中心提供。
1.2 实验设计
实验分7轮进行,每轮针对与制片质量密切相关的1个条件进行比较。动物取材分组如表1。
1.3 固定液
配制标准Zamboni(多聚甲醛20g,Na2HPO4·12H2O 3.74g,NaH2PO4·2H2O 45g,饱和苦味酸150ml,pH 7.3,定容到1000ml[3])、AAF(醋酸: 85%乙醇: 40%甲醛按体积比1∶2∶17混合[4])和中性缓冲甲醛NBF(本实验配方为多聚甲醛40g,Na2HPO4·12H2O 20g,NaOH 4g,pH 7.2,定容到1000ml[4])3种常用固定液。以NBF为基础,渗透压不变,调整磷酸盐用量,配制pH为7.2(原配方)、7.0和6.5的固定液。固定pH为7.0(根据后续结果确定),调整缓冲盐用量,配制渗透压1.2、1(即原液)、0.7和0.4倍的NBF固定液。
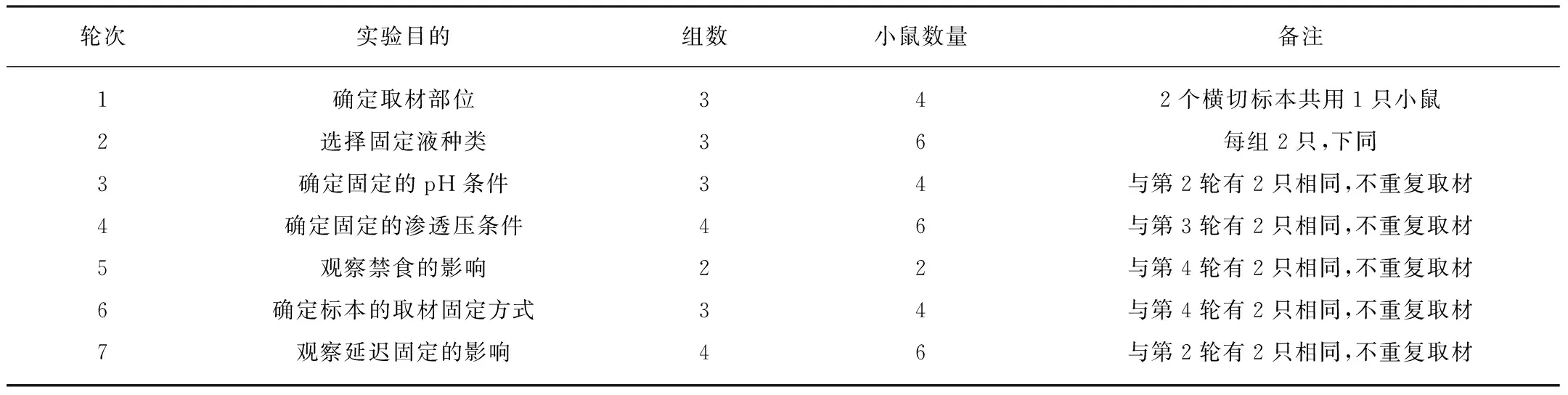
表1 小鼠腺胃显微制片条件优化实验的设计
1.4 组织材料处理
小鼠禁食4h后,10%水合氯醛(0.004ml/g)腹腔注射麻醉,分别取近幽门部(距幽门3mm)横切、胃中段(近前胃-腺胃分界处2mm)横切、胃大弯正中纵切3种方位的标本进行首轮实验。第5轮实验中,2只小鼠禁食4h,给予食物并观察开始进食后20min麻醉取材。第6轮实验中,采用3种固定方式: 整体固定后切开、切开固定(原来的方式)和局部开窗(切开前胃局部,注入固定液再浸泡)固定。第7轮实验中,胃组织分别在小鼠死亡(呼吸心跳停止,不从尸体分离)后0、0.5、1、2h(室温约25℃)开始固定,固定条件均为4℃,16h。按四氢呋喃法[5]常规石蜡包埋,6μm切片,H-E染色。
1.5 显微观察和分析
染色切片通过Olympus BX41显微镜观察,经定制转接筒连接Olympus C5060wz相机拍摄。显微形态比较时,各组2个标本的观察结果一致为有效。切片核质区分度的分析通过Image Pro Plus 5.5进行: 每组2个标本,各取3个视野,分别自动选取胞核、胞质区域,测定透光强度(intensity)的值进行比较。
2 结果
2.1 腺胃前部横切获得的结构相对更完整和典型
腺胃3种断面的形态比较如图1A~C。其中,腺胃前部(距分界线2mm)横切面上,胃壁层次清晰完整,胃底腺结构相对典型,腺管呈纵切面,腺内主细胞、壁细胞排列清晰可辨(图1A)。在近幽门部的横切面,胃壁层次也清晰可辨,但有较多胃底腺被斜切;该断面上腺管细而短,结构差异大且不典型,主细胞与壁细胞排列不规律(图1B)。胃大弯正中纵切面不能稳定呈现清晰的胃壁层次,黏膜皱襞大多呈现斜行或横断面,腺体长度因黏膜褶皱而变化较大,不利于观察腺体的完整结构(图1C)。
2.2 NBF和Zamboni固定液效果相当,制片结果均优于AAF
取3种标准配方固定液处理的腺胃前部横切片比较。其中,NBF(图2A)和Zamboni(图2B)固定液处理后,标本染色结果清晰,结构细节保存良好。Zamboni液处理的标本壁细胞着色更强(伊红染色更红),但主细胞嗜碱性区域的区分度欠佳。NBF液不造成收缩。AAF固定液也不造成收缩,但伊红染色强度显著下降,胞质呈均质状,细节不清,各腺细胞间分界也不清楚(图2C)。
2.3 固定液pH和切片H-E染色的红蓝对比负相关
pH 6.5、7.0和7.2的标准NBF固定液处理的标本,其切片的H-E染色结构均显示清晰。显微图像分析显示,随pH升高,核质着色的光强度对比值有下降趋势(图3)。由于酸性甲醛不利于长时间处理和储备,且染色区分度并无优势,故综合考虑,小鼠腺胃以pH 7.0的配方为佳。

图3 固定液不同pH对H-E染色核质区分度的影响
2.4 NBF渗透压在标准配方0.7倍时显微结构的保存质量最佳
取pH 7.0、相对标准配方的渗透压为1.2、1、0.7倍和0.4倍的改变型NBF,比较固定效果。其中,0.7倍渗透压的NBF造成的收缩、变形或结构松散最小(图4B);1.2倍渗透压会造成显著的细胞收缩(图4A);而0.4倍则同样造成一定的收缩,且细胞质和胞外基质均松散,伊红着色能力下降(图4C)。故对于小鼠腺胃,渗透压0.7倍于标准配方的条件最理想。
2.5 禁食小鼠的胃黏膜维持自然形态
摄入食物后,小鼠胃底腺主细胞的嗜酸性区域着色显著减弱,呈空虚状态,细胞略有变形(图5A)。禁食后胃底腺各细胞保持饱满和良好的着色(图5B)。取材前禁食有利于提高图像质量。
2.6 开窗固定条件下胃壁结构变形最小
胃整体固定后切开,黏膜结构细节特别是主细胞显示不清,结构收缩,表面黏液细胞着色较差(6A)。切开后固定,黏膜被收缩的平滑肌牵拉,胃壁弯曲方向改变甚至反转,黏膜表面结构离散变形(6B)。开窗固定不存在这些人工假象(图6C),为最佳固定方式。
2.7 小鼠死亡后2h内,延迟取材对光镜结构的影响有限,但着色减弱
观察小鼠死亡后0、0.5、1h和2h的胃切片,光镜下各时间点并无显著的结构区别。随取材时间延迟,切片上细胞各成分H-E染色的着色强度较立即固定的标本减弱(苏木素和伊红着色均受影响,图7A、B)。
3 讨论
本实验对小鼠腺胃常规显微制片条件进行了优化探索。经过针对性的实验比较,总结出较好的制片技术条件: 小鼠禁食4h后,麻醉并手术分离整个胃;从前胃局部开窗,注入渗透压650mOsm/L(相当于标准配方0.7倍)、pH 7.0的NBF,并用该液继续在4℃浸泡固定16h;固定后切取距前胃-腺胃分界线2mm的腺胃组织行常规石蜡切片、H-E染色。按该流程操作,镜下形态自然、结构成像清晰,人工假象相对最少。

图1 小鼠腺胃不同切片部位和方向的形态比较,标尺=100μm。A: 距腺胃-前胃分界约2mm处横切面;B: 距幽门约2mm处横切面;C: 胃大弯正中横切面.图2 小鼠腺胃经3种常用甲醛固定液处理后的H-E染色结果比较,标尺=50μm。A: 中性缓冲甲醛(NBF)固定;B: Zamboni液固定;C: 醋酸-乙醇-甲醛液(AAF)固定;↑: 示胃底腺主细胞.图4 固定液不同的渗透压(缓冲盐浓度)对小鼠腺胃结构的影响,标尺=50μm。A: 1.2倍;B: 0.7倍;C: 0.4倍;△: 示收缩产生的空隙;↑: 示细胞质和细胞外基质的结构松散.图5 小鼠摄食与禁食后腺胃结构比较,标尺=50μm。A: 摄食后取材;B: 禁食4h取材;“↑”示胃底腺主细胞.图6 不同取材固定方式对腺胃形态的影响,A: 标尺=50μm;B,C: 标尺=100μm。A: 整体固定后再切开;B: 切开固定;C: 经前胃开窗固定;△: 示收缩产生的空隙;*: 示着色不良的表面黏液细胞;↑: 示胃底腺主细胞.图7 立即取材和延迟取材的染色结果比较,2组切片系同时染色,标尺=50μm。A: 处死后立即取材;B: 处死2h取材.
在比较技术条件时,固定液配方的种类是首先比较的项目。不同的标本应采用最适的配方进行处理。通常,成年哺乳动物标本可在中性缓冲甲醛(NBF)、缓冲甲醛—苦味酸(Zamboni)[3]和乙酸—乙醇—甲醛(AAF)[4]中比较择优。本实验中,NBF和Zamboni对小鼠腺胃的固定效果远优于AAF,总体上都达到优良质量。但胃底腺主细胞的嗜碱性区经Zamboni液处理后,与嗜酸性区的区分不如NBF清晰(处理胰外分泌部标本时也存在该问题),故NBF应作为首选。
选定最佳固定液种类后,pH值的实验比较应先于渗透压实验。因为不同渗透压的固定液在pH改变时,红蓝对比的变化幅度不同(本文未显示该数据)。先在标准渗透压下确定理想的pH,再比较不同的渗透压,结果更可靠。本实验未设pH超过7.2的条件,因为此时固定作用缓慢,日常实验不常用。本实验得出小鼠腺胃标本的理想渗透压为标准配方的70%。NBF标准配方的渗透压约为940mOsm/L[4],故本实验的最佳渗透压数值约为650mOsm/L。高渗和低渗条件都会造成标本收缩。其中,高渗固定液使标本在固定环节发生收缩,细胞间隙拉大;而低渗造成的收缩产生在固定后、浸蜡前的脱水环节,以细胞质结构松散、胞外基质紊乱为主要表现。
大动物的胃可采用切开注入固定液再缝合的方法固定[6]。小鼠胃太小,为保全腺胃结构,从前胃开窗注入固定液,既不会因平滑肌受刺激收缩造成人工假象,也可轻松完成操作。动物死亡后多久取材固定才不影响显微结构的观察,是形态学实验中最常提出的问题之一。由于胃分泌消化酶和酸,一般认为应优先尽快固定,否则易发生溶解和损伤。本实验中,胃不从尸体分离的情况下延迟至2h固定,光镜观察仍不能区分出显著的结构变化,同时染色的情况下仅有组织着色偏浅这一变化(加长染色时间可克服)。因此,在显微水平的实验中,胃的取材、固定并不急迫,不需提高取材次序的优先级别。
本实验虽以小鼠腺胃显微制片为例,但技术优化所采用的实验流程可以应用到其他标本的制片工作中。先比较取材部位(如分叶、分区、切片的横纵方向等),然后选择最佳固定液,再优化固定条件(pH、渗透压等),最后优化取材条件(如充盈、空虚,如为免疫器官还要考虑率免疫状态)和确定允许的延迟取材时间。这一实验方法对提高制片质量有普遍意义。针对其他组织,如果筛选出的最佳固定液是AAF(如睾丸),则应分别对甲醛、醋酸和乙醇的不同体积配比进行实验比较;如果为含苦味酸的固定液,则应比较甲醛和苦味酸以不同配比组合后的固定效果。除非组织质地特殊,NBF一般不需调整甲醛含量(恒定4%),否则会影响后续免疫组织化学等分子原位检测操作中已经成熟的技术条件。
综上,组织标本的常规显微制片虽然属于历史悠久的传统技术,但要稳定地制作出高质量的切片,还是离不开科学的实验和探索。本实验虽仅涉及小鼠腺胃制片,但其他标本的制片都应进行类似的试验比较,方可确知最佳的制片条件。希望本实验对常规显微制片工作有抛砖引玉的作用。
——2017年渗透压相关高考真题赏析