超选择性肾动脉栓塞在腹腔镜下零缺血肾癌肾部分切除术中的应用∗
干思舜 王 磊 叶剑青 田毅君 曲发军 储传敏 杨 炜 崔心刚
(第二军医大学第三附属医院泌尿外科,上海 201805)
肾细胞癌是泌尿生殖系统第三大恶性肿瘤[1]。腹腔镜下肾部分切除术(laparoscopic partial nephrectomy,LPN)已被公认为cT1期肾癌外科治疗的参考标准[2]。LPN在保留部分肾单位的同时,肿瘤学疗效与根治性肾切除术无明显差异,目前在国内外得到较广泛应用[3],在处理较大肾肿瘤时需要有较长的热缺血时间,手术并发症发生率较高。随着手术技术和外科辅助器械的不断发展和进步,LPN的应用范围逐渐扩大。为探讨一种不需要阻断的LPN方法,2015年11月~2016年9月我们采用数字减影血管造影(digital subtraction angiography,DSA)术前超选择性肾动脉栓塞术联合腹腔镜下零缺血肾部分切除术治疗13例临床T1期肾癌,取得较好的效果,报道如下。
1 临床资料与方法
1.1 一般资料
本研究经医院伦理委员会批准(批文号:2014SL023),所有患者均签署知情同意书。病例选择标准:肾脏肿瘤4~7 cm,无局部淋巴结、血管及远处转移病灶,功能性孤立肾或合并可引起肾脏功能减退的基础疾病(如原发性高血压、糖尿病、慢性肾病等)者优先,可耐受手术风险,依从性好,术后可随访1年以上。
本组13例,男8例,女5例。年龄36~78岁,平均52岁。13例均为体检发现,无明显腰痛、血尿症状。肿瘤位于右侧5例,左侧8例。肿瘤分期T1N0M0,肿瘤直径4.0~6.5 cm,平均5.2 cm。7例为外生型生长,6例为内生性生长。R.E.N.A.L评分7~9分。无淋巴结、肾静脉或下腔静脉癌栓及远处转移。术前常规CTA检查显示供应肿瘤的分支血管情况,测定双肾肾小球滤过率(glomerular filtration rate,GFR),7例患肾GFR低于正常,(45.15±11.44)ml/min[我院正常值:男性为(125±15)ml/min,女性低10%]。2例功能性孤立肾,3例合并糖尿病,4例合并高血压肾病。
1.2 方法
1.2.1 栓塞方法 术前常规肾脏CT明确肿瘤大小及位置(图1)。术前1~15 h患者在同一位有经验的介入科医师的操作下完成术前栓塞。取平卧位,皮肤消毒铺巾。2%利多卡因局麻后,应用Seldinger技术穿刺右侧股动脉,置入F5导管鞘,应用Yashiro导管行肾动脉造影,造影总量15 ml,速度3 ml/s,造影见肾肿瘤染色影(图2),超选至肿瘤供血动脉,应用碘油及明胶海绵颗粒(100~300 μm)对肿瘤栓塞,再次行肾动脉造影确认栓塞效果(图3),压迫穿刺处。
1.2.2 手术方法 全麻后取健侧卧位。于腋中线髂嵴上做2 cm切口,手指分离进入腹膜后间隙,置入自制气囊充气约800 ml,手指引导下在腋后线第12肋下置入12 mm trocar 1枚,腋前线与髂嵴和肋缘下交点处各置入10 mm trocar 1枚,髂嵴上切口置入trocar及观察镜。气腹压力维持在15 mm Hg(1 mm Hg=0.133 kPa)。清除腹膜外脂肪,完全显露肾周筋膜,纵行切开肾周筋膜,为安全起见,于肾脏背侧与腰大肌之间游离肾门,找到肾动脉后并充分游离(备用),清除肾周脂肪,暴露肾脏肿瘤,距离肾肿瘤边缘0.5 cm开始切除肿瘤,可见明显的水肿带,甚至坏死组织,辨认界线,避免切破瘤体,直至完整切除肿瘤,损伤的肾盂及深面的血管断端仔细缝合,然后外层缝合肾脏创面。如果在切除肿瘤或缝合过程中出血较多而影响手术视野或手术安全,可将肾动脉临时阻断;创面彻底止血后留置负压引流管1根,取出标本送病理,拔除trocar ,逐一缝合切口。
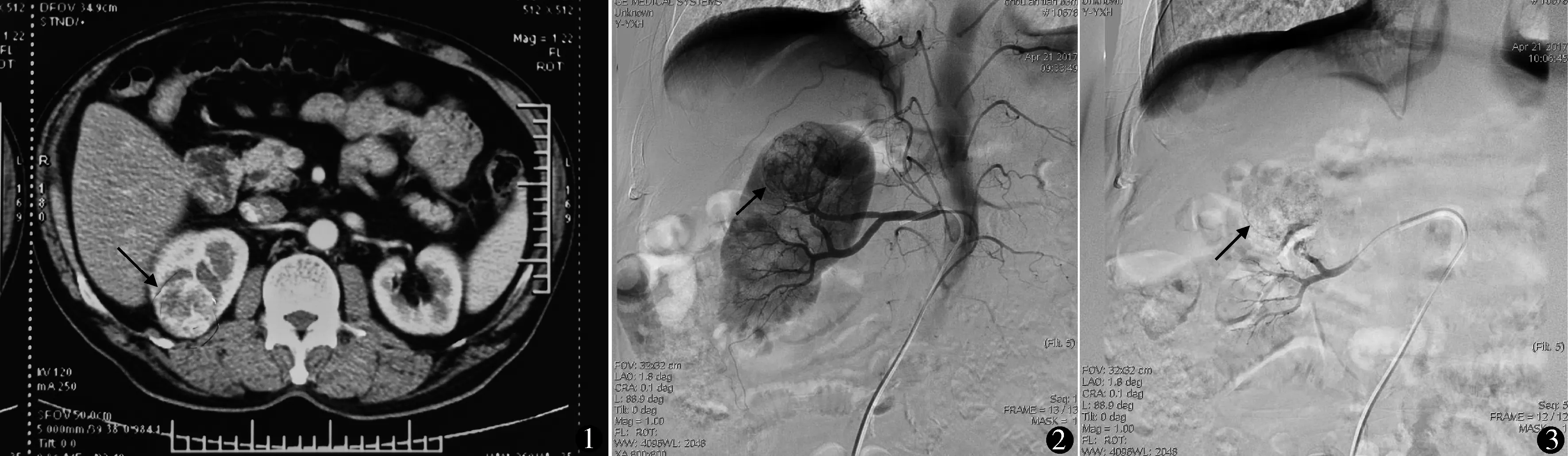
图1 男,58岁,术前CT示右肾肿瘤4.4 cm 图2 栓塞前肾动脉造影肿瘤染色 图3 栓塞后超选动脉造影肿瘤无染色
1.3 随访
术后1个月进行第1次随访,行GFR、血常规和生化检查。术后每3个月复查1次肌酐、腹部B超、胸片、腹部CT等。
2 结果
将肿瘤栓塞范围分为0、1、2分[4](0分:栓塞范围未完全覆盖肿瘤;1分栓塞范围刚好覆盖肿瘤;2分:栓塞范围超过肿瘤的20%),本组0分3例,1分8例,2分2例。栓塞后虽然变换手术体位(侧卧位),但无出血、感染及非定向栓塞等相关并发症的发生。13例均在腹腔镜下完成手术,无中转开放手术。2例因术中出血较多行肾动脉主干暂时性阻断,阻断时间分别为8、12.5 min, 其余11例均按预期顺利完成手术,无输血。平均手术时间82 min(48~125 min),平均出血量130 ml(40~260 ml)。无切缘阳性。平均住院时间 8 d(6~11 d)。术后病理均为肾透明细胞癌。13例术后平均随访14.5月(12~18个月),术后3、6、12个月患肾GFR分别为(42.36±7.60)、(43.08±8.10)、(43.46±8.20)ml/min,均未见肿瘤复发和(或)转移。
3 讨论
DSA栓塞术是一种经由浅表动脉入路将导管漂浮至靶血管,进行造影和栓塞的一门辅助技术,广泛地用于临床疾病的诊断和治疗,除有潜在的心脑血管意外等风险外,还可以出现感染、动脉瘤形成、腹股沟血肿以及非定向栓塞引起的其他器官功能障碍甚至坏死等并发症。随着微创介入技术的不断发展,严重的并发症已经非常罕见,肾动脉栓塞术已经成为一种安全的辅助检查及治疗方法,已被欧洲泌尿外科学会(European Association of Urology)推荐作为有严重血尿及腰痛的不能耐受手术的肾肿瘤的一种姑息性治疗手段。除此之外,超选择性肾动脉栓塞还广泛应用于肾部分切除术后严重出血(假性动脉瘤或动静脉瘘)等并发症的处理。术前超选择性肾动脉栓塞术最早由Gallucci等[5]描述,是肾部分切除术中不需要阻断肾动脉的一种选择。Rais-Bahrami等[6]回顾性分析126例和264例LPN接受零缺血和肾门血管阻断处理的差异,他们首先按照肿瘤大小分期(T1a、T1b、T2),然后分别从手术时间、出血量、住院时间、是否输血、术后并发症及切缘阳性率几个方面进行分层分析,结果显示零缺血组并发症发生率明显低于肾门血管阻断组(P<0.01),因此,他们认为LPN零缺血比传统夹子更有利于患者的康复。
目前,临床工作中也应用一些其他零缺血肾部分切除方法,如常规无阻断、预缝线法,但这些方法仅适合体积较小、位置较表浅的肾肿瘤,并仅适于经验较为丰富的术者,处理R.E.N.A.L评分较高的肾肿瘤会造成术中出血量大、切除缝合困难。此外,Gill等[7,8]首次开展阶段性肾动脉阻断肾部分切除术,与完全阻断肾动脉主干的方法不同,这种术式阶段性阻断第3或4级肾动脉分支,避免整个肾脏的缺血-再灌注损伤。殷长军等[9~11]也较早开展了这种术式,与超选择性肾动脉栓塞后肾部分切除术有相似的原理,但超选择性肾动脉栓塞法可阻断供应肿瘤的微小动脉,阶段性肾动脉阻断常只能阻断肾段动脉一级的肿瘤供血动脉,肾实质的缺血范围较超选择性肾动脉栓塞大。此外,在临床实际应用中,许多肾肿瘤常由多支动脉供血或难以判断供血动脉而无法应用阶段性肾动脉阻断法,同时阶段性肾动脉分离的手术难度给临床推广带来一定难度。
对于DSA超选择性肾动脉栓塞后腹腔镜零缺血肾癌肾部分切除术我们有以下经验。①DSA栓塞的时机和范围:为减少手术区域的水肿范围和组织坏死程度,我们一般选择术前1~15 h进行栓塞,间接降低手术的操作难度。由于肿瘤的大小和位置不同,血管造影有时并不能发现明确的肿瘤营养动脉,此时容易出现栓塞范围过小或过大,如果栓塞范围过小致血管阻断不完全,术中出血较多,必须保证视野的清晰,不可勉强操作致肿瘤破裂、切缘阳性,必要时可行肾动脉暂时阻断后再切除肿瘤,这种情况下肾动脉主干阻断时间也会大大缩短。栓塞范围过大会损伤过多的正常肾单位,我们建议尽量不要超过肿瘤范围的20%,否则手术获益无优势。②手术操作过程风险:DSA超选择性栓塞后1~15 h体表动脉穿刺点一般都在加压包扎中,加压包扎环带不能覆盖手术区域,在改变患者体位时需要防止动脉固定器的脱落引起动脉瘤或大出血;肿瘤栓塞后周围都会出现水肿带,导致组织脆性增加、界线模糊,因而在切除肿瘤过程中避免紧贴肿瘤包膜,否则界线不清瘤体容易破裂,切缘阳性率增加。③降低出血风险:与传统肾动脉主干阻断后肾部分切除术相比,DSA超选择性肾动脉栓塞后零缺血理论上无操作时间限制,但创面渗血会增加,术中可联合麻醉师行控制性降压以降低出血量;对于一些可见的血管残端可以使用小血管夹和双极电凝止血,减少创面活动性出血。
这种手术方式也存在一些不足。①选择性动脉栓塞术对LPN是一种有效控制术中出血的方法,但约有20%的病例不能成功栓塞动脉,与RENAL评分负相关,特别是面对较大且内生性的肿瘤,使用DSA超选择性栓塞肿瘤供应动脉需要更多的理论支持[4]。②超选择性动脉栓塞和控制性降压对于静脉回流的阻断影响肿瘤的切除,经常需要临时提高气腹的压力。③超选择性动脉栓塞术可以导致手术区域的水肿和坏疽,给正确辨别正常组织和肿瘤组织带来难度,需要时刻警惕,否则肿瘤容易破裂,切缘阳性率会增加,对于初学者来说要保证距离瘤体充足的切缘。
DSA超选择性栓塞在腹腔镜下零缺血肾部分切除术具有最大限度保护肾功能的优势[12],我们认为T1期肾癌术前DSA超选择性肾动脉栓塞后行腹腔镜下无阻断肾部分切除术是安全可行的,对于肾细胞癌合并孤立肾、肾功能不全以及有肾功能下降潜在风险的患者是较好的选择。随着栓塞技术的不断发展和出血风险的进一步控制,此术式具有良好的临床应用前景。同时,对于一些初学LPN的临床医师,在避免大出血的情况下可降低他们手术操作时间的紧迫感,缩短学习曲线。

