胃饥饿素对鱼类摄食调控的研究进展
张 鑫 齐锦雯 唐 妮 陈德芳 李志琼
(四川农业大学动物科技学院,成都611130)
摄食可维持动物机体的稳定,促进动物生长[1]。摄食主要通过中枢摄食系统和外周摄食系统的增食欲及厌食欲因子(神经肽、单胺类、胃肠肽和激素等)互作进行调控[2]。胃饥饿素(Ghrelin),又称作生长激素释放肽(growth-hormone-releasing peptide),是机体内重要的增食欲因子之一[3]。1999年,日本学者Kojima等[3]在大鼠上鉴定出含28个氨基酸的多肽,能刺激生长激素(GH)的释放,故将此多肽命名为生长激素释放肽,进一步通过组织表达分析发现其在胃和下丘脑中存在。随后,2000年Wajnrajch等[4]在人的胃和下丘脑处检测到Ghrelin的表达,因此认为Ghrelin是一种脑肠肽[3]。除大鼠和人外,Ghrelin在其他哺乳动物[5-7]中也已鉴定存在。Ghrelin作为增食欲因子,在鱼类摄食相关领域中已成为研究热点之一。为此,本文着重阐述Ghrelin对鱼类摄食的调控及其机制,以期为鱼类摄食调控及生长的研究和生产实践提供理论依据。
1 Ghrelin的结构
1.1 Ghrelin的基因结构

1.2 Ghrelin的蛋白质结构

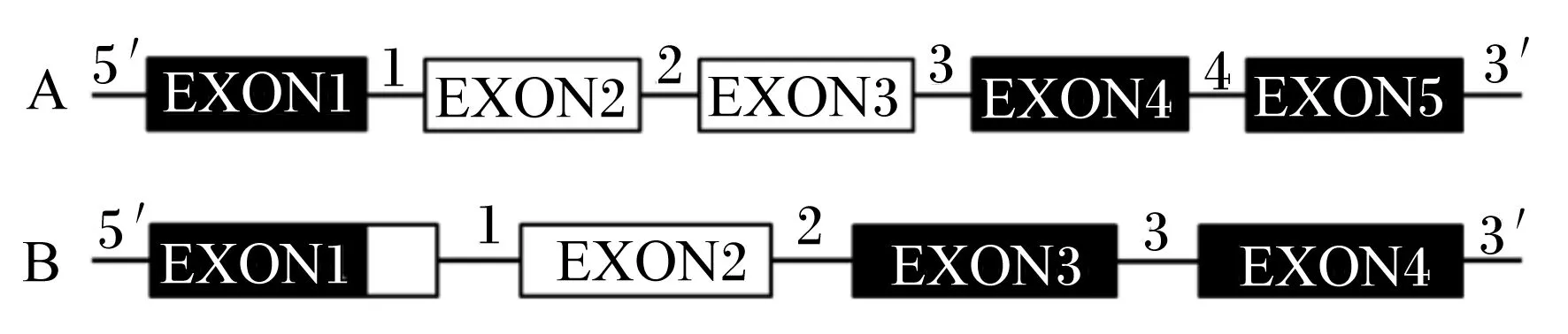

A: the structure ofGhrelingene in mammals and a part of fish species includingOncorhynchusmykiss,IetaluruspunetausandSalmosalar(5 exons and 4 introns); B: the structure ofGhrelingene in a part of fish species includingCarassiusauratus,Oreochromismossambicus,Oreochromisniloticus,AcanthopagrusschlegeliandBarchydaniorerio(4 exons and 3 introns).
图1Ghrelin基因结构
Fig.1 The structure ofGhrelingene
2 Ghrelin的组织分布
Ghrelin广泛分布于各物种的中枢和外周系统中。在哺乳动物中,Ghrelin在中枢系统中的脑组织表达量最高,在外周系统中的胃和肠道广泛表达[3,16-17]。Ghrelin的组织分布在金鱼[8]、日本鳗鲡(Anguillajaponica)[18]、黑鲷[11]、斑马鱼[12]、雅鱼[19-20]和红腹食人鱼(Pygocentrusnattereri)[21]等鱼类上已有报道。Unniappan等[8]通过Northern blot检测出金鱼的肠道组织中有GhrelinmRNA的表达,进一步用反转录PCR(RT-PCR)分析出脾脏中GhrelinmRNA表达量最高,其次是肠道,但是在中脑、后脑和垂体以及其他外周组织中未检测出GhrelinmRNA。Kaiya等[18]通过RT-PCR发现日本鳗鲡Ghrelin在脑、心脏、胃、肠道、体肾和头肾处有表达,胃和前肠的表达量最高。Yeung等[11]发现黑鲷Ghrelin仅在胃部大量表达。而Amole等[12]发现,除胃部外,斑马鱼脑和肝胰脏等也有Ghrelin分布。此外,报道了齐口裂腹鱼(Schizothoraxprenanti)Ghrelin在脑和肠道中表达量较高[20],而重口裂腹鱼(Schizothoraxdavidi)Ghrelin在肠道中丰富表达[19]。Volkoff[21]通过实时定量PCP(qRT-PCR)发现在红腹食人鱼脑、消化道、肝脏和脾脏等组织中Ghrelin表达量较为丰富。
Ghrelin在不同物种各组织中的广泛表达模式暗示其具有多种生物学功能,在脑组织中的丰富表达可能暗示其参与多种生命活动的中枢调控,在消化道中的高表达可能暗示其与动物的摄食、消化和吸收等功能有关。
3 Ghrelin调节鱼类摄食
Ghrelin对动物摄食功能的调节是其生物学功能研究的热点之一,在哺乳动物上的研究较多,鱼类上也开展了一些研究,研究主要集中在:1)喂养策略对Ghrelin表达量的影响;2)注射Ghrelin对鱼类摄食量的影响。
3.1 喂养策略对Ghrelin表达量的影响
摄食前后和禁食后复投喂等喂养策略可引起Ghrelin表达水平改变。学者们发现增食欲因子在摄食前或禁食后表达量上升,在摄食后表达量下降,而厌食欲因子的表达模式则相反[22]。在哺乳动物上的报道显示,中枢神经系统和外周组织中的Ghrelin表达模式为摄食后表达量下降、禁食(短期或长期)后表达量上升,长期禁食后复投喂表达量下降[23-25]。在鱼类上,Wei等[20]发现齐口裂腹鱼摄食后1.5和9.0 h脑中Ghrelin表达量显著下降,摄食后6 h肠道中Ghrelin表达量也显著下降。类似的,异育银鲫摄食后1和3 hGhrelin表达量显著降低,禁食7 d后Ghrelin表达量显著升高[26]。Amole等[12]报道斑马鱼禁食3、5和7 d后脑和肠道中GhrelinmRNA表达量均显著升高,复投喂后GhrelinmRNA表达量恢复至正常投喂组水平。此外,在重口裂腹鱼[27]、南亚野鲮(Labeorohita)[28]和草鱼(Ctenopharyngodonidellus)[29]等上的研究也发现长期禁食显著提高Ghrelin表达量,复投喂后恢复至正常水平。这些研究表明Ghrelin作为促食欲因子参与鱼类摄食调控。

3.2 注射Ghrelin对鱼类摄食量的影响
通过中枢和外周注射Ghrelin可进一步探究Ghrelin对动物摄食的调控功能。在哺乳动物上的研究发现中枢或外周注射Ghrelin均可促进摄食,并通过其受体生长激素释放激素受体(GHS-R)调节[32-36]。对鱼类的研究结果与哺乳动物基本类似。Unniappan等[8]报道,金鱼脑室注射Ghrelin后显著增加1 h内摄食量。Matsuda等[37]给金鱼脑室和腹腔注射酰化Ghrelin,1 h内摄食量均极显著增加。Shepherd等[38]给虹鳟幼鱼静脉注射Ghrelin,摄食量显著增加。Miura等[39]发现金鱼腹腔或脑室注射酰化Ghrelin均显著增加摄食量,而注射非酰化Ghrelin则摄食量无显著变化。Tinoco等[40]报道,给虹鳟幼鱼腹腔注射Ghrelin 7 d后摄食量显著提高。此外,Velasco等[41]报道,给虹鳟注射Ghrelin 24 h后摄食量显著增加。在塞内加尔鳎上的研究也显示Ghrelin能够促进其摄食[42]。不同的是,Saito等[43-44]给初生小鸡脑室注射不同剂量Ghrelin,结果发现2 h内摄食量呈现剂量依赖性的显著下降;Jönsson等[30]报道虹鳟腹腔注射Ghrelin 12 h内摄食量无显著改变;Jönsson等[45]给虹鳟幼鱼长期(14 d)腹腔注射Ghrelin,其摄食量显著下降。综上,在鱼类上Ghrelin可发挥促进摄食的功能,但在不同鱼类上存在差异,这可能与药物来源、给药方式及注射剂量和时间有关。
4 Ghrelin调节鱼类摄食机制
Ghrelin对动物摄食调控的作用机制目前还不十分清楚。作者根据已有哺乳动物和鱼类研究,从以下3点分析Ghrelin调节鱼类摄食的作用机制:1)Ghrelin调节鱼类的胃肠运动;2)Ghrelin与胃中消化因子的关系;3)Ghrelin与其他食欲调节因子的关系。
4.1 Ghrelin调节鱼类的胃肠运动
组织分布的研究发现Ghrelin在机体胃肠道中丰富表达,生物学功能的研究发现其参与动物的摄食调控。此外,Ghrelin与胃动素蛋白结构相似性高[34],有学者提出Ghrelin通过影响动物的胃肠运动来调节摄食。在小鼠上的研究显示,GHS-R敲除后胃排空下降,而中枢和外周注射Ghrelin可通过GHS-R促进机体胃排空,增加胃肠动力。在鱼类上关于Ghrelin对胃肠运动影响的研究较少,还未见Ghrelin与胃排空关系的报道。Olsson等[46]以斑马鱼为研究对象,通过力量位移传感器记录了随Ghrelin浓度的增加升高了肠道紧张性收缩频率。而Kitazawa等[47]发现,在虹鳟上Ghrelin不能引起胃和肠道明显收缩,在金鱼上Ghrelin可引起肠道的小幅度收缩,但效果不明显。Ghrelin对鱼类胃肠运动的调节还有待进一步探究。
4.2 Ghrelin与胃中消化因子的关系
Ghrelin主要在胃肠道分泌,胃肠道是动物体消化的主要场所。因此,Ghrelin与动物胃中消化因子(胃酸和胃消化酶等)可能存在联系。Masuda等[48]发现给大鼠静脉注射Ghrelin可增加胃酸的分泌。类似的,Date等[49]报道给大鼠脑室注射Ghrelin也呈现剂量依赖性的增加胃酸的分泌。不同的是,de la Cour等[50]发现酰化Ghrelin或去酰化Ghrelin均不能改变大鼠胃G细胞对胃酸分泌。Ghrelin对动物胃酸分泌的调节作用还有待进一步研究。此外在,哺乳动物中,适量的Ghrelin能够提高胃蛋白酶及肝脂肪酶活性。Du等[51]报道,用Ghrelin处理胃黏膜细胞4 h,胃蛋白酶活性无显著性变化。而杜改梅等[52-53]用1×10-3μmol/L的Ghrelin处理大鼠胃黏膜细胞时显著增加了胃蛋白酶活性,进一步对大鼠左侧腿部肌肉注射重组Ghrelin,发现胃蛋白酶的活性显著提高。Nieminen等[54]对田鼠腹腔注射Ghrelin,持续注射4 d后肝脏中脂肪酶活性极显著提高。目前未见Ghrelin对动物淀粉酶活性影响的研究,在鱼类上关于Ghrelin与消化酶关系的研究也尚属空白。
4.3 Ghrelin与其他食欲调节因子的互作
Ghrelin主要在动物的胃肠道和中枢神经系统中下丘脑核团中表达量丰富。作为脑肠肽,Ghrelin可和下丘脑核团产生的多种食欲调节因子[神经肽Y(NPY)/刺鼠相关蛋白(AgRP)、阿黑皮素原(POMC)/可卡因-苯丙胺调节转录肽(CART)、促皮质激素释放激素(CRF)、增食欲素(Orexin)和哺乳动物雷帕霉素靶蛋白(mTOR)]以及外周或神经内分泌系统的肽类激素[瘦素(Leptin)、Nesfatin-1、GH和催乳素(PRL)]互作调节摄食(图2),其中NPY/AgRP、Orexin和GH促进动物摄食,POMC/CART、CRF、mTOR、Leptin、Nesfatin-1和PRL抑制动物摄食。
4.3.1 Ghrelin与NPY/AgRP、POMC/CART
Ghrelin可能通过作用于NPY/AgRP和POMC/CART信号通路调节动物摄食。Asakawa等[34]在小鼠上的研究显示Ghrelin可通过作用于中枢系统的NPY及其受体Y1促进小鼠摄食。Miura等[55]以金鱼为研究对象,发现脑室或腹腔注射Ghrelin使摄食量显著增加,NPYmRNA表达量显著上升;当Ghrelin与Y1受体拮抗剂BIBP3226共注射后,摄食量显著下降。Gao等[56]研究显示,投喂含Ghrelin的饲粮8周,石斑鱼(Epinepheluscoioides)脑NPYmRNA的表达量显著增加。Ariyasu等[57]发现,循环系统Ghrelin下降的小鼠,摄食量及下丘脑中神经肽(NPY/AgRP和POMC)的表达量未发生显著改变。Qi等[58]发现,长期弓状核Ghrelin过表达的小鼠前3周摄食量和体重显著增加,第4周开始摄食量无显著变化,但是体重仍显著增加,Ghrelin过表达6周后弓状核中NPY表达量无显著改变,而POMC表达量极显著升高,这可能是机体通过上调POMC的表达来补偿Ghrelin对摄食引起的刺激作用。Velasco等[59]研究发现,给虹鳟脑室注射Ghrelin显著降低下丘脑中POMC、CART表达量,显著增加下丘脑中NPY、AgRP表达量。Ghrelin通过NPY/AgRP和POMC/CART信号通路调节动物摄食的作用机制还需进一步探究。
4.3.2 Ghrelin与CRF
Ghrelin可能通过CRF信号通路调节动物的摄食。Asakawa等[60]给小鼠腹腔注射Ghrelin,下丘脑中CRFmRNA表达量显著增加。Jönsson等[45]报道,给虹鳟幼鱼脑室注射Ghrelin,其摄食量显著降低,共注射Ghrelin与CRF受体拮抗剂ahCRF后,其摄食量得到恢复。然而,关于Ghrelin通过CRF信号通路调节动物摄食的研究资料很少,需要加大这方面的研究。
4.3.3 Ghrelin与Orexin、mTOR
Ghrelin与Orexin和mTOR信号通路互作调节动物摄食。Toshinai等[61]报道,通过Ghrelin诱导小鼠Orexin神经元的免疫活性,单独注射抗-Orexin引起摄食量显著下降,而与Ghrelin共注射后,摄食量显著低于Ghrelin单独注射组,但仍显著高于对照组,这说明抗-Orexin可以一定程度减弱Ghrelin引起的摄食量增加。Miura等[62]给金鱼脑室注射Orexin受体拮抗剂SB334867后摄食量下降,与Ghrelin共同注射后摄食量恢复到正常水平;此外,脑室注射Ghrelin后金鱼间脑中OrexinmRNA表达量显著增加。Penney等[63]以洞穴鱼为研究对象,发现腹腔注射Ghrelin 30 min内摄食量显著升高,全脑中mTOR和Orexin的表达量均显著升高。因此,中枢和外周注射Ghrelin均会提高Orexin和mTOR的表达量,但外周注射Ghrelin是否是通过反馈作用调节还需深入研究。
4.3.4 Ghrelin与Leptin、Nesfatin-1
关于Ghrelin与外周组织中食欲调节因子相互关系的研究报道很少。Ghrelin受体和Leptin受体在小鼠弓状核中超过90%的神经元共表达[64],在哺乳动物和鱼类上都发现Leptin系统与Ghrelin系统在调节摄食和能量代谢等生理作用上存在拮抗效应[65-68]。一些研究报道了Leptin可改变AgRP和NPY等食欲调节因子的表达量,与Ghrelin引起的变化模式相反[69-70]。此外,Ghrelin注射显著增加了Leptin缺失型小鼠的摄食量,而当Ghrelin与Leptin共注射后摄食量恢复到对照组水平[71]。Kohno等[72]的研究也显示注射Leptin能够抵抗Ghrelin引起的小鼠摄食量增加,二者共注射后摄食量与对照组无显著差异。Toshinai等[25]发现小鼠腹腔注射Leptin显著增加胃中GhrelinmRNA的表达量。另外,Shimizu等[73]发现给小鼠腹腔注射Nesfatin-1显著抑制其摄食,而Stengel等[74]运用共聚焦显微镜研究发现Ghrelin与Nesfatin-1前体核酸结合蛋白2(NUCB2)共定位于大鼠的胃X/A样细胞中。因此,Ghrelin可能与Leptin、Nesfatin-1等外周食欲调节因子相互作用,但在鱼类上是否共同作用发挥调节摄食的功能及作用途径还不清楚。
4.3.5 Ghrelin与GH、PRL
注射Ghrelin后可增加循环系统中与摄食相关的GH、PRL等激素的水平。Date等[75]报道大鼠脑室注射Ghrelin可增加血浆中GH水平。Kaiya等[18]在日本鳗鲡上的研究发现离体培养的垂体细胞用Ghrelin(0.1、1.0、10.0 nmol/L)处理,高剂量显著增加GH的释放量,并且各剂量均显著增加PRL的释放量。Riley等[76]21 d连续给莫桑比克罗非鱼腹腔注射Ghrelin,可显著增加垂体中GHmRNA的表达量。Shepherd等[38]也报道给虹鳟腹腔注射Ghrelin显著增加了血浆中GH的水平。因此,Ghrelin可能通过影响GH和PRL的分泌调节动物摄食。
综上,将Ghrelin与其他食欲因子的关系总结如下:1)Ghrelin可以作用于中枢神经系统中的NPY/AgRP和POMC/CART、CRF、Orexin和mTOR等信号通路调节动物摄食;2)Ghrelin可能与外周组织中的Leptin、Nesfatin-1等食欲因子互作;3)Ghrelin能够增加循环系统中GH、PRL等激素的水平。
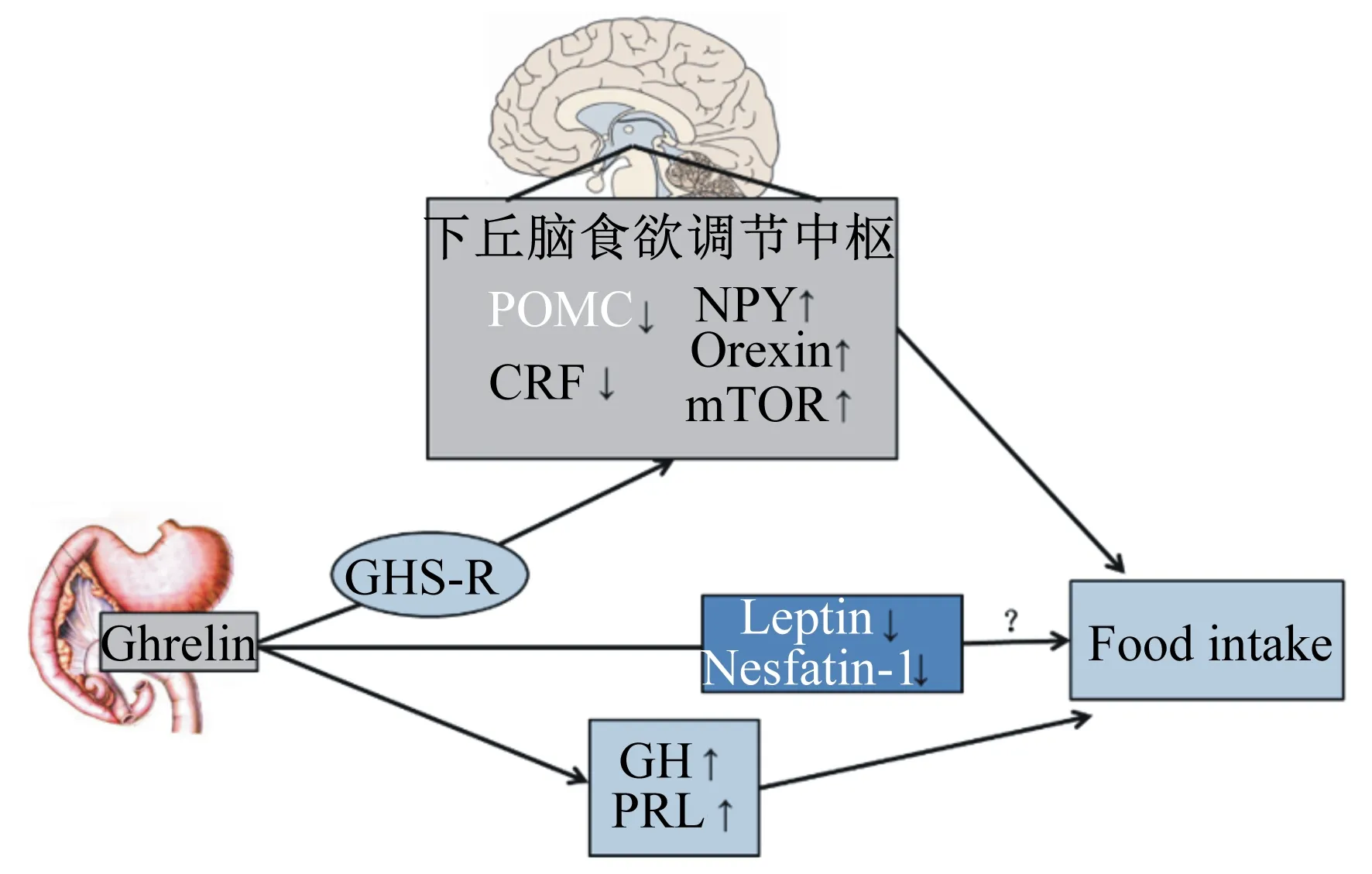
Ghrelin:胃饥饿素或生长激素释放肽;GHS-R:生长激素释放肽受体;POMC:阿黑皮素原;NPY:神经肽Y;CRF:促皮质激素释放激素;Orexin:增食欲素;mTOR:哺乳动物雷帕霉素靶蛋白;Leptin:瘦素;GH:生长激素;PRL:催乳素;Food intake:摄食量。下调箭头:抑制摄食;上调箭头:促进摄食;黑色字体:Ghrelin促进相关基因表达;白色字体:研究结果不一致或没有直接研究。
Ghrelin: growth-hormone-releasing peptide; GHS-R: growth hormone releasing peptide receptor; POMC: proopiomelanocortin; NPY: neuropeptide Y; CRF: corticotropin-releasing factor; mTOR: mammalian target of rapamycin; GH: growth hormone; PRL: prolactin. Down arrow: inhibiting food intake; up arrow: promoting food intake; black font: Ghrelin promotes related gene expressions; white font: inconsistent research results or no direct study.
图2Ghrelin调控摄食机制
Fig.2 The mechanisms of Ghrelin regulation on feeding
5 小 结
Ghrelin作为一种脑肠肽,在动物中枢系统的脑组织及外周系统的胃中大量表达,是中枢和外周摄食调控系统中重要的增食欲因子。研究表明禁食后哺乳动物和鱼类Ghrelin表达量显著提高,中枢或外周注射Ghrelin可促进动物的摄食量。目前,有关Ghrelin摄食调控的探究主要集中在哺乳动物的人和大鼠上,在鱼类上主要集中在鲤科,其他鱼类的相关研究资料十分有限。鉴于Ghrelin作为在鱼类摄食相关领域中的研究热点,其摄食调控以及作用机制的研究不够深入,未来应在借鉴哺乳动物研究结果的基础上,深入探讨Ghrelin对不同鱼类的摄食调控机制,为鱼类摄食调控和生产应用提供理论依据。

