马尾松林土壤微生群落结构对不同营林处理的响应
雷 蕾,肖文发,曾立雄,*,黄志霖,高尚坤, 张维诚,王 松
1 中国林业科学研究院森林生态环境与保护研究所,国家林业局森林生态环境重点实验室,北京 100091 2 南京林业大学南方现代林业协同创新中心,南京 210037 3 华南农业大学林业风景园林学院,广州 510642 4 湖北省秭归县国有九岭头林场,宜昌 443604
多样的森林类型和不同营林措施的干扰造成了森林土壤碳库维持机制、碳固定过程研究较大的不确定性[1]。土壤微生物是土壤中物质转化的动力,对土壤有机质的分解起着重要作用[2- 4],且对环境变化十分敏感[5]。森林采伐等对森林生态系统产生干扰的经营措施极可能会通过改变地上植被组成、凋落物和根系分泌物等有机质碳输入的数量和化学成分,影响微生物的底物获取和微生物过程[6- 7],从而作用于土壤有机碳的分解与转化,引起土壤碳排放的变异[2, 8- 9]。近些年来许多学者针对森林经营特别是采伐措施对土壤碳排放的影响进行了大量研究[10- 12],但对于采伐干扰后微生物的响应研究有限[13],深入分析森林采伐后微生物过程的变化是探讨森林采伐对于土壤碳库的影响机制的关键部分,是评估采伐干扰对森林土壤碳库过程的影响机制的重点与难点[12]。
马尾松(Pinusmassoniana)是中国南方主要造林树种,是三峡库区分布面积最大的森林类型[14- 16],但由于本区域马尾松林经营粗放且人为干扰强烈,低产林大面积存在,这可能是本区域森林生态系统碳密度偏低的主要可能原因。因此,在三峡库区开展马尾松林的经营试验,并对经营后马尾松林的土壤碳库动态、碳固定过程的微生物因子进行长期连续的监测和调查十分必要。本研究以三峡库区人为管理后马尾松飞播林为研究对象,对营林处理后(对照(未采伐),除灌(清除灌丛),采伐1(强度15%)和采伐2(强度70%))不同时期(处理后初期(2013年12月)和处理后15个月(2014年12月))的土壤微生物生物量、微生物群落结构组成以及土壤温湿度等环境因子进行了测定。我们假设认为地上植被组成的改变造成了土壤微生物群落结构的差异性,通过分析不同营林处理的马尾松林土壤微生物因子的变化情况及其主要影响因子,以期为深入认识营林干扰措施对土壤碳排放过程的微生物影响机制提供科学依据。
1 研究区概况
研究地点位于湖北省秭归县三峡库区九岭头林场,地理位置30°59′N,110°47′E,海拔156—2030.6 m,年均气温16.9℃,年降水量1000—1250 mm,多集中于4—9月,属于亚热带大陆性季风气候。土壤类型以黄壤、黄棕壤为主[16]。调查样地内马尾松林为70年代飞播造林,样地内林木分布均匀,马尾松为主要优势种,盖度为80%,伴生有少量光皮桦(Betulaluminifera)、漆树(Toxicodendronvernicifluum)、杉木(Cunninghamialanceolata)。灌木主要有火棘(Pyracanthafortuneana)、胡枝子(Lespedezabicolor)、木姜子(Litseapungens)等,草本主要有狗脊(Woodwardiajaponica)、苔草(Carextristachya)、三脉紫菀(Asterageratoides)、中日金星蕨(Parathelypterisnipponica)等。
三峡库区马尾松林主要受到大树的采伐和林下灌丛清除2种措施的干扰,但在采伐灌丛过程中,当地居民也会采伐林内新更新的光皮桦、杉木等,因此在2013年9月根据上述常见的营林干扰措施,在三峡库区九岭头林场设置了3种营林干扰类型,分别为除灌(SM)措施清除样地内所有灌木,并对灌木清理中产生的剩余物(灌丛枝叶等)进行仔细清除;采伐1(H1)措施清除样地内径阶在4 cm以上的非马尾松(主要为光皮桦、漆树、杉木,包括部分高大灌木,如木姜子、火棘等),强度为15%(按胸高断面积计算);采伐2(H2)措施清除样地内平均胸径(17.9 cm)以上的马尾松,强度为70%。本实验样地设置于经营后的马尾松飞播林内,样地内采用典型采样法,在除灌、采伐1、采伐2分别设立3块20 m×20 m固定样地,同时在固定样地相邻处,土壤条件基本相同的林地,设置对照固定样地3块(20 m×20 m)。伐木作业采用人力油锯伐木,仅对采伐的树干进行了移除,不对采伐产生的剩余物如枝叶等进行清除。各种经营措施并未对活地被层草本以及地表枯落物进行任何处理,上述营林措施于2013年10月中旬完成(样地具体特征详见前期研究表1[15]),且观测期内每隔半年定期对除灌样地内灌丛进行清除。
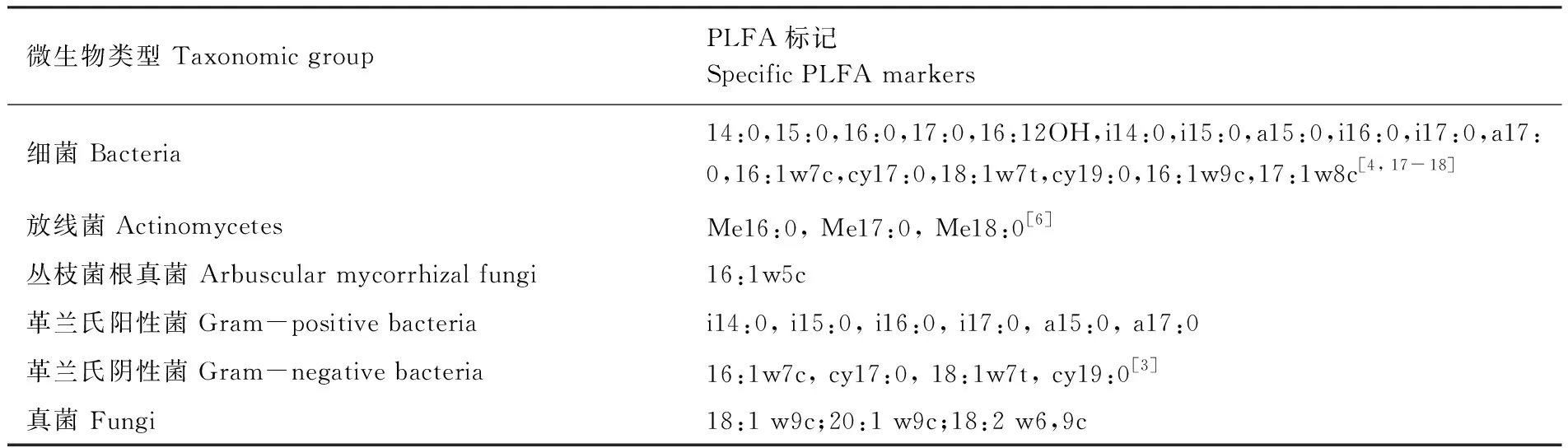
表1 表征微生物类群的PLFA
2 研究方法
2.1 土壤样品采集与相关指标分析
在固定样地内随机设置3个观测小区(1 m×1 m),于处理后初期(2013年12月),处理后15个月(2014年12月),使用土钻对观测小区0—10 cm土壤取3个土样,同一固定样地同层混合。将采集的部分新鲜土样过2 mm筛,一部分-80℃保存,采用磷脂脂肪酸方法(phospholopid fatty acid, PLFA)对微生物群落结构(soil microbial community,SMC)进行测定和分析[17],根据不同PLFA确定微生物类群,每种类群的PLFA生物量采用nmol/g干土进行表述,表征不同类群的PLFA标记如表1所示,主要分为细菌(B)、放线菌(ACT)、丛枝菌根真菌(AMF)、革兰氏阳性菌(GP)、革兰氏阴性菌(GN)以及真菌(F)。一部分过筛的新鲜土样置于4℃冰箱保存并于一周内采用氯仿熏蒸浸提法测定土壤微生物量碳(MBC)、微生物量氮(MBN)[17]。一部分过筛的新鲜土样通过KCL溶液浸提后采用流动分析仪测定铵态氮、硝态氮。剩余样品风干通过重铬酸钾外加热法测定土壤有机碳(SOC),凯氏定氮法测定全氮(TN),pH采用玻璃电极法测定[19]。用土壤温湿度测定仪器(Watchdog 2000 series weather stations)测定0—10 cm土壤温度湿度。
2.2 数据统计分析
利用单因素方差分析(one-way ANOVA)检验不同采伐处理方式下土壤微生物生物量和土壤理化性质的差异(P<0.05),利用双因素方差分析(two-way ANOVA)检验采伐处理方式和处理时间对于土壤理化指标、微生物生物量和各类微生物PLFA含量的影响。同时采用主成分分析(PCA)和冗余度分析(RDA)检验不同处理样地SMC结构的差异及其与土壤理化性质的关系。主成分和冗余度分析均在软件Canoco 4.5中进行,其余分析处理在SPSS 19.0中进行,用SigmaPlot 12.5软件作图。
3 结果与分析
3.1 土壤微生物生物量对不同采伐处理的响应
在干扰后初期(2013年12月),各处理间土壤微生物总PLFAs和各类微生物PLFAs差异并不显著(图1)。但在2014年12月,与CK相比,SM、H1与H2的放线菌呈现出降低的趋势,且H1与H2均达到显著水平(P<0.05)。在2014年,除AMF外,SM、H1、H2土壤微生物总生物量以及各类群生物量均呈现降低的趋势。综合2年数据可知,处理方式对土壤微生物量无显著影响,而处理时间显著影响了土壤微生物总PLFAs、放线菌PLFAs和真菌PLFAs。处理方式与处理时间对总PLFAs与各类菌群PLFAs均无显著的交互作用(表2)。
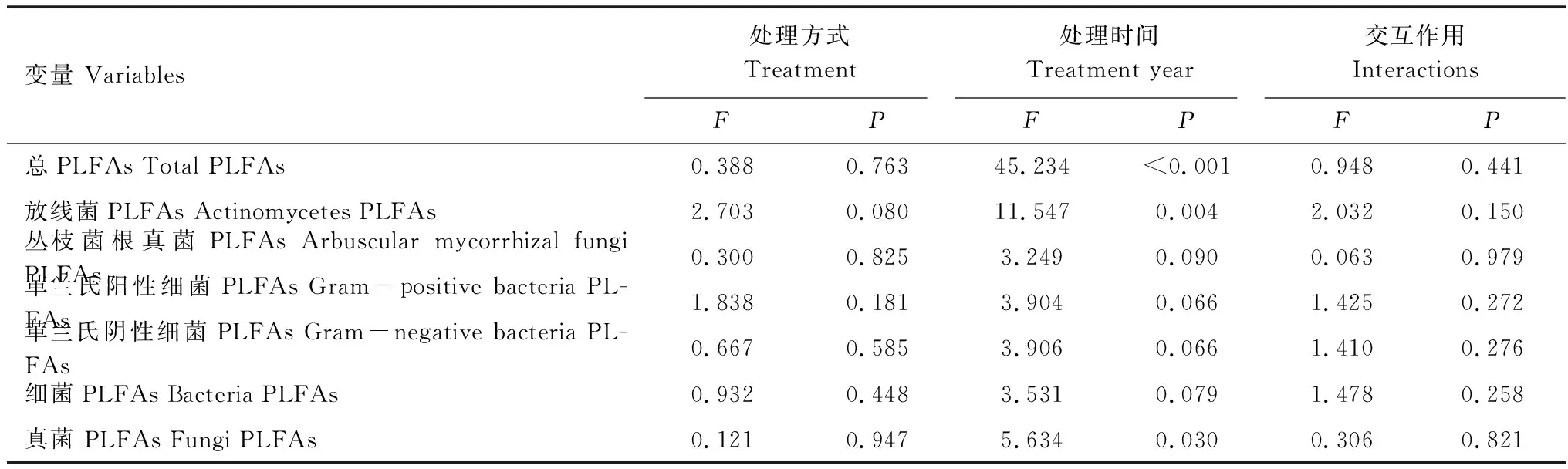
表2 处理方式、处理时间及其交互作用对土壤微生物量的影响
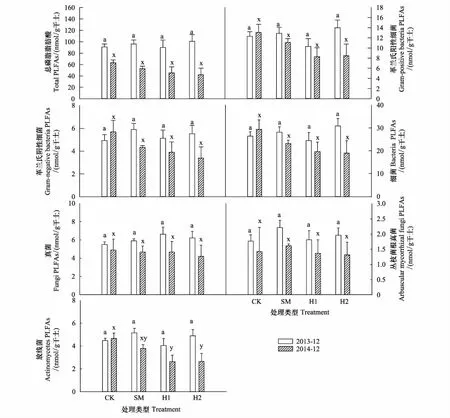
图1 土壤微生物PLFAs对不同采伐方式的响应
3.2 土壤微生物群落结构对不同采伐处理的响应
土壤微生物群落的磷脂脂肪酸相对丰度是评价微生物群落结构变化的重要指标。对不同处理和处理时间下土壤中所提取的20种磷脂脂肪酸进行主成分分析,结果显示,在处理后初期(2013年12月),各处理微生物群落结构并无显著差异,第1、2主成分的贡献率分别为60.9%、17.4%。而在2014年,CK与其他处理的微生物群落结构存在显著差异,不同乔木层采伐处理(H1和H2)之间微生物群落差异不显著(图2)。
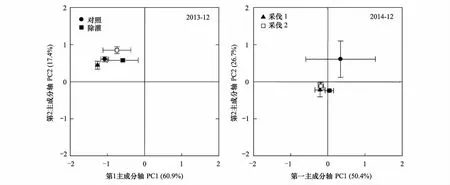
图2 不同处理土壤微生物磷脂脂肪酸相对丰度主成分分析
通过对主成分的因子载荷分析可知(表3),2013年与PC1显著相关的微生物PLFA生物标记类型的有5种,2014年PC1显著相关的微生物PLFA生物标记类型增至7种。处理后1年,真菌(20:1w9c)对PC1的贡献作用降低,细菌(14:0,16:0,cy17:0,i14:0)对PC1的贡献作用增大。2013年真菌生物标记(20:1 w9c)与PC1极显著相关,而在2014年与PC1极显著相关的生物标记物变为革兰氏阴性细菌(16:1w7c)。不同处理时间,对PC2起显著作用的微生物PLFA生物标记物类型均有4种,细菌对PC2起极显著作用,只是标记物类型因处理时间而有所改变(表3)。处理方式对放线菌和革兰氏阳性细菌影响显著,处理时间对革兰氏阴性细菌和总细菌相对丰度影响显著,处理时间和处理方式对放线菌相对丰度存在显著的交互作用(表4)。
3.3 不同处理方式对土壤性质的影响
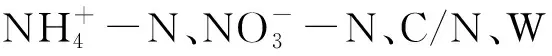
3.4 土壤微生物群落结构与土壤理化性质
对4种处理2个观测时间的土壤微生物群落结构与土壤理化性质的冗余度分析(RDA)表明,10个土壤理化性质变量在2013年和2014年分别共同解释了土壤微生物群落结构变化的77.9%和76.5%(图4)。蒙卡洛检验结果显示,土壤温湿度比值、土壤湿度是显著影响2013年微生物群落结构的主要因子;土壤湿度、土壤微生物熵是显著影响2014年微生物群落结构的主要因子。结合微生物群落结构主成分载荷因子分析可知(表3),不同处理时间,土壤湿度均与主成分分析中PC1显著相关的微生物PLFA生物标记类型呈现显著负相关关系,而土壤温湿度比、MBC/SOC与其呈现显著正相关关系(图4)。
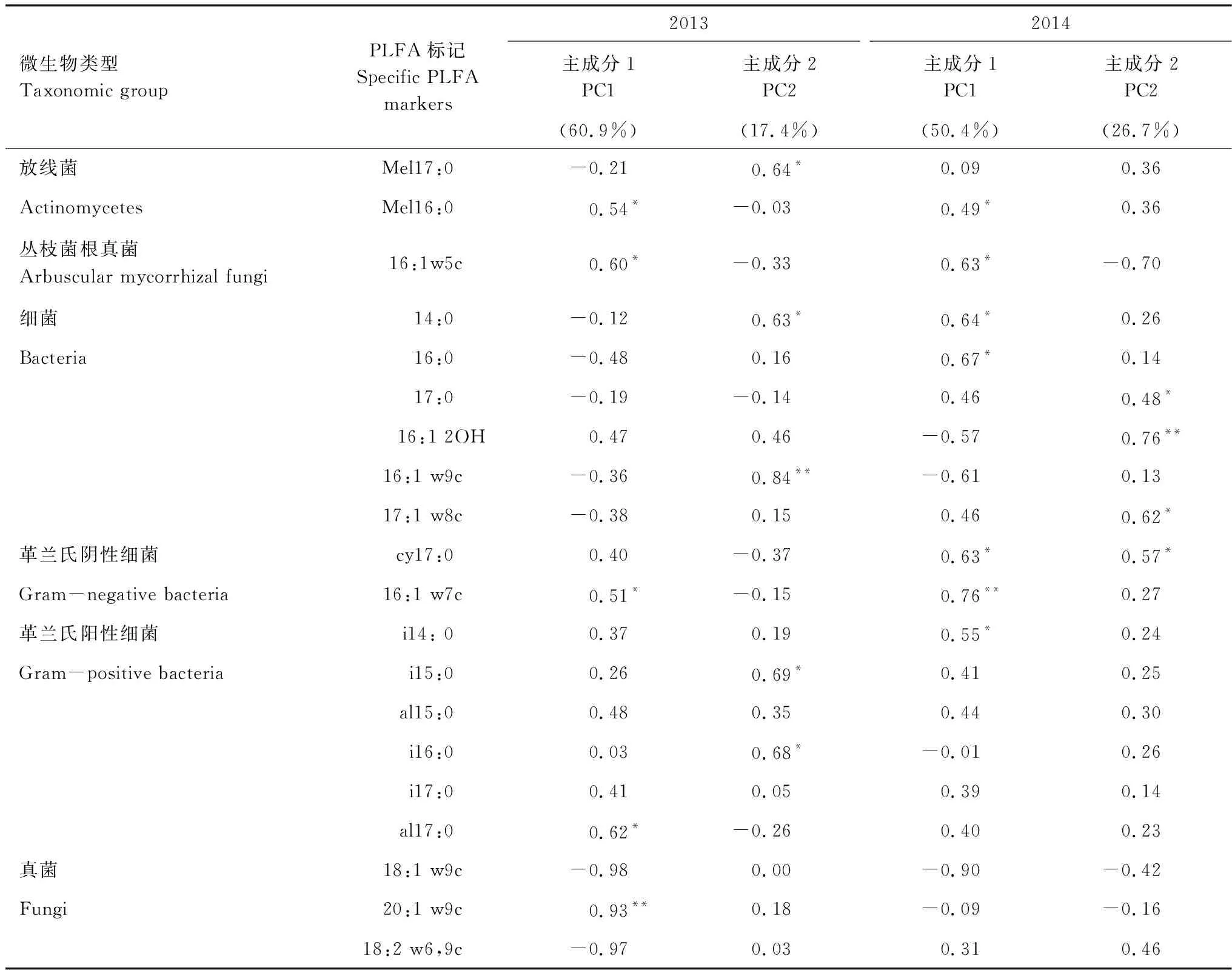
表3 主成分载荷因子
*,**分别表示在0.05和0.01水平下显著相关
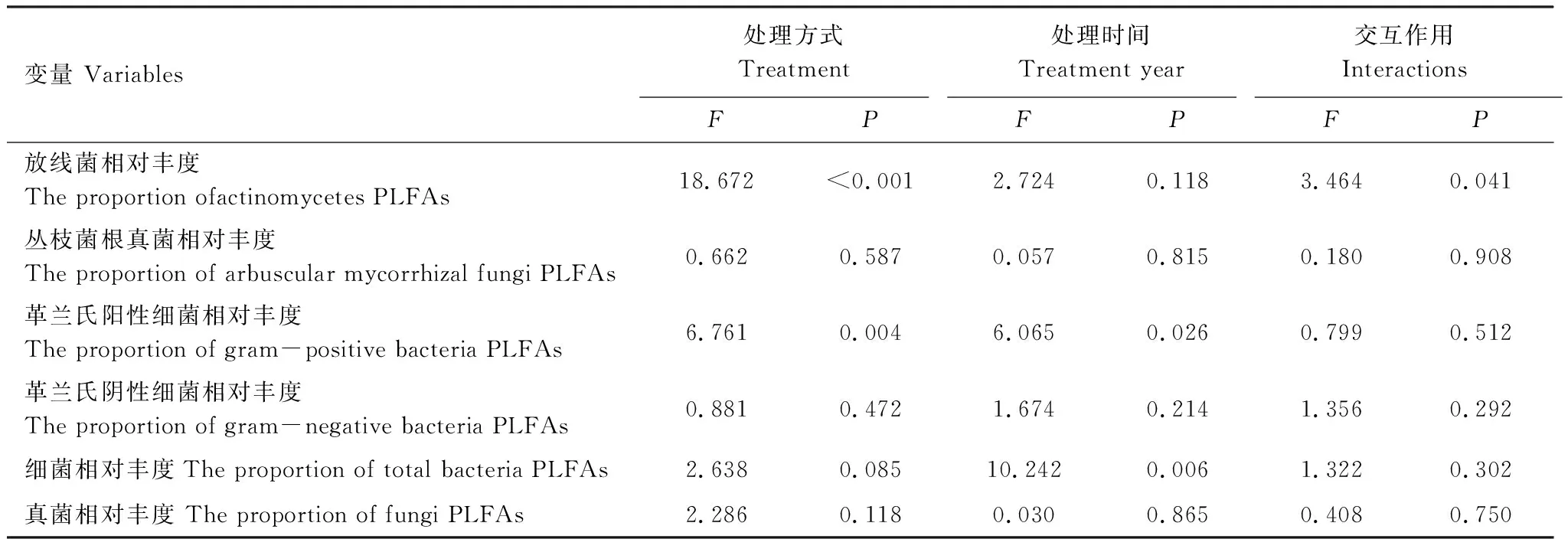
表4 处理方式、处理时间及其交互作用对土壤微生物群落结构的影响
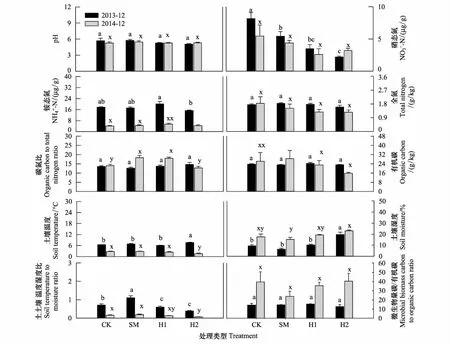
图3 土壤理化性质对不同处理的响应
4 讨论
营林干扰通常通过改变地上底物和地下底物的数量和质量来影响微生物群落,采伐通常会造成针叶林土壤微生物生物量的降低[20- 22]。在本研究中,干扰初期处于不稳定状态,各处理微生物群落生物量并未呈现出规律性的变化(图1);但在2014年12月,林内环境逐渐恢复稳定后,除了AMF群落外,SM、H1、H2的其他类群生物量的均呈现出降低的趋势,从而造成了微生物群落总生物量下降的趋势。其中,真菌是有机质分解和形成的主要驱动因子[6, 23],一般呈块状分布,具有较高的空间异质性[13],而较高的空间异质性使其更易受到采伐等干扰的影响[24],这可能是SM、H1和H2的真菌生物量在处理后1年多呈现出降低趋势的原因(图1)。但采伐干扰后初期,死根的分解以及采伐残余物的输入可能会引起激发效应,刺激真菌类群,大量以寄生、腐生为营养方式的真菌增加,引起真菌类群的增加[6],采伐后初期SM、H1和H2的真菌生物量的高于CK可能源于上述原因。干扰后真菌类群生物量的变化反映了底物供应对真菌类群的影响过程。多数细菌以真菌的分解产物为主要底物[6],真菌类群的改变也会引起细菌的变化。本研究中,不同处理时间,PC1的极显著载荷因子由真菌PLFA生物标记物(20:1w9c)转变为革兰氏阴性细菌PLFA生物标记物(16:1w7c)(表3),因此,真菌群落结构的变化可能是造成本研究中不同处理时间微生物群落结构变化的主要类群(图2)。而真菌类群中的AMF与土壤湿度密切相关,高的土壤湿度会抑制AMF的生长[25],这与本研究结果一致,AMF与湿度显著负相关(图4),但各处理AMF生物量并未随着土壤湿度的变化而出现显著差异(图1),可能是采伐后其他原因造成的,仍需进一步分析。
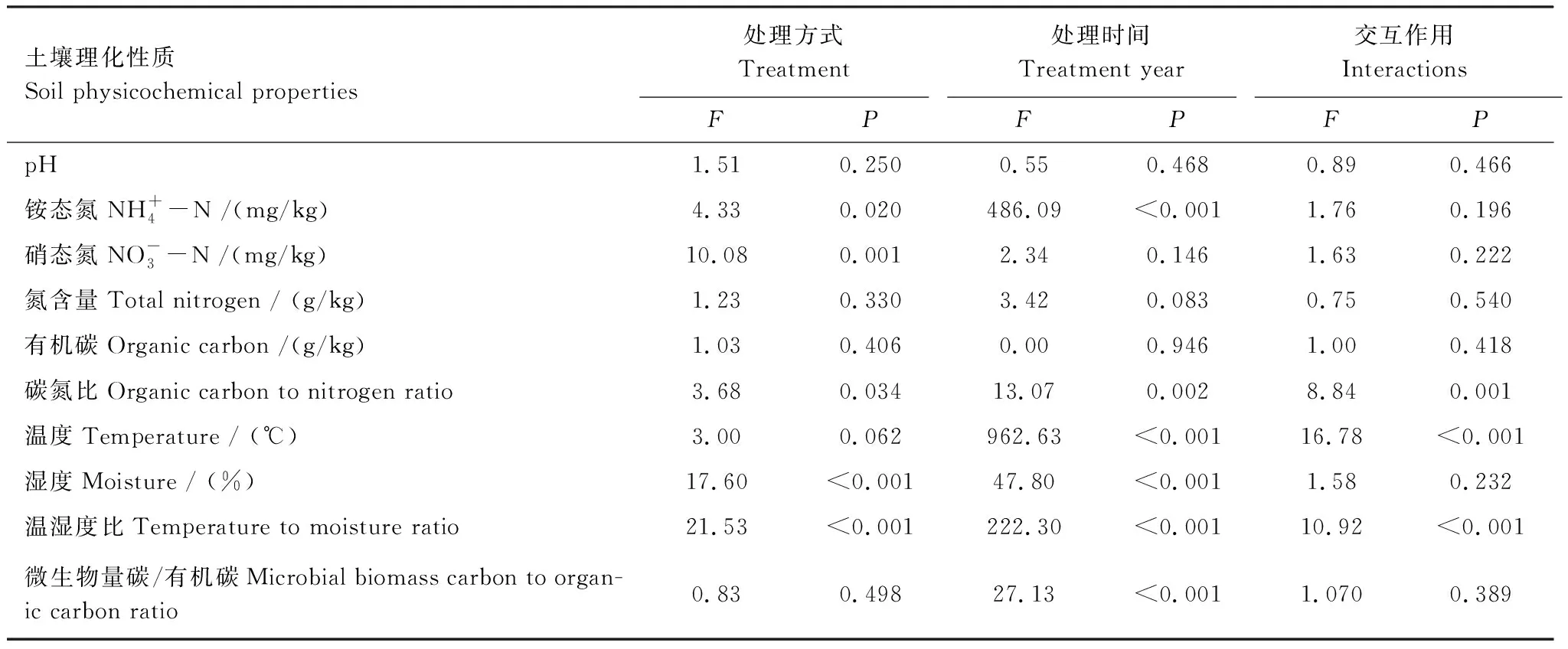
表5 处理方式、处理时间及其交互作用对土壤理化性质的影响
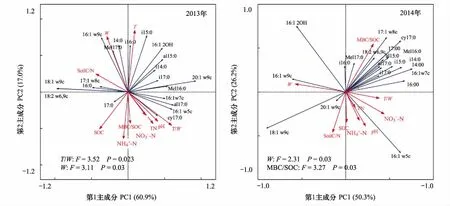
图4 不同处理时间土壤微生物磷脂脂肪酸与土壤理化性质冗余度分析
相较于真菌,细菌对于环境因子的变化(如土壤温度、湿度、通气度等)适应范围更大[26- 27],同时对于土壤温湿度变化更为敏感[28]。其中,放线菌能够通过生产相容物如脯氨酸、甘油等,保持细胞膨胀,抵抗在水分压力下的质壁分离,同时其丝状特征能够有效利用土壤中的水分和空气[29],因此在土壤温湿度比值较高的情况下,ACT生物量占优势,初期SM的ACT生物量高于其他处理(图1),可能是由于较高的温湿度比值造成的(图3)。1年后,H1 和H2 的ACT显著低于CK(图1),其温湿度比低于CK和SM可能是造成ACT变化的主要原因(图3)。
地上部分和地下部分的群落结构具有强烈的交互作用,植被类型以及组成是影响微生物群落结构主要因子之一[30- 31],SM、H1和H2均改变了地上植被组成以及凋落物的属性,从而影响微生物群落结构的底物供应,因此处理后1年,这三种措施的微生物群落结构显著区别于CK(图2)。而上层植被干扰(H1和H2)和下层植被(SM)属于两种不同的干扰方式,尽管灌丛生物量相较于上层植被要小很多,但却是微生物的重要底物来源[30],因此灌丛的移除极可能通过影响底物组成来改变微生物群落结构的组成(图2)。相关研究认为由于针叶树种和阔叶树种的提供的养分不同,影响共生真菌类群而显著影响土壤微生物群落组成[32],但那是在改变优势树种属性的前提下[33],本研究中的两种采伐处理虽然影响了针叶树种和阔叶树种的组成,但优势树种仍是马尾松,因此微生物群落结构以及丛枝菌根真菌在两个观测期并无显著差异(图1,图2)。不同的微生物种类对土壤有机碳的降解能力不一样,导致土壤有机碳周转速率的不同[34],这与本研究的前期研究结果一致。由前期研究可知,与CK相比,H1和H2显著增加了矿质土壤呼吸,而SM显著降低了矿质土壤呼吸,微生物群落结构的变化可能是造成土壤呼吸主要组分矿质土壤呼吸变化的重要因素[15]。

5 结论
土壤微生物群落对于森林采伐等干扰措施的响应直接调控着森林土壤碳固定与转化,本研究通过对采伐处理后不同时期马尾松林的土壤微生物生物量、群落结构以及相关环境因子进行了分析,结果表明,处理后初期各处理土壤微生物群落生物量以及微生物群落结构并无显著差异,而在处理后1年多,除灌、采伐1和采伐2 微生物生物量均呈现降低的趋势,且PCA分析结果显示,处理后1年多,林下植被剔除以及上层采伐均显著改变了土壤微生物群落结构。微生物群落结构的变化可能是不同处理土壤异氧呼吸变异的主要原因,但具体机制仍需进一步分析进行确定。同时本研究对不同采伐处理后的相关环境因子进行了探讨,土壤温湿度、土壤微生物熵是造成微生物群落结构变化的关键因子,但本研究不同时期结果的差异性表明营林措施的效应会随时间而改变,因此下一步的研究要注重营林干扰的持续性的作用。

