亚急性期静脉注射人骨髓间充质干细胞对脑梗死大鼠神经功能的影响
迟鲁梅,龚秀玲,于 骁,吴坤军,沈 静,高 宇*
(1.吉林大学中日联谊医院 神经内科,吉林 长春130033;2.上海市嘉定区南翔医院 神经内科,上海201800)
在我国,脑梗死是导致死亡和成人致残的第一位原因。尽管医学上对脑梗死的治疗已取得了不断的进步,每年仍至少有200万新发的脑梗死患者,卒中死亡占所有死亡原因的22.45%[1]。近年来,骨髓间充质干细胞(BMSCs)治疗为脑梗死患者带来了新的希望。目前对BMSCs的研究主要在急性期,本实验主要探讨亚急性期静脉给予人骨髓间充质干细胞(hBMSCs)对脑缺血再灌注大鼠神经功能的影响。
1 材料与方法
1.1实验材料
hBMSCs(ScienCell公司,No.7500;ScienCell),高糖DMEM培养液(CEFOgro BMMSC),胎牛血清(SH30084.03,Hyclone),Trypsin-EDTA(Gibco,Canada),雄性SD大鼠(辽宁长生生物技术有限公司),冰冻切片机(Lecia CM1900),Image J软件(Image J;NIH,Bethesda,MD)。
1.2方法
1.2.1细胞培养 hBMSCs原代细胞种于含10%胎牛血清、1%青霉素-链霉素的高糖DMEM 培养基中,将细胞放于37℃,5%二氧化碳的标准湿化孵育箱中培养。当细胞生长达到80%时进行传代。取第3-5代细胞进行实验。
1.2.2脑缺血再灌注模型的制备和实验分组 选用250-300克的雄性SD大鼠作为实验对象。所有大鼠的饲养温度为(20±2)℃,自由摄食和饮水,保持12小时轮换开灯关灯的作息时间,大鼠在大脑中动脉闭塞(MCAO)模型制备前1天禁食,模型制备前4小时禁水。采用线栓法[2]制备大脑中动脉闭塞(MCAO)模型。造模成功后2小时,拔出线栓,实现再灌注。
将大鼠随机分为2组,对照组(MCAO模型)和治疗组(MCAO+hBMSCs),两组大鼠分别在再灌注14天注射等量的2 mlPBS和2×106个hBMSCs。实验过程中不使用免疫抑制剂。
1.2.3大鼠行为功能测试 实验大鼠的行为功能测试由不了解实验分组的实验员进行。mNSS评分,limb placement 评分,Corner test 评分在造模后1天、14天、21天、35天、42天进行。mNSS评分参照王利平[3],Limb placement评分参照M De Ryck等[4],Corner test参照Zhang等[5]。
1.2.4梗死体积的测定 造模后第42天,所有大鼠麻醉后,通过心脏灌洗冰盐水处死,取出脑组织放于4%的福尔马林中浸泡24小时,然后浸入30%的蔗糖溶液中,48小时后,待脑组织沉底后,取出脑组织,放入-70℃冰箱中保存。24小时后取出冰冻的脑组织,在冰冻切片机中切成30 μm的薄片。进行Nissl染色。通过Image J软件测量梗死体积。梗死体积的表示方法为:病灶的体积/对侧大脑半球的体积。
1.3统计学方法
采用 SPSS 20.0 统计软件进行分析,数据以均数±标准差(mean±SD) 表示,采用t检验的方法对两组进行统计分析,以P<0.05为有统计学意义。
2 结果
2.1两组大鼠的mNSS功能评分结果
对照组和实验组在第1,14,21,35,42天均进行mNSS评分,两组在各个时间点均没有显著差异(P>0.05)。两组比较结果见表1。

表1 各组大鼠间mNSS评分结果
2.2Limbplacement功能评分的结果
实验组和对照组在各个时间的Limb placement评分没有显著差异(P>0.05)。结果见表2。

表2 两组大鼠间limbplacement评分结果
2.3Cornertest评分结果
两组大鼠在各个时间点的Corner test功能评分没有显著差异(P>0.05)。结果见表3。

表3 两组大鼠间的Corner test评分结果
2.4Nissl染色
Nissl染色正常脑组织为浅紫色,梗死区颜色发白。如图1,2。结果用Image J软件计算梗死体积和对侧大脑半球的体积的百分比表示。通过t检验,两组之间梗死体积百分比没有显著差异(P>0.05),结果如表4。
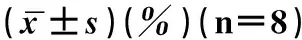
表4 两组大鼠梗死体积百分比的结果

图1 对照组Nissl染色的结果
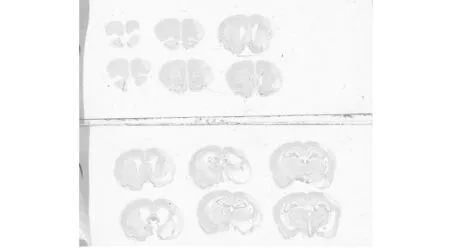
图2 hBMSCs治疗组Nissl染色的结果
3 讨论
在世界范围内,脑卒中是导致长期残疾的主要原因。目前,尚没有太多有效的方法来促进卒中后患者的神经功能康复。近年来,细胞移植为脑卒中患者的治疗带来了新的希望。尤其是BMSCs。它们能够识别并趋附脑损伤部位,一旦到达损伤部位,能够分泌促进脑组织恢复的因子[6]。此外,它们具有低免疫源性,能够自体移植而不涉及伦理学问题。大量研究表明,BMSCs能够改善脑缺血大鼠的神经功能[7-9]。
BMSCs移植的最佳时间取决于脑梗死后周边环境的动力学改变。大多数动物实验中,细胞移植的时间多为脑缺血后24小时或更短的时间[7-9]。但在实际的临床病人中,由于伦理学及免疫源性等原因,多采用自体BMSCs治疗。急性期患者的不良状态以及BMSCs的较长的培养周期为急性期的细胞治疗提供了阻碍。卒中病人的细胞治疗更可能在亚急性期或慢性期进行。亚急性期细胞移植的效果目前尚没有统一的定论。王利平等[3]认为,亚急性期(造模后7天)给予BMSCs能够减少微环境对宿迁细胞的损害,从而减小梗死体积,改善神经功能。Bhimashankar Mitkaria等认为亚急性期(造模后7天)给予MSCs虽然能促进血管再生[10],但是并不能带来神经功能的好转[10-12]。但是,也有研究[13,14]表明,造模后7天给予BMSCs能显著的改善大鼠的运动和感觉功能。目前关于缺血再灌注后14天给予BMSCs治疗报道较少。为了探索这一时期静脉注射BMSCs对脑缺血大鼠的影响,本实验在MCAO后第14天给予hBMSCs治疗,并用了三组行为功能测试来评估MCAO大鼠的运动、感觉的改善。这三个检查分别是mNSS评分,limbplacement评分和Corner test评分。我们选这三种行为功能检测方法是因为它们对脑梗死大鼠的感觉和运动损伤比较敏感[4,5],而且比较适用于长期的观察评估[5],不易受反复测试的影响。结果表明,造模14天给予hBMSCs静脉治疗后,一直到第42天并未见到治疗组大鼠的神经功能的改善。同时,通过Nissl染色对两组大鼠的梗死体积进行对比,也没有见到明显的统计学差异。这说明,脑梗死后14天后给予静脉注射hBMSCs并不能改善实验大鼠的神经功能。这与其他部分亚急性期和慢性期治疗的研究结果是不一致的[7,15]。应该注意的是,在很多研究[7,16]中,BMSCs注射后的几天内很快就能看到行为功能的改善,这种改善更多的是与急性期神经保护作用或者水肿以及炎症反应的减退有关,而不是单纯的感觉和运动的修复。除了治疗的时间对治疗效果的影响外,静脉给予细胞的数量也是很重要的。通过对60项基础研究的meta分析结果表明,注射的细胞数量和治疗效果呈明显的剂量相关性[17],增加细胞注射的数量有可能促进神经功能的改善。此外,尽管大多数的研究[18,19]认为异体BMSCs没有免疫排斥反应或者很弱的免疫反应,目前尚缺乏自体和异体BMSCs在免疫反应、动力学改变以及治疗效果方面的合适的对照研究。异体细胞的给入是否也影响了BMSCs治疗的效果也需要进一步的探索。
本研究证实,亚急性期给予hBMSCs并不能改善脑梗死的神经功能,其移植治疗的时间窗需要更多的基础研究来进一步确定。

