蒲公英萜醇对人乳腺癌细胞MCF-7增殖及凋亡的影响
朱 坤,丁米娜,杨 洋,车拴龙,陈丽艳,*
乳腺癌是全世界妇女中最常见的癌症之一,也是女性癌症死亡的主要原因[1]。在我国由于“西化的生活方式”和乱用外源性雌激素等原因,乳腺癌发病率有逐年增加的趋势[2]。因此,探究乳腺癌发病机制,寻找新的乳腺癌治疗药物成为研究的热点。近年来,从食品和中药中提取的抗癌药物因其副作用小、有效成分含量高而备受国内外研究者的关注。
蒲公英(Taraxacum mongolicum Hand. Mazz.)为菊科(Compositae)蒲公英属(Taraxacum F.H.Wigg.)多年生草本植物[3],在我国分布广泛、产量高且价格低廉。蒲公英具有清热解毒、消肿散结的功效,可全草入药,是菜药兼用佳品,不仅具有药用价值,而且是一种营养价值很高的野生蔬菜,是开发绿色天然植物营养保健品的宝贵资源。蒲公英研究历史已有数千年,在妇科中主要为治疗乳痈肿痛良药[4]。清代《本草正义》中有“蒲公英,其性清凉,治乳痈乳疔,红肿坚块,尤为捷效”的描述[5]。有研究发现噻唑蓝(methylthiazolyldiphenyltetrazolium bromide,MTT)法检测口服蒲公英提取液的大鼠尿液对人乳腺癌细胞MCF-7增殖具有抑制作用,并指出蒲公英萜醇、羽扇豆醇很有可能是此抑制作用的活性物质[6]。蒲公英萜醇属于乌苏烷型五环三萜类化合物,在蒲公英、杜香、檀香叶、紫菀等中药中均有分布,其分子式是C30H50O,相对分子质量为426.729,可溶于二甲基亚砜(dimethyl sulfoxide,DMSO)[7-8]。近年研究表明蒲公英萜醇可以抑制胃癌、宫颈癌等肿瘤细胞增殖并促进细胞凋亡[9-10],但其在抑制乳腺癌中的作用和机制尚不清楚。本实验旨在研究蒲公英萜醇对乳腺癌细胞增殖及凋亡的影响,并探讨其可能的分子机制,为蒲公英萜醇的医疗开发和利用提供依据。
1 材料与方法
1.1 材料与试剂
乳腺癌细胞系MCF-7为延边大学肿瘤研究中心提供;蒲公英萜醇 西安昊轩生物科技有限公司;DMEM培养基、胎牛血清(fetal bovine serum,FBS)、Hoechst 33342染料 美国Thermo公司;细胞培养皿、移液管、96 孔板 美国Corning公司;青霉素、链霉素 碧云天生物技术研究所;胰蛋白酶、MTT、DMSO 北京华美公司;荧光猝灭封固液 北京索莱宝科技有限公司;Western blot相关抗体 美国Cell Signaling公司;脱脂奶粉美国BD公司;Tris-HCl(1 mol/L,pH 8.8及pH 6.8)、质量分数30%丙烯酰胺 北京康为世纪生物科技有限公司;羊抗兔IgG、羊抗鼠IgG 美国Sigma公司;ECL试剂盒 美国Pierce公司。
1.2 仪器与设备
HERA-Cell 150 CO2培养箱 美国Thermo公司;DYCZ-40D型迷你转印电泳仪 北京六一仪器厂;BX53倒置显微镜 日本Olympus公司;Infinite 200 PRO全波长多功能酶标仪 瑞士Tecan公司;凝胶成像仪 美国Bio-Rad公司。
1.3 方法
1.3.1 药品配制
蒲公英萜醇用DMSO溶解,12.5、25.0、50.0、100.0、200.0 μmol/L蒲公英萜醇的培养基中DMSO质量分数分别为0.005%、0.01%、0.02%、0.04%、0.08%,-20 ℃分装保存,使用前解冻。
1.3.2 细胞培养
从液氮中取出冻存的人乳腺癌细胞株MCF-7并快速置于37 ℃水浴迅速使其融化,将细胞悬液转移至离心管,1 000 r/min离心4 min,弃上清液,使用含10% FBS及青霉素与链霉素各100 U/mL的DMEM培养基,于37 ℃、5% CO2的恒温培养箱中培养。每日倒置显微镜观察细胞形态及生长情况,待细胞长至70%~80%时消化传代。
1.3.3 MTT法细胞相对活力检测
将对数生长期的细胞2×103个/孔接种于96 孔板,37 ℃、5% CO2培养箱中常规培养,待细胞贴壁后加入终浓度为12.5、25.0、50.0、100.0 和200.0 μmol/L蒲公英萜醇,每组设8 个平行复孔,对照组加入等体积的培养液。于24、48、72 h后每孔加入配制好的MTT溶液100 μL孵育4 h;去液体,每孔加入100 μL DMSO,振荡10 min使结晶物充分溶解,应用全波长多功能酶标仪在490 nm波长处检测每孔的吸光度,并按下式计算细胞相对活力。
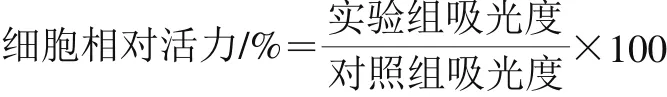
1.3.4 细胞集落形成测定(平板克隆实验)
取对数生长期MCF-7细胞,用0.25%胰蛋白酶消化并吹打成单个细胞,离心后把细胞重悬在10%胎牛血清的DMEM培养液中备用。将细胞悬液接种至6 孔板(500 个/孔),每孔0.2 mL培养液。置于37 ℃、5% CO2培养箱培养24 h后,加入50、100 μmol/L蒲公英萜醇处理细胞48 h,换为正常培养液继续培养,两周后出现镜下可见的克隆,终止培养。弃去上清液,用预冷的磷酸盐缓冲液(phosphate buffered saline,PBS)洗两次。加入1 mL甲醇固定30 min。弃去甲醇,加1 mL Gimsa染色液染色30 min,然后用自来水缓慢洗去染色液,室温干燥。
1.3.5 Hoechst 33342荧光染色法检测细胞凋亡
盖玻片于无水乙醇中浸泡2 h以上并于紫外照射后,放入6 孔板中,将细胞接种于6 孔板,培养24 h。待细胞融合度达到60%时采用如1.3.4节药物处理,其对照组用普通培养液继续培养。24 h后弃去上清液,PBS清洗一次后加1 mL甲醇固定15 min,弃甲醇,PBS洗两次,加入PBS配制的Hoechst 33342染色液0.5 mL,避光孵育30 min。去染色液,用PBS洗两遍,吸尽液体滴一滴抗荧光猝灭封片剂于载玻片上,盖上贴有细胞的盖玻片,使细胞接触封片剂,尽量避免气泡。荧光显微镜下观察细胞凋亡情况。
1.3.6 Western blot检测
待细胞饱和度达到70%~80%,以预冷的PBS清洗3 次,加入RIPA裂解液提取总蛋白;Bradford法测定蛋白质量浓度;十二烷基硫酸钠-聚丙烯酰胺凝胶电泳分离并转至聚偏二氟乙烯膜上;用TBST配制的质量分数5%脱脂奶粉室温下封闭2 h,加入一抗后4 ℃过夜;次日室温下TBST洗膜,加入相应二抗室温孵育2 h,ECL试剂盒显色、成像。β-actin蛋白作为内参,用Image J软件对蛋白条带进行扫描和定量分析,计算目标蛋白条带灰度/内参条带灰度的比值。
1.4 数据分析
所有实验重复3 次以上,采用SPSS 17.0软件进行统计学分析。实验数据采用方差分析,以P<0.05为差异具有统计学意义。
2 结果与分析
2.1 蒲公英萜醇抑制乳腺癌细胞的增殖作用
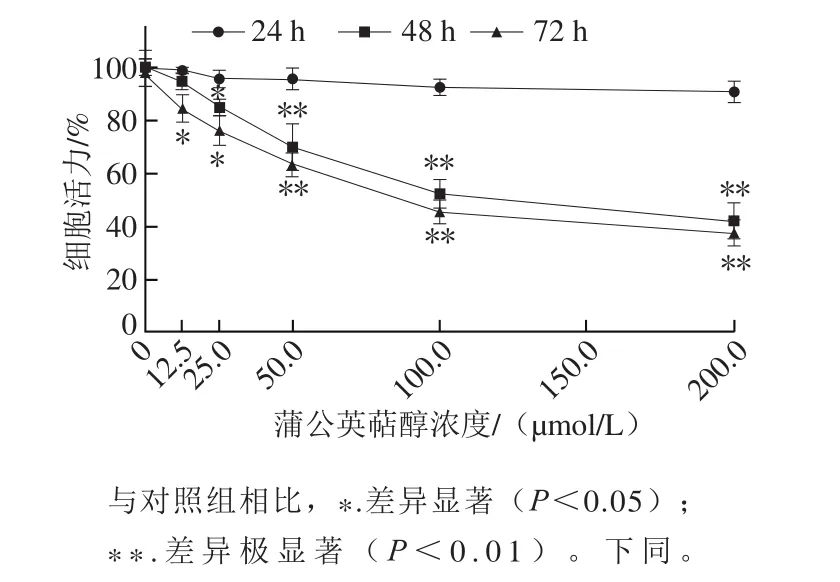
图1 蒲公英萜醇对MCF-7细胞增殖的影响Fig. 1 Effect of taraxerol on the proliferation of MCF-7 human breast cancer cells
由图1可知,用不同浓度(12.5、25.0、50.0、100.0、200.0 μmol/L)蒲公英萜醇处理MCF-7细胞,MTT实验结果表明,24 h后的给药组细胞增殖抑制效果不明显;48 h后,给药组细胞增殖受到明显抑制,且随着浓度增加,细胞增殖能力下降(P<0.05)。提示蒲公英萜醇对乳腺癌细胞的抑制作用呈现良好的剂量-效应关系。
2.2 细胞克隆形成情况
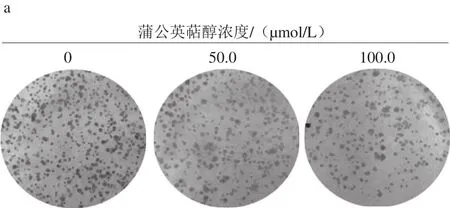

图2 平板克隆实验检测蒲公英萜醇对MCF-7细胞克隆形成的抑制作用Fig. 2 Taraxerol inhibited colony formation in MCF-7 human breast cancer cells as detected by the plate colony-forming assay
由图2可知,平板克隆实验结果显示,MCF-7细胞经蒲公英萜醇(50.0、100.0 μmol/L)处理48 h并换为正常培养液培养两周后,与对照组相比,克隆集落形成数量明显减少;提示蒲公英萜醇可显著抑制MCF-7细胞的增殖与克隆形成能力。
2.3 Hoechst 33342染色观察细胞核微型态变化
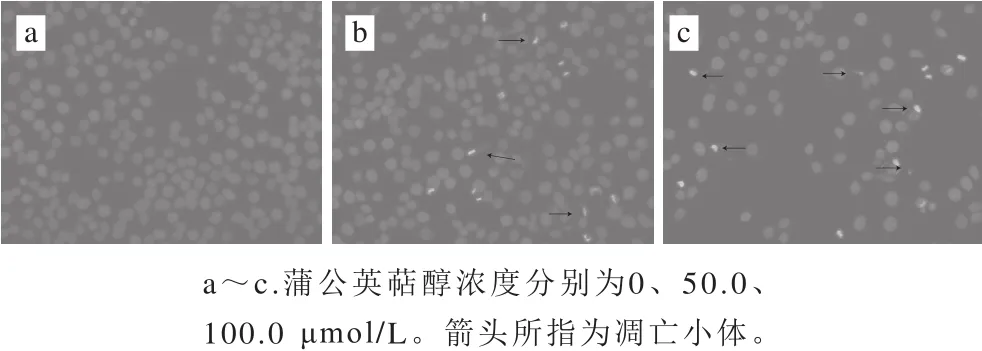
图3 Hoechst 33342染色检测蒲公英萜醇诱导MCF-7细胞发生凋亡Fig. 3 Taraxerol exacerbated the apoptosis of MCF-7 human breast cancer cells as evaluated by Hoechst 33342 staining
由图3可知,经不同浓度(50.0、100.0 μmol/L)蒲公英萜醇处理48 h后,MCF-7细胞核形态发生改变,对照组细胞形态规则且呈均匀蓝色荧光(图中未显示),染色质分散,细胞核呈椭圆形;药物组细胞数量变少,呈致密浓染,颜色发白发亮,可见染色质凝集、核固缩或碎裂为小核,形成凋亡小体等典型的细胞凋亡形态学特征。蒲公英萜醇浓度愈高,细胞凋亡愈显著。
2.4 Western blot法检测凋亡相关蛋白的表达
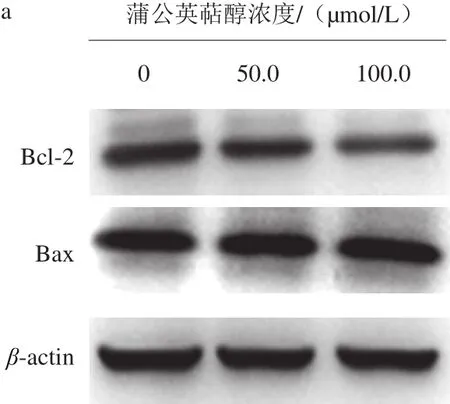
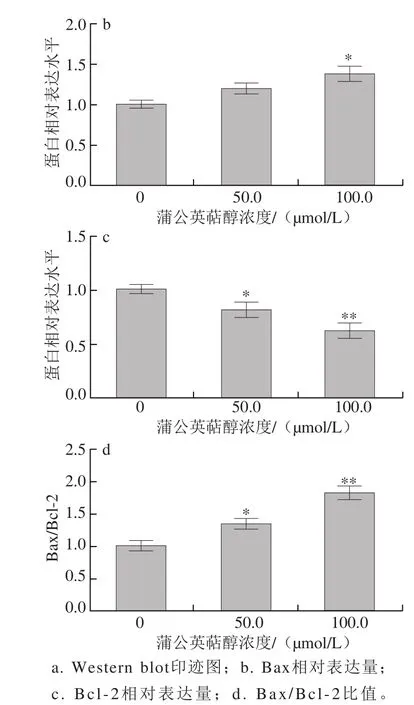
图4 蒲公英萜醇对MCF-7细胞的Bcl-2和Bax蛋白表达的影响Fig. 4 Effect of taraxerol on the expression of Bcl-2 and Bax in MCF-7 human breast cancer cells
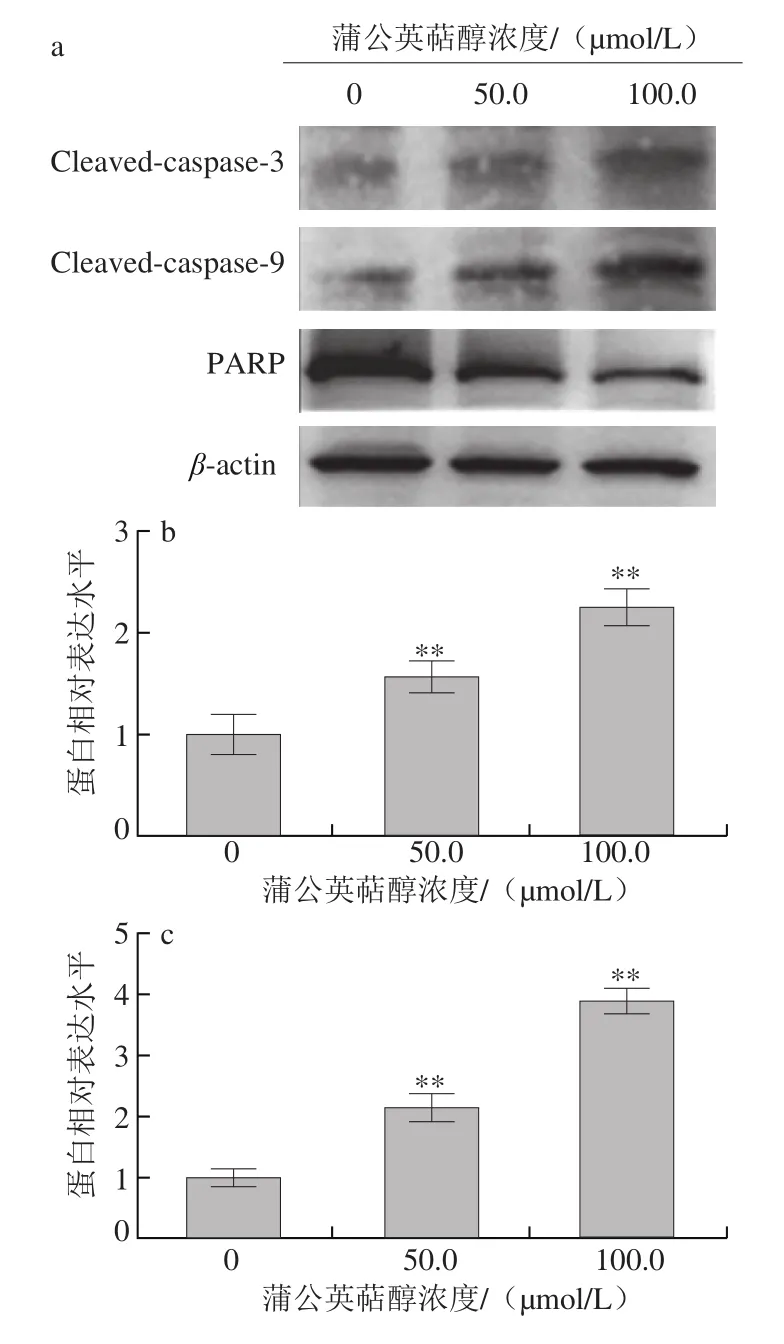
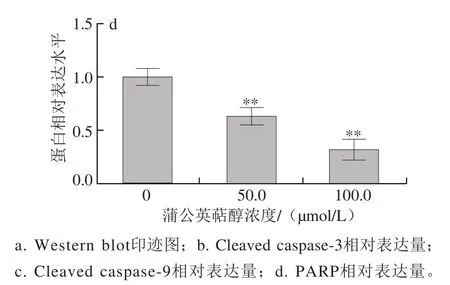
图5 蒲公英萜醇对MCF-7细胞的Cleaved caspase-3、Cleaved caspase-9和PARP蛋白表达的影响Fig. 5 Effect of taraxerol on the expression of cleaved caspase-3,cleaved caspase-9 and PARP in MCF-7 human breast cancer cells
实验结果表明,不同浓度(50.0、100.0 μmol/L)蒲公英萜醇处理48 h后Bax蛋白的表达显著上调(P<0.05),Bcl-2蛋白的表达极显著下调(P<0.01),因而Bax/Bcl-2表达极显著增加(P<0.01)(图4);同时,给药组Cleaved caspase-3、Cleaved caspase-9蛋白的表达极显著上调(P<0.01),PARP表达极显著下调(P<0.01)(图5);提示蒲公英萜醇可通过线粒体途径诱导MCF-7细胞发生凋亡。
3 讨 论
蒲公英被誉为“天然抗生素”,具有营养保健作用,有着悠久的食用和药用历史。随着对其开发利用价值的深入研究,其医疗保健功能逐渐受到重视。近年研究表明,蒲公英抗肿瘤的有效成分主要为多糖、三萜、黄酮、酚酸、植物甾醇等天然活性物质成分[11]。三萜类化合物是一类具有广泛抗肿瘤等生物活性的化合物,在自然界中资源广泛,对乳腺癌、直肠癌、肺癌等多种肿瘤均具有显著的抑制效果。蒲公英萜醇属五环三萜类化合物,本实验发现,蒲公英萜醇可抑制人乳腺癌细胞MCF-7的增殖,并通过线粒体途径诱导凋亡的方式发挥其抗肿瘤作用[12-14]。
MTT比色法是检测活细胞数量的常用方法[15],在代谢过程中,活细胞线粒体与NADP相关的脱氢酶可以将黄色的MTT还原为蓝色甲瓒结晶,通过酶标仪在490 nm波长处检测吸光度,从而检测出细胞的存活率[16-17]。本实验通过不同浓度的蒲公英萜醇处理人乳腺癌细胞MCF-7 24、48、72 h后,发现48、72 h产生明显抑制细胞增殖的作用,且该抑制作用呈浓度依赖性。细胞在体外培养的过程中,单个细胞分裂繁殖6 代以上的后代组成的细胞群体,称为集落或克隆。集落形成率表示细胞独立生存能力。因此,本实验采用平板克隆实验进一步检测蒲公英萜醇对MCF-7细胞生长抑制的影响,结果显示蒲公英萜醇能有效抑制乳腺癌细胞增殖和集落形成。
细胞凋亡是由基因控制的细胞在生理病理状态下发生的一种自发性、程序性死亡[18],它与癌症等许多疾病的发生发展有关,且诱导肿瘤细胞发生凋亡是许多抗癌药物作用的主要机制之一。细胞凋亡首先表现为形态学改变,因此细胞形态学观察成为判断细胞凋亡最基本和可靠的方法。Hoechst染色是一种经典而又快速的细胞凋亡形态学检测方法[19]。当细胞发生凋亡时,与邻周细胞脱离,胞浆聚缩,核染色体密度增加,呈半月形,且在核膜周边凝集,核仁发生裂解,细胞内陷,进而形成凋亡小体。本实验通过荧光显微镜观察结果,从形态学上证实蒲公英萜醇能够诱发MCF-7细胞凋亡,细胞核出现明显的凋亡形态学特征,且呈剂量依赖性。
有研究发现蒲公英萜醇主要通过线粒体途径诱导HeLa细胞凋亡,且可以诱导抗凋亡蛋白Bcl-2的下调和促凋亡蛋白Bax的上调[20]。Bcl-2家族是一类与凋亡密切相关的调节基因,研究表明,Bcl-2和Bax蛋白水平高低与凋亡调控直接相关,Bax与Bcl-2的比值可以决定细胞在受凋亡刺激后的生存能力[21-24]。在细胞凋亡的过程中,Caspase-3和Caspase-9常被作为细胞线粒体凋亡途径的早期检测指标,而PARP是一种DNA修复酶和最具特征性的蛋白酶解底物,当细胞损伤过度时,细胞凋亡启动使PARP发生水解[25-26]。为了进一步阐明蒲公英萜醇诱导乳腺癌发生凋亡的机制,本实验研究了凋亡相关蛋白的表达。实验结果表明,蒲公英萜醇给药组可明显上调Bax/Bcl-2比值,同时诱导Cleaved caspase-3和Cleaved caspase-9表达上调,PARP表达下调,表明蒲公英萜醇可活化Bcl-2和Bax,激活Caspase-3和Caspase-9,被激活的Caspase-3将PARP裂解,促进DNA断裂,诱导细胞凋亡[27-28]。以上结果提示蒲公英萜醇可通过线粒体途径诱导乳腺癌细胞凋亡。
综上所述,蒲公英萜醇对人乳腺癌细胞MCF-7增殖具有良好的抑制作用,并可通过线粒体途径诱导乳腺癌细胞凋亡,但对其抗肿瘤作用潜在的多种分子机制还需要进一步深入研究。

