急性缺血性卒中患者情绪、自主神经功能改变及其与神经功能缺损程度的相关性研究
文乐菊,罗华,袁志俊
急性缺血性卒中(acute ischemic stroke,AIS)是指多种原因引起局部脑供血障碍而导致的脑组织缺血缺氧坏死,近年来,焦虑、抑郁等情绪问题作为AIS患者常见并发症而逐渐受到关注[1-2]。研究表明,焦虑、抑郁不仅会影响AIS患者康复,还可能导致疾病复发率、患者病死率升高,甚至可能导致患者自杀、自残风险升高;此外,AIS患者除运动、感觉功能损伤外,还存在一定程度自主神经功能改变。交感神经皮肤反应(sympathetic skin response,SSR)是一种神经电生理学指标,可反映交感神经节后纤维功能,具有操作简便、结果客观、无创等优点,近年来已广泛用于自主神经功能异常性疾病的诊疗[3-5],但目前国内关于AIS患者情绪改变尤其是自主神经功能改变的研究报道较少见。本研究旨在分析AIS患者情绪、自主神经功能改变,并探讨其与神经功能缺损程度的相关性,现报道如下。
1 资料与方法
1.1 一般资料 选取2017年3月—2018年3月西南医科大学附属医院神经内科收治的AIS患者86例作为观察组,均于发病72 h内入院并符合《中国急性缺血性脑卒中诊治指南2014》[6]中的AIS诊断标准;另选取同期收治的非AIS患者40例作为对照组,其中血管性头痛26例,无症状性脑梗死14例。纳入标准:(1)意识清楚并能配合完成相应检查及量表;(2)发病前无明显精神异常、人格改变及认知障碍。排除标准:(1)有脑血管病病史、脑器质性疾病病史者;(2)伴有影响自主神经功能的疾病,如甲状腺功能异常、糖尿病、帕金森病、多发性硬化及周围神经病变等;(3)伴有严重躯体疾病、抑郁症、焦虑症等者;(4)检查前使用拟肾上腺素等影响自主神经功能的药物者;(5)妊娠期、哺乳期妇女及酒精、药物依赖者。对照组患者中男22例,女18例;平均年龄(58.3±9.5)岁;平均受教育年限(6.7±2.8)年。观察组患者中男50例,女36例;平均年龄(56.2±8.5)岁;平均受教育年限(6.9±2.9)年。两组患者性别(χ2=0.110)、年龄(t=-1.214)、受教育年限(t=0.406)比较,差异无统计学意义(P>0.05),具有可比性。本研究经西南医科大学附属医院医学伦理委员会审核批准,所有患者及其家属签署知情同意书。
1.2 神经功能缺损程度评估标准 入院当天采用美国国立卫生研究院卒中量表(National Institutes of Health Stroke Scale,NIHSS)对观察组患者神经功能缺损程度进行评估,其中NIHSS评分≤4分者归入轻度组(n=46),4分<NIHSS评分≤20分者归入中重度组(n=40)。
1.3 焦虑、抑郁判断标准[7]对照组患者于入组时、观察组患者于发病2周内分别采用汉密尔顿焦虑量表14项版(Hamilton Anxiety Scale-14,HAMA14)、汉密尔顿抑郁量表24项版(Hamilton Depression Scale-24,HAMD24)判断焦虑、抑郁发生情况。以HAMA14评分<7分为无焦虑,≥7分为焦虑,评分越高表明焦虑程度越重;以HAMD24评分<8分为无抑郁,≥8分为抑郁,评分越高表明抑郁程度越重。
1.4 SSR检查方法 对照组患者于入组时、观察组患者于发病2周内采用丹迪KEY POINT肌电诱发电仪进行双上肢SSR检查,具体如下:在安静的屏蔽室中使患者放松并取仰卧位,将室温控制在22~25 ℃、皮肤温度控制在32~37 ℃;SSR记录电极采用圆盘电极并置于手心,参考电极置于手背,电极间阻抗<5 kΩ,电流强度为100 mA,电刺激时程为0.2 ms,频率为0.6~60.0 Hz,分析时间为5 s,灵敏度为0.1~1.0 mV/cm,随机刺激双侧腕部正中神经,刺激间隔1 min;为减少刺激部位适应性,每例患者重复测试2次取平均值。SSR检查结果异常判断标准[8]:以对照组检查结果为参考,以未引出完整波形、起始潜伏期>(x± 2s)、波幅低于对照组最低值为SSR检查结果异常;潜伏期指刺激开始到电位偏离基线时间间隔,波幅是每次刺激形成的首个波峰到波底的垂直高度。
1.5 统计学方法 采用SPSS 17.0统计学软件进行数据分析,计量资料以(x±s)表示,采用两独立样本t检验;计数资料分析采用χ2检验或Fisher's确切概率法(双侧检验);HAMA14评分、HAMD24评分、双上肢SSR检查结果与AIS患者NIHSS评分的相关性分析采用Pearson相关分析。以P<0.05为差异有统计学意义。
2 结果
2.1 对照组与观察组患者焦虑、抑郁发生情况 对照组患者中焦虑1例(2.5%),无抑郁及焦虑并抑郁患者;观察组患者中焦虑17例(19.8%),抑郁13例(15.1%),焦虑并抑郁8例(9.3%)。观察组患者焦虑(χ2=5.313,P=0.021)、抑郁(P=0.009)发生率高于对照组,差异有统计学意义。而两组患者焦虑并抑郁发生率比较,差异无统计学意义(P=0.055)。
2.2 对照组与观察组患者双上肢SSR检查结果 对照组、观察组患者均引出完整波形。观察组患者双上肢SSR检查结果异常率高于对照组,潜伏期长于对照组,波幅低于对照组,差异有统计学意义(P<0.05,见表1)。观察组患者患侧与健侧、对照组患者左侧与右侧SSR潜伏期、波幅比较,差异无统计学意义(P>0.05,见表 2~3)。
2.3 轻度组与中重度组患者HAMA14评分、HAMD24评分及双上肢SSR检查结果比较 中重度组患者HAMA14评分、HAMD24评分高于轻度组,差异有统计学意义(P<0.05);中重度组患者双上肢SSR检查结果异常率高于轻度组,潜伏期长于轻度组,波幅低于轻度组,差异有统计学意义(P<0.05,见表4)。
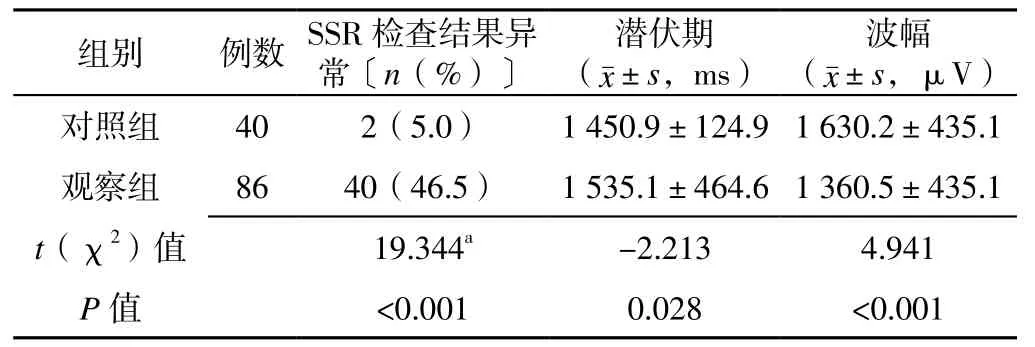
表1 对照组与观察组患者双上肢SSR检查结果比较Table 1 Comparison of SSR examination results of bilateral upper limbs between the two groups
表2 观察组患者患侧与健侧SSR检查结果比较(±s,n=86)Table 2 Comparison of SSR examination results between affected side and normal side in observation group

表2 观察组患者患侧与健侧SSR检查结果比较(±s,n=86)Table 2 Comparison of SSR examination results between affected side and normal side in observation group
肢体 潜伏期(ms) 波幅(μV)患侧 1 579.9±380.9 1 387.2±362.2健侧 1 490.4±533.9 1 333.7±412.3 t值 1.385 0.950 P值 0.170 0.345
表3 对照组患者左侧与右侧SSR检查结果比较(±s,n=40)Table 3 Comparison of SSR examination results between left side and right side in control group

表3 对照组患者左侧与右侧SSR检查结果比较(±s,n=40)Table 3 Comparison of SSR examination results between left side and right side in control group
肢体 潜伏期(ms) 波幅(μV)左侧 1 456.9±120.3 1 815.5±544.1右侧 1 444.9±130.6 1 730.5±514.8 t值 0.434 0.711 P值 0.667 0.481
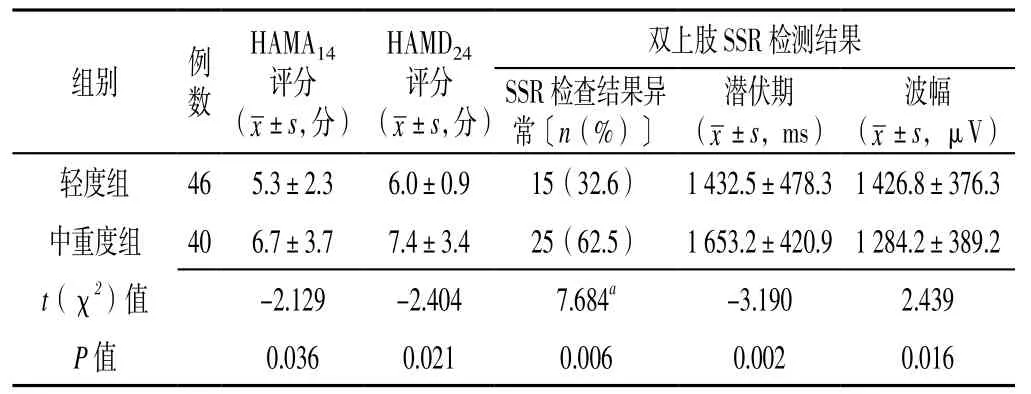
表4 轻度组与中重度组患者HAMA14评分、HAMD24评分及双上肢SSR检查结果比较Table 4 Comparison of HAMA14 score,HAMD24 score and SSR examination results of bilateral upper limbs in AIS patients with different severity of illness
2.4 相关性分析 Pearson相关分析结果显示,HAMA14评分、HAMD24评分、双上肢SSR潜伏期与AIS患者NIHSS评分呈正相关(r值分别为0.285、0.330、0.305,P<0.01),而双上肢SSR波幅与AIS患者NIHSS评分呈负相关(r=-0.309,P<0.01)。
3 讨论
焦虑、抑郁是AIS患者最常见的情绪问题,AYERBE等[9-10]研究结果显示,卒中后焦虑、抑郁发生率呈动态改变,会在不同程度上影响卒中患者病死率、复发率。研究表明,AIS患者自主神经功能改变主要表现为高血压、体位性或发作性低血压、心律失常、膀胱和大肠功能紊乱、出汗异常等[11]。部分研究者认为,自主神经功能紊乱是导致AIS患者猝死的重要原因[12],而严重的自主神经功能紊乱预示着卒中后1年内血管并发症发生风险较高、患者预后较差[13]。
焦虑、抑郁均属情感障碍,发生机制较为复杂,主要与单胺能系统异常、额叶-皮质下回路损伤、下丘脑-垂体-肾上腺轴激活、神经炎症及神经营养因子信号通路改变等有关。研究表明,单胺类神经递质尤其是去甲肾上腺素(NE)和5-羟色胺(5-HT)与人类精神活动尤其是情感活动密切相关,NE和5-HT在焦虑、抑郁的发生发展过程中具有重要作用[14-16];急性脑组织缺血性损伤会导致额叶皮质、基底核、丘脑、杏仁核等部位神经通路损伤并导致NE和5-HT运输阻断、生物胺含量持续下降,从而引发焦虑、抑郁等不良情绪[17]。
既往研究结果显示,卒中后1个月内焦虑发生率为20%,且约31%的患者在卒中后5年内可能发生抑郁[18-20]。本研究于患者入院2周内完成焦虑、抑郁评估,结果显示,AIS患者焦虑发生率为19.8%,抑郁发生率为15.1%,焦虑并抑郁发生率为9.3%,表明AIS患者焦虑、抑郁发生率较高;中重度组患者HAMA14、HAMD24评分高于轻度组,且HAMA14评分、HAMD24评分与AIS患者NIHSS评分呈正相关,与MENG等[21]研究结果一致,证实焦虑、抑郁情绪与AIS患者神经功能缺损程度有关,分析其可能原因为脑组织损伤越重则神经功能缺损越重,对参与情绪反应的神经递质影响也越大。目前,卒中后焦虑、抑郁的确切发生机制尚不完全明确,但多数研究者认为生物学与社会心理学因素的相互影响、相互作用可能具有关键作用;DE RYCK等[22]通过一项前瞻性纵向流行病学研究结果显示,生物学因素主要决定急性抑郁,而社会心理学因素对卒中后1~2年发生抑郁的影响较大。
SSR根据人体交感神经支配发汗原理评估交感神经节后C类(胆碱能)无髓鞘小纤维的传导功能,是在皮肤上记录到的瞬时电位,主要反映交感神经节后纤维功能[3],主要观察波形、潜伏期和波幅,其中潜伏期可反映引起发汗的神经冲动在整个反射弧中的传导时程,而波幅可反映交感神经纤维与汗腺的兴奋程度;潜伏期延长、波幅降低或波形缺失提示自主神经功能障碍。本研究结果显示,观察组患者双上肢SSR检查结果异常率高于对照组,潜伏期长于对照组,波幅低于对照组,与既往研究结果一致[8,23];观察组患者患侧与健侧、对照组患者左侧与右侧潜伏期、波幅间无统计学差异,提示AIS患者双上肢SSR潜伏期、波幅均基本对称。分析AIS患者出现双上肢SSR改变的可能原因如下:AIS可导致网状结构通路改变,而网状结构通路是经一侧皮质投射到双侧的,因此单侧皮质损伤即可导致双侧网状结构及功能改变,主要表现为双侧SSR抑制性改变[24]。本研究结果还显示,中重度组患者双上肢SSR检查结果异常率高于轻度组,潜伏期长于轻度组,波幅低于轻度组,且SSR潜伏期与AIS患者NIHSS评分呈正相关、SSR波幅与AIS患者NIHSS评分呈负相关,提示AIS患者存在自主神经功能障碍,且与患者神经功能缺损程度有关。
综上所述,AIS患者焦虑、抑郁发生率较高并存在自主神经功能障碍,且与患者神经功能缺损程度有关,临床合理运用神经心理测试量表及SSR检查有利于早期识别AIS患者情绪、自主神经功能改变,进而指导患者的康复治疗;但本研究样本量较小且为单中心研究,同时由于临床条件有限而未进行随访,研究结果仍需要进一步研究证实。
作者贡献:文乐菊、罗华进行文章的构思与设计;文乐菊进行研究的实施与可行性分析,撰写论文,进行数据收集、整理与分析;文乐菊、袁志俊进行结果分析与解释;罗华、袁志俊进行论文修订;罗华负责文章的质量控制及审校,对文章整体负责并监督管理。
本文无利益冲突。

