麦冬皂苷D预处理对PM2.5介导肺泡Ⅱ型上皮细胞炎性损伤的抑制作用及其机制
王莹,宋磊,孙立燕,张珍珍,丁会
(吉林大学白求恩第一医院,吉林长春130021)
大气细颗粒物(PM2.5)即空气动力学直径≤2.5 μm的细颗粒物,是工业化飞速发展的毒性产物。正常情况下,短期低浓度PM2.5吸入可被气道表面的黏液吸附,并通过纤毛摆动排出;而长期高浓度PM2.5吸入可损伤气道上皮,降低其清除能力,导致PM2.5堆积并停留在呼吸道;且部分PM2.5可穿透气-血屏障入循环系统,引起和加重肺、心血管乃至整个机体的损伤[1]。研究证实,吸入PM2.5浓度与呼吸道疾病发病率呈正相关[2,3],而NF-κB诱导炎症介质表达是PM2.5引起炎症反应的主要机制[4]。麦冬皂苷D是从麦冬中提取的一种甾体皂苷类化合物[5,6]。王亮等[7]发现,麦冬皂苷D可通过抑制NF-κB信号通路对小肠上皮细胞产生抗炎作用,但其是否可以减轻PM2.5诱导的气道炎症反应及其作用机制尚不清楚。为此,我们于2017年12月~2018年4月进行了如下研究。
1 材料
细胞:肺泡Ⅱ型上皮细胞MLE-12购于中国科学院上海细胞所。主要试剂:麦冬皂苷D(含量质量分数≥98%,中国Biotoppe公司),PM2.5、DMEM培养基(美国Corning公司),FBS、PBS、双抗、胰蛋白酶、CCK-8试剂盒(中国Transgen公司)、二甲基亚砜、细胞核蛋白提取试剂盒(美国Sigma公司),小鼠细胞上清 TNF-α、IL-1β、IL-6、IL-8 ELISA 试剂盒(中国Bpro公司),BCA蛋白浓度测定试剂盒、ECL试剂盒(美国Thermo公司),NF-κB p65一抗、GAPDH、HRP-goat anti-rabbit IgG、FITC Goat anti-Rabbit(美国ABclonal公司)。
2 方法与结果
2.1 PM2.5悬浊液及麦冬皂苷D溶液配制 ①PM2.5悬浊液:使用颗粒采样器采集大气PM2.5于玻璃纤维滤膜(孔径2.5 μm)上,滤膜剪裁成直径约1 cm的小片滤膜,浸泡在无菌蒸馏水中。水浴超声仪中超声震荡 60 min,得到含有PM2.5的悬浊液,无菌纱布过滤,真空冷凝法干燥,再用无菌PBS配置成PM2.5悬浊液。应用前超声震荡灭菌30 min,使颗粒物充分混匀。②麦冬皂苷D溶液:将麦冬皂苷D用DMSO配成质量浓度为10 μmol/L的原液,实验时再用DMEM培养基稀释至所需浓度(DMSO浓度小于总体积的0.01%)。
2.2 麦冬皂苷D安全用药范围观察 采用CCK-8法。将MLE-12细胞接种于含10% FBS的DMEM培养基中,37 ℃、5% CO2恒温培养箱中培养。取对数生长期的MLE-12细胞,以5×103个/mL接种于96孔板,每孔100 μL,恒温培养箱中培养24 h。每孔中加入麦冬皂苷D,使其终浓度分别为0、5、10、20、40、80、160、320 μmol/L。以不含药物的细胞为阴性对照组,以含DMSO培养基的细胞为空白对照组,分别加入含0.01% DMSO的细胞培养液,每组设4个复孔。37 ℃孵育24 h,加入CCK-8溶液10 μL/孔。作用2 h后使用酶标仪检测490 nm处的吸光度(A)值。细胞活性=(A药物组-A空白对照组)/(A阴性对照组-A空白对照组)×100%。结果显示,加入终浓度分别0、5、10、20、40、80、160、320 μmol/L麦冬皂苷D的MLE-12细胞活性分别为(100.37±1.02)%、(101.29±3.04)%、(100.05±2.53)%、(96.65±2.54)%、(96.87±2.80)%、(95.09±1.53)%、(88.53±1.95)%、(77.18±2.95)%;麦冬皂苷D浓度≤80 μmol/L时对MLE-12细胞活性无明显影响(P均>0.05),麦冬皂苷D浓度≥160 μmol/L时MLE-12细胞活性明显下降(P均<0.01)。选取10、20、40、80 μmol/L麦冬皂苷D进行后续实验。
2.3 麦冬皂苷D预处理对PM2.5介导的MLE-12细胞炎性因子及NF-κB p65表达影响的观察
2.3.1 麦冬皂苷D预处理 取对数生长期MLE-12细胞,调整细胞密度为3×105个/mL,接种于6 孔板,每孔3 mL。将MLE-12细胞随机分为空白对照组、PM2.5组及麦冬皂苷D组,麦冬皂苷D组分别加入浓度为10、20、40、80 μmol/L麦冬皂苷D预处理1 h。预处理后麦冬皂苷D组及PM2.5组分别加入PM2.5混悬液,并调整其终浓度为80 μg/mL,作用24 h;空白对照组不作任何处理。
2.3.2 细胞培养基上清炎性因子表达检测 采用ELISA法。干预24 h 收集各组细胞培养基上清,标准品稀释后加样、温育、洗涤、酶标显色,每组设4个复孔,同时设置空白孔消除背景差异。严格按照ELISA试剂盒说明书操作,检测各组培养基上清中TNF-α、IL-1β、IL-6、IL-8的表达量。加终止液后10 min内检测各组450 nm波长处的光密度(OD)值,根据样品的OD值由标准曲线公式计算相应浓度。结果显示:PM2.5组培养基上清IL-1β、IL-6、IL-8和TNF-α表达均明显高于空白对照组(P均<0.01),加入80 μmol/L麦冬皂苷D的麦冬皂苷D组培养基上清IL-1β、IL-6、IL-8、TNF-α表达均低于PM2.5组(P均<0.01)。加入不同浓度麦冬皂苷D的麦冬皂苷D组培养基上清IL-8、TNF-α表达均高于对照组,加入10、20、40 μmol/L麦冬皂苷D的麦冬皂苷D组培养基上清IL-1β、IL-6表达均高于对照组(P<0.05或<0.01)。加入80 μmol/L麦冬皂苷D的麦冬皂苷D组培养基上清IL-1β、IL-6表达与对照组比较差异均无统计学意义(P均>0.05)。见表1。
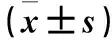
表1 各组培养基上清炎性因子表达比较
注:与PM2.5组比较,*P<0.01;与对照组比较,#P<0.05,△P<0.01。
2.3.3 细胞核及细胞质NF-κB p65蛋白表达检测 采用Western blotting法。干预24 h收集各组细胞,按细胞核蛋白提取试剂盒说明加入裂解液,依次提取细胞质蛋白和细胞核蛋白。BCA法进行蛋白定量,加入上样缓冲液煮沸变性10 min,经SDS-PAGE、转膜、封闭;加入NF-κB p65兔源一抗(稀释倍数为1∶1 000),4 ℃过夜,PBST洗3次后加入HRP标记的抗兔二抗(稀释倍数为1∶5 000),室温孵育1 h,PBST洗3次。加入ECL显影液显色,化学发光凝胶成像系统下显影成像,Image J软件对目的条带进行灰度扫描。细胞核NF-κB p65蛋白以lamin B为内参,细胞质NF-κB p65蛋白以GAPDH为内参;以目的蛋白条带灰度值与内参条带灰度值的比值计算目的蛋白相对表达量。结果显示,PM2.5组细胞核NF-κB p65蛋白相对表达量高于对照组,细胞质NF-κB p65蛋白相对表达量低于对照组(P均<0.01);加入不同浓度麦冬皂苷D的麦冬皂苷D组细胞质NF-κB p65蛋白相对表达量均高于PM2.5组,加入20、40、80 μmol/L麦冬皂苷D的麦冬皂苷D组细胞核NF-κB p65蛋白相对表达量均低于PM2.5组(P均<0.01)。见表2。
3 讨论
研究发现,麦冬皂苷D在人肺癌细胞中可通过调节NF-κB、PI3K/AKT及AP-1等多种信号通路,抑制肿瘤细胞增殖及化疗增敏性,发挥抗肿瘤作用[8];通过调节Wnt/β-catenin信号通路,抑制氧化应激改善糖尿病患者钛合金植入物的成骨融合[9];还可通过下调CYP2J2/EETs系统相关因子表达发挥抗炎作用[10]。近期研究发现,麦冬皂苷D可通过上调细胞色素450表氧化酶基因表达而抑制体内炎症反应,从而减轻大鼠心肌肥厚[11]。本研究结果显示,麦冬皂苷D干预浓度≤80 μmol/L时对MLE-12细胞活性无明显影响,≥160 μmol/L时则可导致细胞活性明显下降;表明高浓度麦冬皂苷D对MLE-12细胞生长具有明显抑制作用,其安全用药范围为≤80 μmol/L,此时细胞毒性较小。
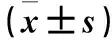
表2 各组细胞核及细胞质NF-κB p65蛋白相对表达量比较
注:与PM2.5组比较,*P<0.01;与对照组比较,#P<0.05,△P<0.01。
PM2.5能刺激肺上皮细胞及免疫细胞,促进局部炎症因子TNF-α、IL-6及IL-1等释放,启动炎症级联反应及放大肺组织局部炎症反应[12~14]。本研究结果显示,PM2.5组培养基上清IL-1β、IL-6、IL-8、TNF-α表达均高于对照组,说明PM2.5可导致MLE-12细胞发生炎性损伤;加入80 μmol/L麦冬皂苷D的麦冬皂苷D组培养基上清IL-1β、IL-6、IL-8、TNF-α表达均低于PM2.5组,说明80 μmol/L麦冬皂苷D可明显减轻PM2.5引起的MLE-12细胞炎性损伤。本研究加入不同浓度麦冬皂苷D的麦冬皂苷D组IL-8、TNF-α表达均高于对照组,加入10、20、40 μmol/L麦冬皂苷D的麦冬皂苷D组IL-1β、IL-6表达均高于对照组,而加入80 μmol/L麦冬皂苷D的麦冬皂苷D组IL-1β、IL-6表达与对照组比较差异均无统计学意义;说明安全范围内高浓度麦冬皂苷D可减轻PM2.5引起的MLE-12细胞炎性损伤,以80 μmol/L麦冬皂苷D的作用效果最好。
NF-κB是一种广泛表达的炎症调节转录因子,其中NF-κB p65是NF-κB的活性形式,在某些有效刺激的作用下,激活的NF-κB会迅速由细胞质进入细胞核,结合至TNF-α、IL-1β、IL-6等多种促炎基因启动子区的作用位点,从而激活上述基因的转录翻译,导致多种炎症因子的表达和释放增加,促进炎症的发生;同时这些炎性因子反过来又可以激活NF-κB,形成恶性循环,导致广泛而持续的炎症损伤[15]。细胞内NF-κB p65总量处于恒定水平,细胞核内活性NF-κB p65蛋白表达升高必然伴随细胞质内表达降低,也伴随NF-κB相关信号通路的启动激活。本研究结果显示,PM2.5组细胞核NF-κB p65蛋白相对表达量明显高于对照组,而细胞质NF-κB p65蛋白相对表达量低于对照组,说明PM2.5介导的MLE-12细胞发生炎性损伤可能与NF-κB入核及其相关信号通路激活有关。本研究中加入10、20、40、80 μmol/L麦冬皂苷D的麦冬皂苷D组细胞质NF-κB p65蛋白相对表达量均高于PM2.5组,并呈剂量依赖性升高,而其细胞核NF-κB p65蛋白相对表达量则呈相反趋势;加入80 μmol/L麦冬皂苷D的麦冬皂苷D组细胞核NF-κB p65蛋白相对表达量明显低于PM2.5组并与对照组无统计学差异;说明麦冬皂苷D可抑制PM2.5介导的MLE-12细胞NF-κB入核及其相关信号通路激活,以80 μmol/L浓度时的效果最明显。
综上所述,麦冬皂苷D预处理可减轻PM2.5引起的MLE-12细胞炎性损伤,80 μmol/L浓度时作用最明显且细胞毒性较小;其机制可能与抑制NF-κB p65入核及其相关信号通路激活有关。

