利用大酱中的枯草芽孢杆菌提高人参中Rg3含量的研究
李铉军,张先,付长雪,李范洙


摘要:为探究枯草芽孢杆菌固态发酵人参对人参内稀有皂苷Rg3含量的影响,本实验首先以七叶苷修饰过的LB营养琼脂为选择培养基,从大酱中分离得到的200株枯草芽孢杆菌菌株中筛选出10株产β葡萄糖苷酶的枯草芽孢杆菌。然后用pNPG法分别测得10种菌种产β-葡萄糖苷酶的酶活力,选取酶活力最高的58号菌进行培养,并对58号菌的最适产酶条件进行研究,得到58号菌的最佳培养时间为16 h,最适产酶温度36℃,最适产酶pH值6.0,最佳产酶时间8 h。在最适条件下,用58号菌对双螺杆挤压后的人参进行固态发酵,以白参为参照。结果表明在第4d时,白参内Rg3含量最高,为0.6236 mg/g,比发酵前提高了53.75%。在第4d时,双螺杆挤压后的人参内Rg3含量最高,为0.8442 mg/g,比发酵前提高了70.99%。
关键词:枯草芽孢杆菌;人参;Rg3
中图分类号: R284.1 文献标识码: A DOI编号: 10.14025/j.cnki.jlny.2018.18.026
人参为五加科人参属多年生草本植物。是一种传统的名贵中草药,在我国具有悠久的药用历史,被誉为“百草之王”。《神农本草经》是现存最早的中药学专著,据其记载人参具有“补五脏、安精神、定魂魄、止惊悸、除邪气、明目益智,久服轻身延年”之功效。人参中的主要活性成分之一是人参皂苷,已知的人参皂苷有40余种。白参中含量最高的人参皂苷为Rb1、Rb2、Rd、Rg1、Re、Rf等[1]。红参含量高的二醇类皂苷Rb1、Rb2、Rc、Rd 等, 加工过程中转化为Rg3 、Rg5、Rh2、Rh3 等稀有皂苷;含量高的三醇类皂苷Rg1、Re、Rf 等, 转化为Rg2、Rg4 、Rh1、Rh4 等稀有皂苷[2]。这些稀有皂苷具有很高的生理活性,尤其在抗肿瘤方面显示了独特的作用,但是其人参内含量普遍很低。为此,本实验致力于研究微生物法固态发酵人参以增加其内稀有皂苷Rg3、Rd的含量。
多年来,各国科学研究者围绕人参单体皂苷制备,从化学法[3]、组织培养法、人参发根诱导培养法、酶法[4]、微生物发酵法等方面进行了探索,并在某些方面取得了进展,但目前大多停留在实验室阶段。微生物发酵是利用微生物细胞产生的一种或多种酶将外源底物进行催化使其转变成结构相关的经济价值更高的产物,这是物理或化学方法难以实现的生化反应。微生物发酵法主要包括液体发酵和固体发酵两种。液体发酵是将底物人参皂苷从生药中提取出来,在液体环境下利用微生物产生水解酶进行的发酵方法。固体发酵工艺是指在几乎没有自由水存在下,在有一定湿度的水不溶性固体基质中,用一种或多种微生物发酵的生化反应过程[5]。
人参皂苷的固体发酵是将人参等中药材作为营养基质,通过微生物的生理活动与生化反应过程对人参皂苷进行结构修饰,产生新的生物活性成分和新的功能。这是一个双向发酵的过程。具有活性成分的药性基质被微生物发酵,提供微生物维持生命所需的营养物质,促进菌体生长分裂。同时又能因菌体代谢产生的酶而改变人参皂苷的原有结构,转化为活性更高的稀有人参皂苷。近年研究者开始将药用真菌或食用细菌作为发酵菌株对人参进行双向发酵。无须将微生物与发酵产物分离,二者共同发挥药物活性,克服了其他皂苷转化方法分离纯化困难、产率低等缺点。工艺简单,质量易于控制,次级人参皂苷含量丰富,适宜工业化生产。
1 材料与方法
1.1 试验材料
试验原料为白参和双螺杆挤压后的人参,所用菌种来自于从朝鲜族大酱中提取出的200株枯草芽孢杆菌。
1.2 试剂与药品
对硝基苯基-β-D-吡喃葡萄糖苷(上海晶纯生化科技股份有限公司);
七叶苷(上海源叶生物科技有限公司);
LB营养琼脂(北京奥博星生物技术有限责任公司);
LB营养肉汤(北京奥博星生物技术有限责任公司);
其余乙酸、乙酸钠、对硝基苯酚、碳酸钠,无水正丁醇,无水甲醇(天津市科密欧化学试剂有限公司)。
1.3 试验仪器
SW-CJ-1FD 超凈工作台(上海新苗医疗器械机械制造有限公司);
SX-700 高压蒸汽灭菌锅(日本TOMY公司);
NU-9668E 超低温冷冻箱(美国NUAIRE公司);
JA-3100 精密电子天平(深美仪器有限公司);
FA1004 电子天平(上海良平仪器仪表有限公司);
DHG-907385-Ⅲ 电热恒温鼓风干燥箱(上海新苗医疗器械制造有限公司);
KQ-500DE 医用数控超声波清洗器(昆山市超声仪器有限公司);
HH-8 数显恒温水浴锅(金坛市科析仪器有限公司);
TDL-5000B 冷冻离心机(上海安亭科学仪器厂);
DZF-6050 真空干燥箱(上海新苗医疗器械制造有限公司);
SHB-ⅢA 循环水式多用真空泵(上海豫康科技仪器设备有限公司);
UV-1800 紫外/可见分光光度计(上海美谱达仪器有限公司);
40目网筛。
1.4 菌种的活化和筛选
1.4.1 枯草芽孢杆菌的活化:采用划线法[6] 制作平板在超净工作台中将灭菌后的LB营养趁热倾倒在无菌培养皿中。水平在灭菌后的工作台上,冷凝后加盖保存;菌体培养:将200株菌种从冷藏箱中取出后,在超净工作台中划线接入平板中,在37℃培养24h于恒温培养箱中;菌种活化:将200个菌种继代培养3次,进行纯化。
1.4.2 产β-葡萄糖苷酶菌株的筛选 将200株枯草芽孢杆菌分别接种在添加了七叶苷和柠檬酸铁的LB营养琼脂平板中,在37℃恒温培养箱中培养24h。七叶苷显色的原理为:七叶苷在β-葡萄糖苷酶的作用下能够水解为七叶苷元(6,7-二轻香豆素)和葡萄糖,当七叶苷元遇到游离的铁离子时会产生黑色物质[7-8]。借此筛选出能够产生葡糖苷酶的菌株。
1.4.3 对硝基苯酚标准曲线的绘制 准确称取对硝基苯酚1.39mg,溶解于蒸馏水中并定容至100mL。取 6个10mL容量瓶,分别吸取 1mL、2mL、3mL、4mL、5mL、6mL 对硝基苯酚溶液至 1~6 号瓶,用蒸馏水定容并混匀。则1~6 号瓶对应的对硝基苯酚浓度为0.01mmol/L、0.02mmol/L、0.03mmol/L、0.04mmol/L、0.05mmol/L、0.06mmol/L。
分别取不同浓度的对硝基苯酚溶液2mL,再加入1mL 1mol/L碳酸钠溶液充分混匀,以蒸馏水为对照,紫外分光光度计在40nm的条件比色记录值,横坐标为对硝基苯酚的浓度,绘制标准曲线。
1.4.4 β-葡萄糖苷酶活性测定 β-葡萄糖苷酶活性测定采用pNPG法[9-10],pNPG法是以对硝基苯酚-β-葡萄糖苷为底物,β-葡萄糖苷酶可以在酸性条件下使其水解生成对硝基苯酚,对硝基苯酚在碱性条件下为黄色,后用比色法测定并计算出β-葡萄糖苷酶活力。
取0.1mL粗酶液,加入0.9mL pH 5.0的0.2mol/L乙酸-乙酸钠缓冲溶液,于37℃水浴预热,10分钟后加入已预热10 min的1mL 5 mmol/L pNPG溶液,精确计时10min后立即加入1mL 1mol/L 碳酸钠溶液终止反应,室温放置5min冷却,于400nm处测吸光值OD。以加热失活的酶液为空白对照。
在此条件下,酶的活性(U)被定义为酶每分钟分解pNPG 释放出 1 mol 对硝基苯酚所需要的酶量。
1.5 枯草芽孢杆菌酶学性质研究[11-12]
1.5.1 枯草芽孢杆菌生长曲线的确定 将枯草芽孢杆菌液体培养12h后,制成种子液。吸取1ml种子液接种于装有50mL LB肉汤的锥形瓶中,摇匀后置于37℃培养24h,以未接种的培养基为空白对照,每隔4h在600nm处测定培养液的吸光度值。以时间为横坐标,吸光度值为纵坐标,绘制枯草芽孢杆菌生长曲线。
1.5.2 枯草芽孢杆菌产β-葡萄糖苷酶最佳培养时间的确定
分别吸取1mL种子液于8组装有25mL LB肉汤的锥形瓶中摇匀,pH自然,密封在37℃条件下恒温摇床培养。分别在0h、4h、8h、12h、16h、20h、24h时,将培养液于无菌离心试管中,在4000 r/min下离心10min,制得粗酶液,测定酶活。实验重复3次,取平均值。
1.5.3 枯草芽孢杆菌产β-葡萄糖苷酶最佳培养pH的确定
分别吸取1mL种子液于9组装有25mL LB肉汤的锥形瓶中,调节LB肉汤pH值分别为4.0、4.5、5.0、5.5、6.0、6.5、7.0、7.5、8.0,在37℃条件下恒温摇床培养24h。后将培养液于无菌离心试管中,在4000r/min下离心10min,制得粗酶液,测定酶活。实验重复3次,取平均值。
1.5.4 枯草芽孢杆菌产β-葡萄糖苷酶最佳培养温度的确定
分别吸取1mL种子液于6组装有25mL LB肉汤的锥形瓶中,pH自然,在28℃、31℃、34℃、37℃、40℃、43℃下摇床培养24h后,将培养液于无菌离心试管中,在4000r/min下离心10min,制得粗酶液,测定酶活。实验重复3次,取平均值。
1.6 人参固态发酵及稀有皂苷测定
1.6.1 枯草芽孢杆菌固态发酵人参 取活化后的枯草芽孢杆菌1mL接种至20mL LB肉汤培养基中,以36℃、150rpm/min条件下恒温摇床中培养16h,制成种子液;将双螺杆挤压后的人参和白参粉碎后过40目筛;取过筛后的人参4g加5mL LB肉汤培养基混合均匀后置于高压灭菌锅中,灭菌处理;冷却后,加入0.25mL种子液,密封后置于36℃恒温培养箱中培养1~5天,每隔24h测定一次人参皂苷;实验分为十组,双螺杆挤压后的人参五组,白参五组,各组三个平行。
1.6.2 稀有人参皂苷Rg3的提取與检测[13-17]
将发酵后的人参从培养箱中取出,干燥后,研磨成均匀颗粒大小,过40目筛;称取2g发酵人参粉放入平底烧瓶,加入80%甲醇溶液,在80℃下回流提取3h,取上清液,此操作重复两次;所得提取液用旋转蒸发仪减压回收甲醇(温度不超过60℃);减压回收后,浸膏挂于烧瓶内部,加20mL蒸馏水溶解;所得水溶液再加20mL水饱和正丁醇溶液,置于离心管中;在4000rpm下离心萃取10min,重复三次,取上清液并合并;将所得上清液在60℃下旋转蒸发,减压回收正丁醇液,蒸干后残留物即为总皂苷粗品;在旋干后的烧瓶中加入2mL甲醇溶液溶解,过滤,得待测样品;HPLC法[18]测定皂苷含量。
2 结果与分析
2.1 产β-葡萄糖苷酶的菌株筛选
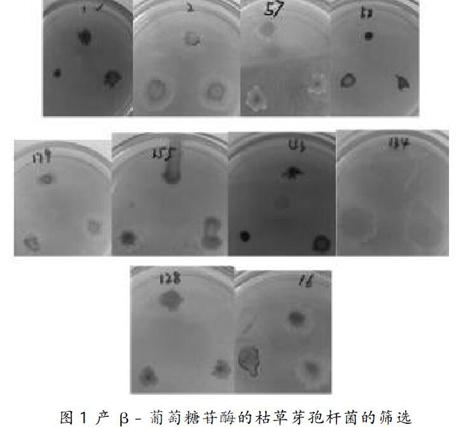
在枯草芽孢杆菌进行产β-葡萄糖苷酶的菌株筛选时,菌落周围出现黑色水解斑的菌株为最终的目的菌。筛选结果如下图 1 所示,200株中有10株产β-葡萄糖苷酶。
结果如图1所示,200株枯草芽孢杆菌中在七叶苷选择培养基下共筛出10株显色菌株,1、58、153三株显色较深,其余6株显色较浅,剩余191株不显色。
2.2 对硝基苯酚标准曲线
根据1.4.4中的方法,酶活力计算公式为:U=C×N/(10×0.1)
注:U:酶活力(IU/mL) 10:反应时间(min)
N:原酶液稀释倍数 0.1:添加酶液体积(mL)
C:对硝基苯酚含量,为对硝基苯酚的标准曲线上的值,见图2。
根据上图的标准曲线,得到对硝基苯酚标准曲线的回归方程为:y=10.834x+0.0155,相关系数 R2=0.9989(y为对硝基苯酚的吸光度,x为对硝基苯酚的浓度)。
2.3 不同菌株产β-葡萄糖苷酶活力测定结果
对10株筛选后的菌株进行β-葡萄糖苷酶活力测定结果如图3所示:
由图3可知,第58号菌株为产β-葡萄糖苷酶活力最高的菌株,因此选择58号菌为人参固态发酵的发酵菌株。
2.4 枯草芽孢杆菌酶学性质研究
2.4.1 枯草芽孢杆菌的生长曲线
由图4可知,58号枯草芽孢杆菌在4~8h为生长对数期,繁殖速度最快;在12h后趋于稳定,此时繁殖速度与死亡速度几乎持平;而16h后,由于营养物质及生长空间的匮乏,细菌数急速下降,繁殖速度滞后,死亡率升高。
2.4.2 培养时间对枯草芽孢杆菌产β-葡萄糖苷酶的影响 由于酶的产量会受菌液培养时间长短的影响,所以在37℃下,对菌液进行恒温摇瓶培养。分别在0h、4h、8h、12h、16h、20h、24h时,对菌液进行摇匀离心,测定其酶活力,以最高酶活100%计算。结果如图5所示:
由图5可知,枯草芽孢杆菌在0~4h时酶活力缓慢增加;4~8h时产酶量迅速增加,酶活力增长速度快;在8h时达到产酶量的峰值;继续培养后,酶活性开始逐渐下降。
2.4.3 pH值对枯草芽孢杆菌产β-葡萄糖苷酶的影响 不同来源菌株其最适pH值是不同的,只有在特定的pH值范围内才会表现出最大活性,即为所谓的最适pH值。在不同pH值条件下对菌液进行恒温培养,测定酶活力。酶活以最高100%计算。结果如图6所示:
由图6所知,菌株在pH为7.0时,酶活力最强。在pH值低于7.0的条件下,酶活性随着pH值的提高而增强;在pH值高于7.0的情况下,酶活性随着pH值的升高而减弱。
2.4.4 温度对枯草芽孢杆菌产β-葡萄糖苷酶的影响 每一种酶在一定条件下,只在某一特定温度时才表现出最大的活性,即所谓的最适温度。温度和pH值对酶的活性的影响是相互依赖的[9]。所以,反應必须控制在恒温条件下进行,且所有试剂应预热到所需要的温度。本实验将菌液pH调至7.0,分别考察菌液在28℃、31℃、34℃、37℃、40℃、43℃下酶活力的变化。酶活以最高为100%计算。结果如图7所示:
由图7所知,菌株在反应温度为37℃时,酶活性达到峰值。在低于此温度条件下,酶活性随着反应温度的升高而增强;在高于此温度条件时,酶活性则随着反应温度的升高而减弱。
2.5 人参内稀有皂苷Rg3的含量及分析
为了研究枯草芽孢杆菌固态发酵人参对人参内稀有皂苷Rg3含量的影响,在发酵菌最适产酶条件下,对处理后的人参粉进行固态发酵,并且每隔24h对其进行稀有皂苷含量的测定,最终比较人参发酵前后人参内Rg3含量的变化情况。本实验采用HPLC法测量Rg3的含量,原料为双螺杆挤压后的人参,白参为对比参照。具体实验结果如表1和图8所示:
由表1和图8可得,双螺杆挤压后的人参中Rg3的含量一直高于普通白参,未发酵时提高了20.56%,发酵后提高了35.38%,说明双螺杆挤压后的人参在发酵时更有利于Rg3的生成,从而导致在发酵后Rg3含量增加。
由表1和图8可知,双螺杆挤压后的人参在发酵第四天时,Rg3含量最高,相比较发酵前Rg3含量提高70.99%。双螺杆挤压后的人参在发酵的第1~4d,Rg3的含量随着发酵时间的延长而增加,在第四天含量达到峰值,从第五天开始,Rg3的含量开始随时间增加而减少。白参同样在发酵的第四天时,Rg3含量到达峰值,与发酵前含量相比较提高了58.75%。白参内Rg3含量在发酵的1~4d呈上升趋势,第五天开始有所下降。
人参在发酵过程中均出现了发酵的1~2d时Rg3含量低于未发酵时,经过2d发酵后,人参内Rg3含量开始急速上升直至超过发酵前人参内Rg3含量的现象。在王洪峰[20]等对人参双向发酵过程中总皂苷和总多糖含量的研究中,人参皂苷Rb1的C20位置处的糖苷键会在发酵过程水解断裂变成Rg3,从而使Rg3含量增加。陈[13]等在枯草芽孢杆菌转化人参总苷为Rg3的研究中提出β-葡萄糖苷酶水解人参皂苷Rb1 C20位点处的葡萄糖苷,形成Rg3和1分子葡萄糖,最终使Rg3含量增加。对于发酵第1天出现Rg3含量低于发酵前的情况,猜测发酵前期细菌生长需要大量营养物,Rg3可能出现逆水解反应生成营养物以供细菌的生长繁殖;细菌数稳定后,β-葡萄糖苷酶开始发挥作用,此时Rg3含量开始快速增加,即发酵2~4d;随着细菌数的增加,营养物质减少,细菌内部出现竞争生长,此时可能又会出现Rg3的逆水解反应,Rg3开始减少,细菌所需营养物有所增加,即出现发酵第五天Rg3含量开始下降的现象。
3 结论
本实验从200株枯草芽孢杆菌中筛选出10株产β-葡萄糖苷酶的菌株,随后使用pNPG法分别测得此10个菌株的酶活力,并从中选取酶活力最高的58号菌株为最终发酵菌株。然后,对58号菌进行了酶学性质研究,得出58号菌在培养8h后β-葡萄糖苷酶活性达到最高,产酶最适pH值为7.0,最适温度为37℃。在枯草芽孢杆菌最适产酶条件下,对人参进行固态发酵,最终得到在发酵第四天时,双螺杆挤压后的人参和白参中Rg3含量达到最高。发酵后,双螺杆挤压后的人参内Rg3含量提高了70.99%,白参内Rg3含量提高了53.75%。且发酵前,人参经双螺杆挤压后Rg3含量提高了20.56%;发酵后,双螺杆挤压后的人参相较于白参Rg3含量提高了35.38%。
实验证明,枯草芽孢杆菌固态发酵法提高了人参内稀有皂苷Rg3含量。
参考文献
[1]王铁生.中国人参[M].沈阳:辽宁科学技术出版社,2001,671-695.
[2]陈业高,吕瑜平,桂世鸿等.三七叶甙制备原人参二醇及其差向异构体[J].精细化工,2003,20(07):425-426.
[3]刘娜,朴虎日,赵余庆.稀有抗肿瘤人参皂苷衍生物的制备与分离中草药,2009,32(05):707-709.
[4]姜彬慧,韩颖,赵余庆,等.酶转化三七叶总苷制备人参皂苷C-K的工业优化.中草药,2004,35(09):986-988.
[5]王兴红,李祺德.微生物发酵中药应成为中药研究的新内容[J].中草药,2001,32(03):112-116.
[6]Dai Chun-chao,Yuan Sheng, Shi Yang. Effect of strain Storing and reculturing conditions on the cephalosporium sp. mycelium's fatty acid composition. Food science.2004,25(03):75-81.
[7]何海燕,秦燕娜,麻琼英,林玲,蓝青萍,覃拥灵.蜡状芽孢杆菌PX16的筛选及产β-葡萄糖苷酶的条件优化[J].贵州农业科学,2014,42(02):119-122.
[8]Kwon K,Lee J, Kang H G, et al.Detection of β-Glu-cosidase Activity in Polyacrylamide Gels with Esculinas Substrate[J]. Applied and environmental microbiology,1994(12):4584-4586.
[9]劉泽玉,苏柘僮,杨明,邹文栓.马蓝叶中β-葡萄糖苷酶的提取及酶学性质的研究[J].中草药,2010,41(09):1461-1464.
[10]姚卫蓉,丁霄霖.pNPG法测定纤维素酶系中β-葡萄糖苷酶[J].微生物学通报,1998,25(03):182-183.
[11]秦艳,李卫芬,黄琴.枯草芽孢杆菌发酵条件的优化[J].饲料研究,2007(12):70-74.
[12]Miyake H, Otsuka C, et al. Catalytic mechanism of beta-amylase from Bacillus cereus var. mycoides: chemical rescue of hydrolytic a catalytic site mutant by azide [J]. Biochem, 2002, 131(04):587-591.
[13]陈,张美萍,王义,孙亮,王康宇,等.枯草芽孢杆菌转化人参总苷为Rg3的研究[J].时珍国医国药,2014,25(11),2676-
2678.
[14]曲正义,赵景辉,刘宏群,姚春林,王英平.活性参中人参总皂苷含量的测定[R].吉林省第七届科学技术学术年会,401-
402.
[15]陈文悦.人参制品中人参皂苷测定方法的评价[J].旅行医学科学,1995,1(03):107-109.
[16]程慧,宋新波,张丽娟.人参皂苷Rg3与Rh2的研究进展[J].药物评价研究,2010(04):307-311.
[17]马小琼,鱼红闪,田兵等.人参皂苷的分离方法[J].大连轻工业学院学报,1999,18(01):39-43.
[18]刘桂燕,刘墨祥,于连贵,等.HPCL法测定西洋参果浆及其发酵液中人参皂苷Rg3的含量[J].吉林农业大学学报,2001,
23(01):61-64.
[19]Xu Lu, et al. Eff ects of soy isoflavones on lymphocyte act ivation and natural killer cells activity in vitro of rats [J] .Chin J New Durgs Clin Rem. 2002,21(09): 513-517.
[20]王洪峰,朱凯,田健,周默,邱智东.人参双向固体发酵过程中化学成分的变化[J].吉林农业大学学报,2013,35(03):312-
316.
作者简介:李铉军,硕士,讲师,研究方向:食品分析。
通讯作者:李范洙,朝鲜族,博士,副教授,研究方向:农产品深加工研究。

