复合酶促桂花酒澄清工艺研究
周 伟,骆德伟
(1.杭州顶津食品有限公司,浙江杭州 310018;2.吉首大学化学化工学院,湖南吉首 416000)
0 引言
桂花酒(Chinese rice wine) 是以糯米和金桂花等为主要原料,经蒸煮、加曲、糖化、发酵、压榨、澄清、过滤、煎酒、贮藏和勾兑而成的酿造酒。它酒性醇和、营养丰富,其含有的糖、肽、氨基酸等低分子浸出物和微量元素易被人体消化吸收,是深受人们喜爱的滋补酒、饮料酒和调味酒。但由于桂花酒的营养成分特别丰富,酒体中含有较多的蛋白质、多酚(单宁)、脂肪、焦糖色素和多糖等大分子成分,酒体贮存期间较易发生混浊、沉淀,传统的棉饼、硅藻土或纸板过滤往往很难获得理想的澄清效果[1-2]。因此,结合传统工艺,利用木瓜蛋白酶和果胶酶复合酶法对酒体进行澄清处理,以提高桂花酒的稳定性及品质[3-5]。
1 材料与方法
1.1 试验材料
传统手工桂花酒,3年陈酿,购于湖南省怀化市洪江区;木瓜蛋白酶(酶活力50 000 U/g)、果胶酶(酶活力100 000 U/g),江苏锐阳生物科技有限公司提供;乙酸、碳酸氢钠,均为分析纯。
1.2 仪器与设备
HH-S2型恒温水浴锅,金坛市成辉仪器厂产品;FA2004型电子天平,上海舜宇恒平科技仪器有限公司产品;OU-2550型紫外可见分光光度计,日本岛津公司产品;U/GZX-9070 MBE型鼓风干燥箱,上海博讯实业有限公司医疗设备厂产品;PHSJ-4A型pH计,上海精密科学仪器有限公司产品;5810R型台式冷冻离心机,德国艾本德公司产品。
1.3 样品检测与工艺流程
1.3.1 桂花酒的酶处理澄清工艺流程
酶处理桂花酒的澄清工艺流程为:使用碳酸氢钠溶液或乙酸对样品桂花酒进行pH值调试,加入相应浓度的酶,在适当温度条件下进行反应,一段时间后使用台式冷冻离心机以转速6 500 r/min离心10 min,于波长660 nm处的吸光度(吸光度即表示澄清度)[6]。
1.3.2 样品pH值和吸光度检测
检测桂花酒pH值和吸光度(即于波长660 nm处所测吸光度)。
1.3.3 木瓜蛋白酶的单因素试验
(1)酶添加量。将样品酒调至pH值为4,酶添加量依次为0,0.1%,0.3%,0.5%,0.7%,并在温度50℃条件下3 h水浴处理后,测定其吸光度。
(2) pH值。取调节pH值后的桂花酒,木瓜蛋白酶酶解能力在偏酸性条件较强,因此pH值分别为3.0,3.5,4.0,4.5,5.0,在已确定酶添加量的基础上,桂花酒在酶解温度50℃,处理3 h后,测定其吸光度,确定pH值。
(3)酶处理温度。改变木瓜蛋白酶处理的温度40,45,50,55,60℃,在已确定的条件基础上,酶反应时间3 h,测定其吸光度。
(4)酶反应时间。取前面的其他因素的最佳条件下进行酶反应时间1,2,3,4,5 h的确定。1.3.4 果胶酶的单因素试验[7]
(1) 酶添加量。将样品桂花酒调至pH值为4,加入酶添加量依次为0,0.1%,0.3%,0.5%,0.7%,在酶反应温度50℃,处理3 h后,测定其吸光度。
(2) pH值。取桂花酒相应pH值(果胶酶的作用pH值为2.5~6.0),由于过酸性影响酒的口感和气味,所以选择pH值的范围为3.0,3.5,4.0,4.5,5.0,在酶添加量确定的条件下,酶反应温度50℃,处理3 h后,测定其吸光度。
(3)酶处理温度。改变果胶酶的处理温度40,45,50,55,60℃,在酶添加量和pH值确定的条件下,反应3 h后测定其吸光度。
(4) 酶反应时间。取其他因素的最佳条件(酶添加量0.5%,反应温度40℃,pH值3) 改变酶反应时间1,2,3,4,5 h,并测定其吸光度。
2 结果与分析
2.1 木瓜蛋白酶处理样品酒的单因素的确定
2.1.1 酶添加量对澄清度的影响
木瓜蛋白酶添加量对澄清度的影响见图1。
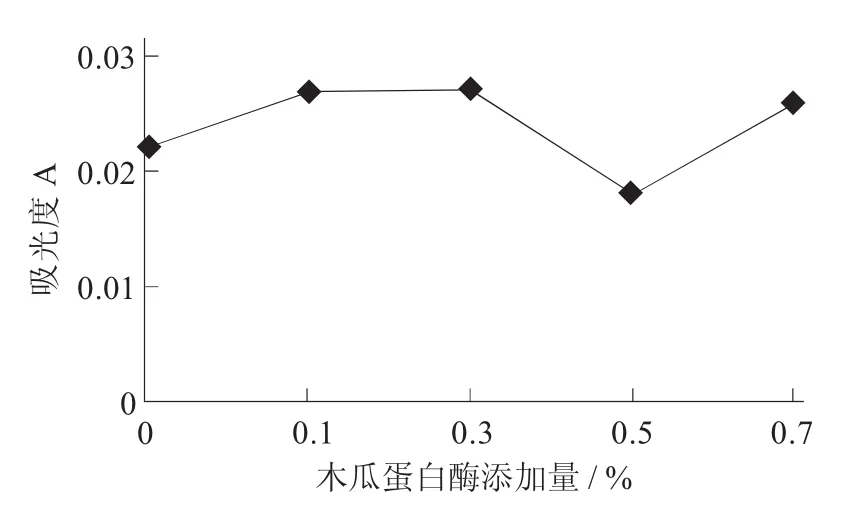
图1 木瓜蛋白酶添加量对澄清度的影响
由图1可知,木瓜蛋白酶处理桂花酒样品的澄清效果随着酶添加量的增加而变化,样品的澄清度在酶添加量为0.5%时达到最佳。由试验结果可得,在酶添加量比较小时,酶的处理达不到有效的效果,反而会使桂花酒更加浑浊;反之酶添加量过大,虽然有澄清效果,但是成本过高。综合各方面的因素,同一条件下进行木瓜蛋白酶的处理,因此选择酶添加量0.5%左右。
2.1.2 桂花酒pH值对澄清度的影响
桂花酒pH值对木瓜蛋白酶澄清效果的影响见图2。
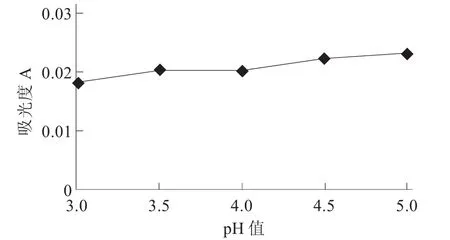
图2 桂花酒pH值对木瓜蛋白酶澄清效果的影响
由图2可知,在相同条件下对桂花酒进行pH值调节,随着pH值的不断增加,酒体的澄清度也在不断下降,在pH值为3时,桂花酒的澄清度最高。因此,在相同酶添加量时,pH值为3时澄清效果最佳。
2.1.3 酶处理温度对澄清度的影响
木瓜蛋白酶处理温度对澄清度的影响见图3。
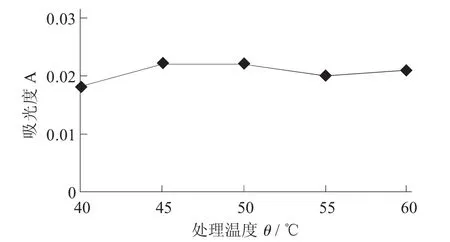
图3 木瓜蛋白酶处理温度对澄清度的影响
由图3可知,得到桂花酒的澄清度随着处理温度的不断变化而发生波动,酶处理温度为40℃时,其澄清效果最佳。
2.1.4 酶反应时间对澄清度的影响
木瓜蛋白酶反应时间对澄清度的影响见图4。
在各条件达到最优条件时,酶反应4 h时桂花酒的澄清度达到最佳。因此,在单因素试验中所得最佳条件为酶添加量0.5%,pH值3,在酶处理温度40℃条件下处理4 h时的澄清度为最佳。
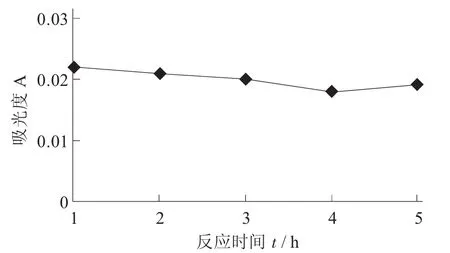
图4 木瓜蛋白酶反应时间对澄清度的影响
2.2 果胶酶处理样品酒的单因素的确定
2.2.1 酶添加量对澄清度的影响
果胶酶酶添加量对澄清度的影响见图5。
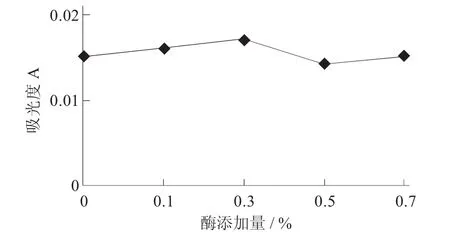
图5 果胶酶酶添加量对澄清度的影响
由图5可知,样品桂花酒的澄清度在不断变化,澄清度在酶添加量为0.5%时达到最佳。由试验结果可得,在酶添加量比较小时,酶的处理达不到有效的效果,会使桂花酒浑浊;反之酶添加量过大,虽然有澄清效果,但是成本过高。综合各方面的因素,选择酶添加量为0.5%左右。
2.2.2 桂花酒pH值对澄清度的影响
桂花酒pH值对果胶酶澄清效果的影响见图6。
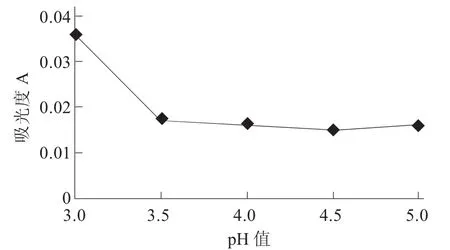
图6 桂花酒pH值对果胶酶澄清效果的影响
由图6可知,调节样品pH值在相同条件下对溶液进行处理,随着pH值的不断增加,桂花酒的澄清度也在不断下降,在pH值为4.5时,溶液的澄清度最高。因此,在pH值为4.5时,添加同等酶添加量对样品的澄清效果最佳。
2.2.3 酶处理温度对澄清度的影响
酶处理温度对澄清度的影响见图7。
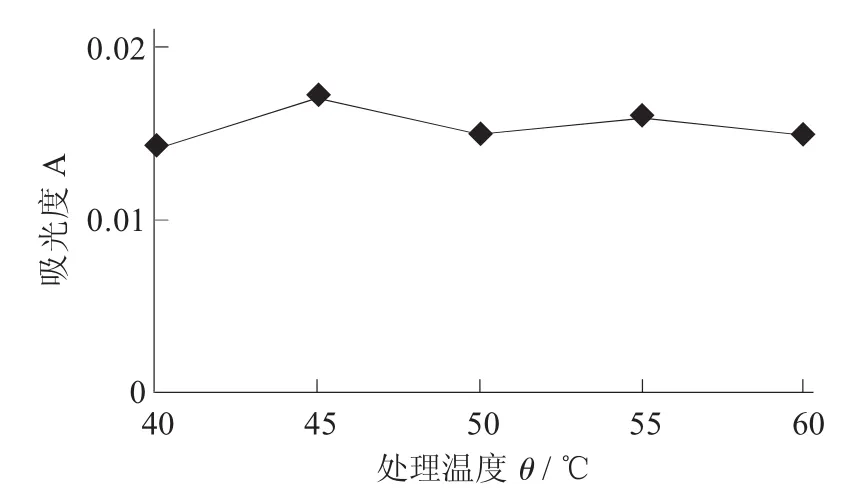
图7 酶处理温度对澄清度的影响
经过对酶处理温度的单因素试验,得到酒体的澄清度随着酶处理温度的不断变化而发生波动,当酶处理温度为40℃时,桂花酒的澄清效果最佳。
2.2.4 酶反应时间对澄清度的影响
果胶酶反应时间对澄清度的影响见图8。
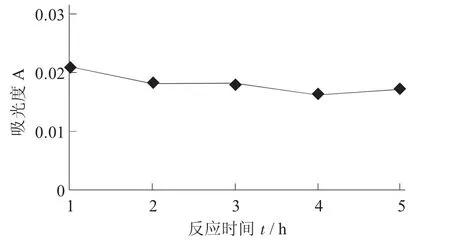
图8 果胶酶反应时间对澄清度的影响
当各条件为最优条件时,样品酒的澄清度反应4 h时达到最佳。因此,在单因素试验中所得最佳条件为酶添加量0.5%,pH值4.5,在酶处理温度40℃条件下反应4 h时的澄清度为最佳。
2.3 正交试验设计
在木瓜蛋白酶处理样品酒的单因素试验中得出,最佳的条件为酶添加量0.5%,酶处理温度40℃,酶反应时间4 h,pH值3时,酒体的澄清效果最好;而果胶酶处理样品酒的单因素试验中得出,最佳的条件为酶添加量0.5%,酶处理温度40℃,酶反应时间4 h,pH值4.5时,酒体的澄清效果最好。因此,木瓜蛋白酶和果胶酶处理样品酒的正交试验表中各因素确定为在单因素试验中得到的最佳条件为参照值,成为1个五因素四水平的正交表。
不同因素作用下的澄清度正交试验设计见表1,不同因素作用下的澄清度正交试验结果见表2。
2.4 复合酶澄清工艺的优化
正交试验结果表明,5个影响因素的R大小排列为E>B>D>C>A,由此可见,极差R越大对试验效果的影响越大,即对桂花酒的澄清度的影响越大,即pH值>酶处理温度>酶反应时间>酶添加量>酶量比。最佳的试验方案为A2B4C1D1E4,即最佳的复合酶澄清传统手工桂花酒的工艺条件为酶处理温度50℃,pH值4.5,酶添加量0.1%,酶反应时间1 h,酶量比1∶2。在此最佳条件下的澄清度为0.015,在原酒的条件上提高了28.6%。
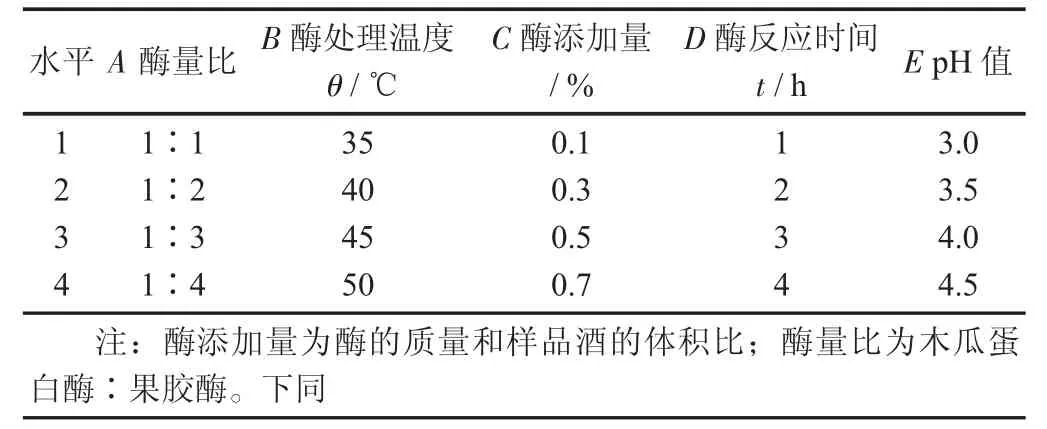
表1 不同因素作用下的澄清度正交试验设计
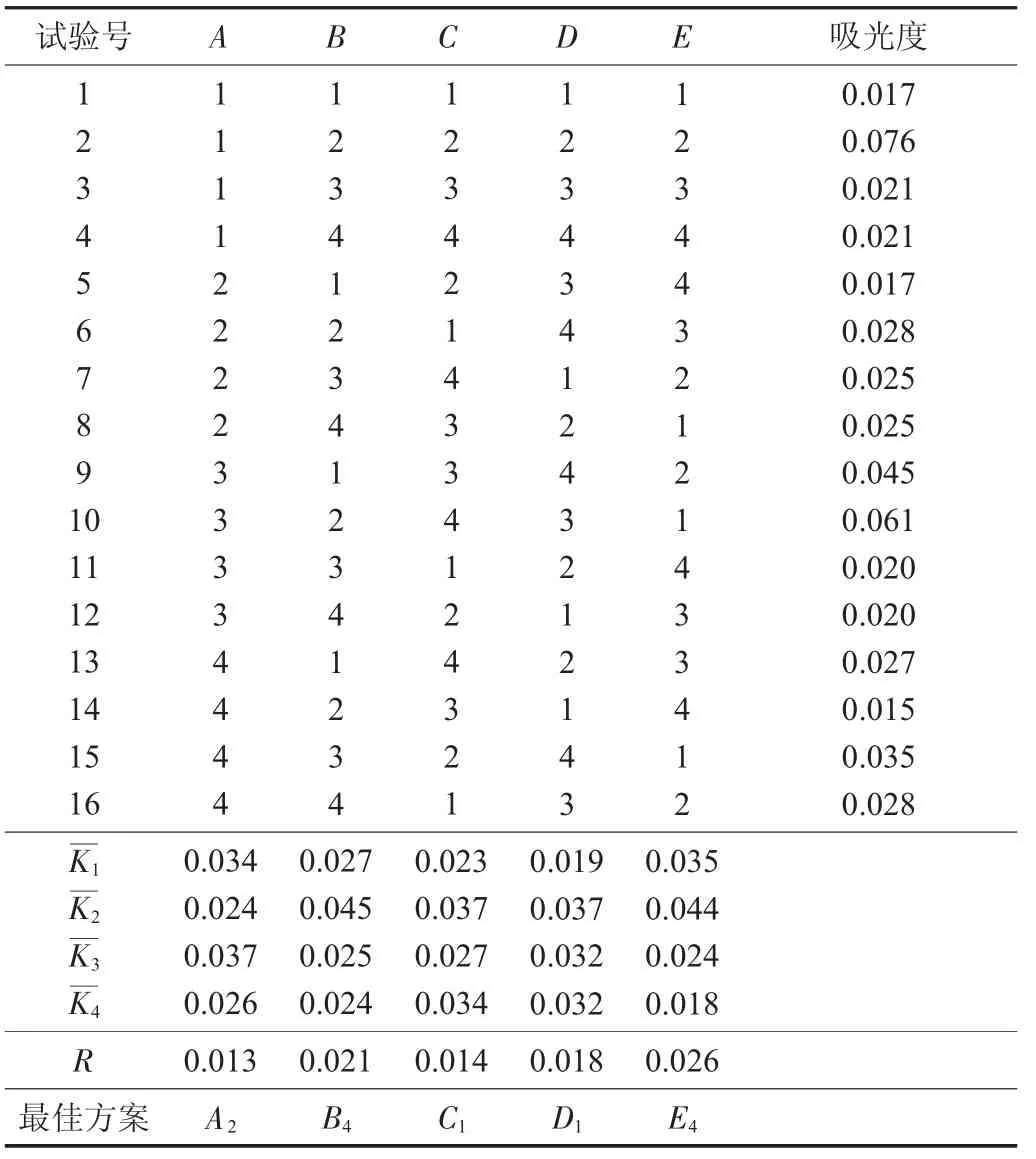
表2 不同因素作用下的澄清度正交试验结果
3 结论
根据试验结果可知,对木瓜蛋白酶4个影响因素的单因素试验结果为酶添加量0.5%,酶处理温度40℃,酶反应时间4 h,pH值3时,澄清度最低,澄清效果最好;果胶酶的单因素试验中得到酶添加量0.5%,酶处理温度40℃,酶反应时间4 h,pH值4.5时澄清效果最好。影响复合酶处理和澄清桂花酒5个因素影响的正交试验结果为pH值>酶处理温度>酶反应时间>酶添加量>酶量比,即最佳提取工艺条件为酶处理温度50℃,pH值4.5,酶添加量0.1%,酶反应时间1 h,酶量比1∶2,此时桂花酒的澄清度提高了28.6%。

