癌胚抗原相关黏附分子1对人支气管上皮细胞增殖、迁移及炎症因子的影响
程文栋 张娜
(青海省人民医院呼吸科,青海 西宁810007)
慢性阻塞性肺疾病(Acute Exacerbation of Chronic Obstructive Pulmonary Disease,AECOPD)常由细菌、病毒、环境污染物等诱发,并导致气道炎症及损伤。气道表面上皮细胞损伤后反应包括上皮细胞完整性的破坏、部分脱落,甚至是基底膜的完全脱落。随后上皮修复、再生并恢复功能,其机制涉及上皮基底细胞的迁移、上皮细胞的增殖与分化等。探讨支气管上皮细胞在AECOPD发生中的功能改变,对于AECOPD发病机制的研究十分重要。为研究CEACAM1对支气管上皮细胞功能的影响,本实验探讨CEACAM1对HBE细胞的增殖、迁移以及炎症因子产生等方面的作用。
1 材料与方法
1.1 材料 细胞系:人支气管上皮细胞株HBE来自中国科学院细胞库。主要试剂:IFN-γR&D Systems 公司;siRNA-CEACAM1GenePharma公司;siRNA-NCGenePharma公司;lipofectamin2000Invitrogen公司;Opti-MEM I Reduced Serum MediumGibco公司;RPMI-1640培养基Hyclone 公司;二甲亚讽(DMSO)Sigma公司;Trizol ReagentInvitrogen公司 ;DNase (RNase Free) water Invitrogen公司Sangon 公司 ;PrimeScript RT reagent KitTaKaRa公司;SYBR Premix Ex TaqTaKaRa公司;引物合成Sangon 公司;CCK-8试剂盒Beyotime 公司;其余试剂均为国产分析纯。
1.2 方法
1.2.1 siRNA转染 HBE细胞 转染方法按Lipofectamine 2000产品说明书进行。转染前1天进行细胞铺板,将1×105个HBE细胞接种于24孔板(6孔板4×105个),每孔内加入 500μl(6 孔板 2ml)无抗生素的 1640 培养基。Lipofectamine2000轻轻摇匀。按照每孔取1μl(6孔板4μl)Lipofectamine2000加入 50μl(6孔板 200μl)Opti-MEM I Reduced Serum Medium比例稀释,轻轻混匀后,室温孵育5min。按照每孔2μl(6孔板8μl)siRNA加入 50μl(6孔板 200μl)Opti-MEM I Reduced Serum Medium比例稀释,轻轻混匀后。5min后,将稀释的Lipofectamine2000 与稀释的 siRNA混合,轻轻混匀,室温静置20min,以形成siRNA-转染试剂混合物。将 siRNA-转染试剂混合液加入含细胞及培养液的孔内,轻轻摇晃孔板混匀。置于37℃、5%CO的培养箱中培养,6小时后更换为含血清的1640培养基。
1.2.2 Real-time PCR PCR检测引物如下:CEACAM1:Forward Primer:5’-GCTGGCATTGTGATTGGAGTA-3’;Reverse Primer:5’-TTAGGTGGGTCATTGGAGTG-3’;IL-6:Forward Primer:5’-GACAGCCACTCACCTCTTCAG-3’;Reverse Primer:5’-CATCCATCTTTTTCAGCCATC-3’;IL-8:Forward Primer:5’-TTGCCAAGGAGTGCTAAAGAA-3’;Reverse Primer:5’-GCCCTCTTCAAAAACTTCTCC-3’;MCP-1:Forward Primer:5’-AGGAACCGAGAGGCTGAGA-3’;Reverse Primer:5’-GGAATGAAGGTGGCTGCTAT-3’;TGF-β:Forward Primer:5’-GCCAGAGTGGTTATCTTTTGATG-3’;Reverse Primer:5’-AGTGTGTTATCCCTGCTGTCAC-3’;VEGF:Forward Primer:5’-AGGGCAGAATCATCACGAAGT-3’;Reverse Primer:5’-AGGGTCTCGATTGGATGGCA-3’。具体实验步骤严格按照试剂盒说明进行。
1.2.3 细胞划痕试验 HBE细胞培养于24孔板,转染 siRNA并用IFN-γ刺激24小时后,观察细胞达完全汇片。 用 10μl枪头比着直尺,每孔划出“+”字型两道划痕。 用PBS清洗细胞3次,尽量冲去划痕中漂浮的细胞。 加入无血清培养基,置于37℃,5%CO2的培养箱中培养。分别于0h、3h、6h、12h、24h、48h、72h于倒置显微镜下观察,并拍照。计算划痕面积,按以下公式计算划痕愈合度:愈合度=(S0-St) /S0×100%(S0:0时间点时的划痕面积;St:测定时间点时的划痕面积)。
1.2.4 CCK-8(Cell Counting Kit-8)测定细胞增殖 HBE细胞培养于 96孔板内,转染 siRNA,并分别于 IFN-γ 刺激 0h、24h、48h、72h进行检测。每孔内加入CCK-8 溶液 10μl。于37℃细胞培养箱内孵育1~2h。置于酶标仪,于450nm检测吸光度,吸光度与细胞数目呈线性相关。
1.3 统计学分析 统计软件用SPSS16.0,多组差别比较用单因素方差分析(One-way ANOVA test),结果以±表示,两组间差别比较用Student’s t-test 检验进行,以P<0.05表示差异有统计学意义。
2 结果
2.1 IFN-γ作用HBE细胞24小时后IL-6、IL-8、TGF-β、VEGF的表达 IFN-γ作用于HBE细胞24小时后进行Real-timePCR检测,发现IL-6及IL-8显著上调,而TGF-β与VEGF无显著变化。因此选择IL-6及IL-8进行下一步实验,见表1。
注:与HBE组相比,①P<0.05
2.2 siRNA干扰CEACAM1表达后IFN-γ作用HBE细胞24小时IL-6、IL-8的表达 用不同浓度IFN-γ刺激HBE细胞24小时,可见阴性参照(NC组)IL-6与IL-8的mRNA表达水平均有所升高。而siRNA干扰(CEACAM1组)的IL-6与IL-8表达水平与IFN-γ刺激无关,且与同等浓度IFN-γ刺激的NC组相比,其表达水平显著下降。提示IFN-γ诱导IL-6与IL-8表达有赖于CEACAM1的存在,见表2。
2.3 细胞划痕试验 转染siRNA-CEACAM1干扰CEACAM1表达后,与空白对照及siRNA-NC组相比,HBE细胞划痕愈合变慢。计算愈合度并绘制曲线发现,空白对照组与siRNA-NC组愈合度随时间变化增长幅度相近,而siRNA-CEACAM1组相比NC组及空白对照组,其愈合度明显较低。提示CEACAM1可促进HBE细胞的迁移,见表3,图1。
表2HBE细胞转染siRNA-CEACAM1后IFN-γ作用24小时IL-6、IL-8表达
Table2ExpressedbyIL-6andIL-8ofHBEcellstransfectedwithsiRNA-CEACAM1byIFN-γ

组别IL-6IL-8IFN-γ 0ng/ml NC组1.99±0.061.02±0.04 siRNA-CEACAM12.65±0.171.93±0.25IFN-γ 10ng/ml NC组5.98±0.24①②3.02±0.14①② siRNA-CEACAM12.24±0.181.89±0.12
注:与ong/ml NC组相比,①P<0.05;与0ng/ml IFN-γ相比,②P<0.05
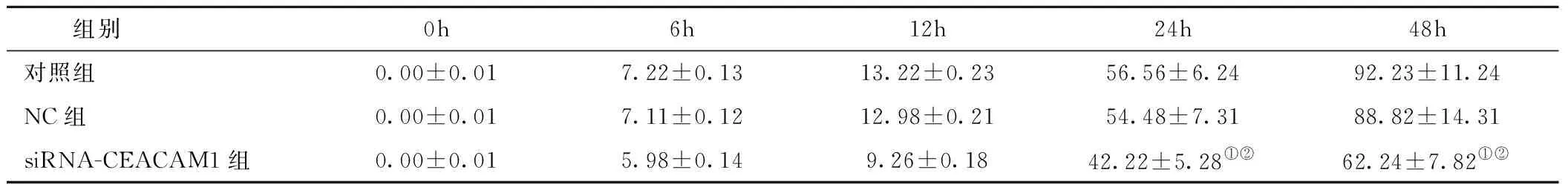
表3 各组细胞划痕面积计算所得愈合度(×10-2)Table 3 The healing degree calculated with scratch area
注:与对照组相比,①P<0.05;与NC组相比,②P<0.05

图1 细胞划痕试验观察CEACAM1对HBE细胞迁移的影响(×40)Figure 1 Effect of CEACAM1 on migration of HBE cells
2.4 CCK-8试验测定CEACAM1对HBE细胞增殖的影响 转染siRNA-CEACAM1及NC组与空白对照组相比,细胞增长率明显减慢。而比较NC组与siRAN-CEACAM1组发现,在24小时时几乎无差异,但在48小时开始两组间差异明显(P<0.05),siRNA-CEACAM1组细胞增长率较NC组显著减慢,因此认为siRNA-CEACAM1可减慢HBE细胞增殖,从而提示在IFN-γ环境下,CEACAM1可促进HBE细胞的增殖,见表4。
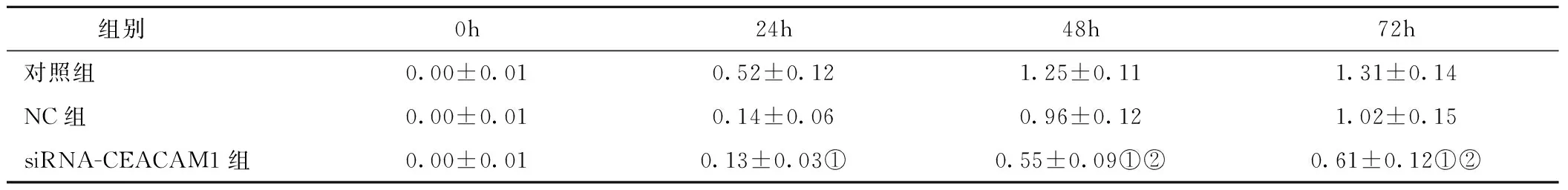
表4 CCK-8实验检测细胞增长率(×10-2)Table 4 CCK-8 test detected cell growth rate
注:与对照组相比,①P<0.05;与NC组相比,②P<0.05
3 讨论
COPD急性加重往往伴随着细菌、病毒等病原体的感染或环境污染物的吸入等所导致的气道炎症反应。以往的研究发现,在AECOPD患者的外周血及肺组织中,有多种炎症因子的水平发生显著变化[1-2]。其中白介素-6(interleukin-6, IL-6)、白介素-8(interleukin-8, IL-8)、血管内皮生长因子(vascular endothelial growth factor, VEGF)、转化生长因子-β(transforming growth factor-β, TGF-β)等炎症因子,均被发现与AECOPD密切相关。
与稳定期COPD患者或健康人群相比,IL-6水平在AECOPD患者外周血及痰标本中均显著升高[3],并且与COPD严重程度密切相关[4]。有研究发现,在病毒或流感嗜血杆菌感染的小鼠中,IL-6明显升高[5]。Jacques等在巨噬细胞中抑制CEACAM1表达后IL-6的水平无明显改变,因此提出IL-6的表达不依赖于CEACAM1[6]。而我们的研究发现,在HBE细胞中抑制CEACAM1后 IL-6表达水平较对照组明显降低,提示在HBE细胞中,IFN-γ通过诱导CEACAM1表达从而上调IL-6。
AECOPD患者中,血浆IL-8在内的趋化因子水平也有所升高[7]。有研究发现,在微血管内皮中CEACAM1过表达可导致IL-8的升高[8]。我们的研究发现,抑制CEACAM1的表达可阻断IFN-γ诱导的IL-8水平升高,提示IFN-γ是通过上调CEACAM1水平从而诱导IL-8的表达。VEGF在COPD患者外周血中的表达也有所升高[9],尤其是在慢支型COPD患者中[10]。并且VEGF水平的升高与FEV1数值呈负相关,认为VEGF参与气道重塑[11],而从急性期恢复后VEGF降低至稳定期水平[3]。有研究发现,在微血管内皮中CEACAM1过表达可导致VEGF的升高,并推测CEACAM1具有促进血管生成的作用[8]。TGF-β也被认为参与AECOPD的发生,TGF-β/smad 信号通路与COPD患者气道炎症及气道重塑的发生密切相关[12]。而在我们的研究中发现,IFN-γ作用HBE细胞后对VEGF或TGF-β无显著的调控作用,因此我们推测VEGF与TGF-β的表达不依赖IFN-γ的作用。
AECOPD的病理过程中,除了炎症因子水平的变化,还涉及气道表面的上皮细胞在损伤后的一系列反应,包括上皮细胞完整性的破坏、脱落以及损伤后修复、再生及功能重建。这一过程中涉及基底细胞的迁移、上皮细胞的增殖与分化等。在COPD患者气道上皮的损伤修复过程中,常常伴随气道上皮的重塑,例如鳞化、粘液腺增生等,从而很大程度上破坏气道上皮的固有免疫功能。在气道上皮损伤修复的再上皮化过程中,气道上皮细胞的迁移是首先发生的变化。有研究发现,在小鼠皮肤伤口愈合试验中,CEACAM1敲除小鼠的伤口愈合过程明显延长[13],提示CEACAM1可促进皮肤细胞的迁移再生。我们在体外培养的HBE细胞中进行细胞划痕试验,发现应用siRNA干扰CEACAM1表达可显著延缓细胞划痕的愈合速度,提示CEACAM1可促进HBE细胞的迁移,从而促进上皮细胞损伤修复。
CEACAM1对细胞增殖的作用目前尚无统一的结论。在肿瘤中,CEACAM1对肿瘤增殖的作用取决于其L与S亚型的比例,不同CEACAM1亚型表现出对肿瘤生长截然不同的作用,CEACAM1-L亚型抑制肿瘤生长,而CEACAM1-S相反。在体外培养的细胞中,也同样发现CEACAM1对细胞增殖的作用与其亚型比例有关[14-18]。利用抗CEACAM1抗体阻断培养于含血清培养基中的膀胱癌细胞NBT-II 的CEACAM1表达,可刺激Erk 活化,降低p27表达,并诱导DNA合成;而在无血清培养基中则表现出相反的结果,提示CEACAM1对于持续暴露于生长因子环境下的细胞具有接触抑制作用,而对于缺乏生长因子的细胞则可共活化生长因子介导的细胞增殖[19-21]。在我们的研究中,采用siRNA干扰CEACAM1并应用IFN-γ刺激,检测HBE细胞的增殖情况,发现转染siRNA-CEACAM1抑制CEACAM1后HBE细胞增长率降低,提示CEACAM1具有促进HBE细胞增殖的作用。
4 结论
本文研究发现,IFN-γ可通过诱导CEACAM1表达而上调HBE细胞IL-6 及 IL-8等炎症因子的表达。提示CEACAM1可促进HBE细胞迁移及细胞增殖,因此,可能具有促进气道上皮损伤修复的功能。

