基于射野区域剂量验证新算法的研究与应用*
胡兴刚 徐家云 郞锦义 尹刚
(1.四川大学物理科学与技术学院,四川 成都 610064; 2.四川省肿瘤医院放疗中心,四川 成都 610041)
调强放射治疗(Intensity modulated radiation therapy,IMRT)越来越多的应用于临床。在IMRT实施过程中需对治疗计划系统(treatment planning system,TPS)生成的患者受照剂量进行剂量验证[1],以保证计划计算值与实际治疗结果间的差别在可以接受的范围内[2]。因此如何在计划执行时保证实际剂量分布和计划系统一致,患者治疗计划执行的剂量验证是确保治疗准确性的关键[3-4]。
MatriXX(IBA Dosimetry GmbH,Schwarzenbruck,Germany)二维计划前验证是通过对计算剂量和验证剂量之间进行γ通过率分析来判断临床计划的可行性,MatriXX支持OmniPro-I'mRT包含的多种数据分析工具,测量过程可实时监测且没有“死时间”[5-6],因此测量精度和测量效率较高。目前二维电离室验证存在的主要问题是伽玛通过率没有明确的临床解释,无法和具体的临床情况对应起来,比如是靶区剂量欠量还是危及器官过量;同时传统伽玛通过率的计算受人为因素的影响较大,如计算阈值、计算区域的选择[7]。本文基于靶区及正常器官在等中心平面的射线投影来分别考虑不同器官的伽玛通过率情况,通过6例调强计划剂量验证进行讨论,用MATLAB软件实现了对危及器官及靶区γ通过率的计算。
1 材料与方法
1.1 随机选取6例IMRT计划完全匿名纳入本研究,其中OncentraMasterplan (OMP) (Nucletron BV, Veenendal, The Netherlands)TPS生成的5例调强计划,治疗机器为Varian 23EX直线加速器;以及一位由Varian EclipseTPS生成的头颈部计划。将计划系统优化后的IMRT计划移植到MatriXX与剂量模体的组合中,按IMRT计划设计进行照射和测量,由此可得到验证剂量分布。从患者TPS中输出DICOM文件,使用MATLAB软件分析这些DICOM文件,通过视角投影对3D图形解析,提供等中心2D平面和3D结构之间的空间关系,(见图1)。基于几何知识的空间分析,只要能知道CT中任一点的空间位置,就可以求出其在等中心平面(Isoplan)上对应投影的坐标,对剂量文件中的剂量信息采用同样的分析方法,利用三维线性插值法解决网格差异,并将剂量值投影到等中心平面(见图2),每个射野都有对应的等中心面,叠加多个等中平面,可得到一个包含剂量信息和感兴趣区域(regions of interest, ROI)轮廓的平面图(见图3),将这个平面图用来与模体中的绝对剂量值进行分析[3]。
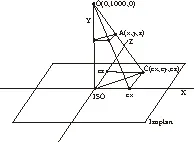
图1 通过单元透视投影获得面积透视图
Figure1Arearenderingviacellperspectiveprojectionareimplemented
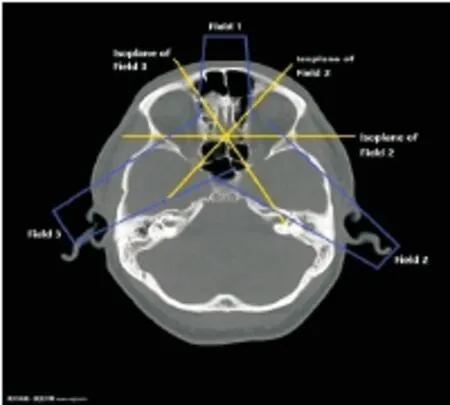
图2每个射野对应一个等中心平面
Figure2Eachfieldhadacorrespondingisocenterplane.
1.2 γ系数的求解如下:

(1)
其中

(2)

基于谷本系数的相似性度量(Tanimoto Coefficient-based Similarity)分析靶区与计算区域的相似度,Tanimoto Coefficient又被叫做Jaccard Coefficient, 靶区与计算区域的相似度用公式表示为:

St表示靶区的面积,Sb表示计算区域的面积,St∩Sb表示二者交叠部分的面积,St∪Sb表示二者面积的并集,其值介于[0,1]之间,值越接近1相似度越高。
2 结果
2.1 将6例调强计划移植到MatriXX模体并实际照射、测量。评估标准设定为2%/2mm、3%/3mm、4%/4mm、5%/5mm,对传统方法取测量点中最大值5%、10%、20%区域纳入γ通过率计算,采用两种对比方法,分别为相对剂量比较(采用空间位置相对应的两个剂量差异和对应点的剂量比值)和绝对剂量比较(采用空间位置相对应的两个剂量差异和测量值的最大点的比值),见表1。
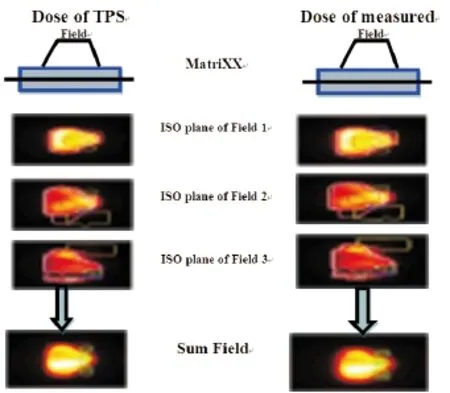
图3IMRT计划移植到水模体中,计划系统和模体中的等剂量图和剂量曲线的叠加
Figure3CalculatedandphantomisodosecontoursandadoseoverlayfromirradiationofaIMRTplanaboveinthewaterphantom

表1 传统法计算得到的γ通过率(×10-2,±s)Table 1 The results of gamma passing rate using traditional way
注:①表示相对剂量差别的比较;②表示绝对剂量的比较,两种比较都采用相同的计算区域。
2.2 表1显示,用相对剂量差别比较计算得到的γ值均小于用绝对剂量比较计算的值,这是由于M值导致的,表2和表3统计了不同计算区域γ值的统计学差异。对分析计算区域的选择与γ值高度相关,均有显著性差异,可见传统方法的γ通过率受阈值选择影响较大。
表2相对剂量比较法不同计算区域γ值的统计学差异
Table2Thestatisticallysignificantdifferencehasbeenobservedfor%GP.

①方法(P)10%20%5%0.0000.01010%-0.009
表3绝对剂量比较法不同计算区域值的统计学差异
Table3Thestatisticallysignificantdifferencehasbeenobservedfor%GP

②方法(P)10%20%5%0.0000.00010%-0.000
注:①表示相对剂量差别的比较;②表示绝对剂量的比较,两种比较都采用相同的计算区域;"-"表示无数值。
2.3 采用新方法,以射野区域为计算区域计算6位患者γ通过率,对靶区临床上主要关注剂量冷点(即γ<-1的点),而射野区域与计算区域高度适形(见表7),因此gamma通过率即为计算区域内γ≥-1的像素点所占的比例(见表4)。新方法计算得到γ通过率均较传统方法高,对比二种方法的γ值有显著性差异(P<0.05),见表5。

表4 新方法计算得到的γ通过率(×10-2,±s)Table 4 The results of gamma passing rate of new way
注:①表示相对剂量差别的比较;②表示绝对剂量的比较,两种比较都采用相同的计算区域。
2.4 新方法和传统方法计算区域的面积(见表6),表中可以看出传统方法计算区域受阈值选择影响较大。计算区域和靶区的相似度,值越大说明计算区域与靶区适形度越高。射野区域作为计算区域时与靶区高度适形,其余的相似度受阈值的选择较敏感,见表7。
表5传统方法和新方法通过率比较
Table5Significantdifference(P-value)betweenthe%GPobtainedusingnewandtraditional%GPcalculationmethod
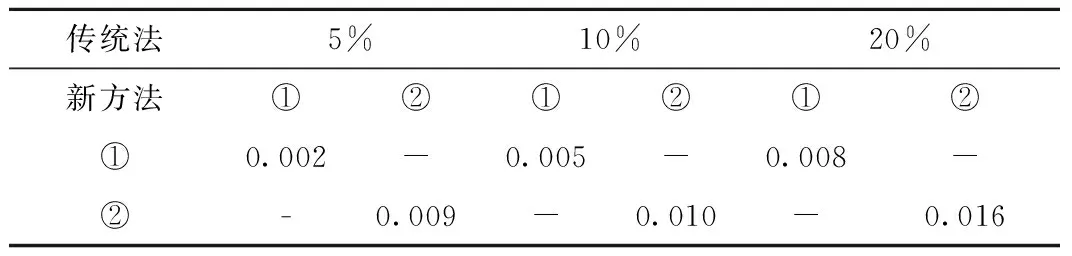
传统法5%10%20%新方法①②①②①②①0.002-0.005-0.008-②-0.009-0.010-0.016
注:①表示相对剂量差别的比较;②表示绝对剂量的比较,两种比较都采用相同的计算区域;“-”表示无数值。
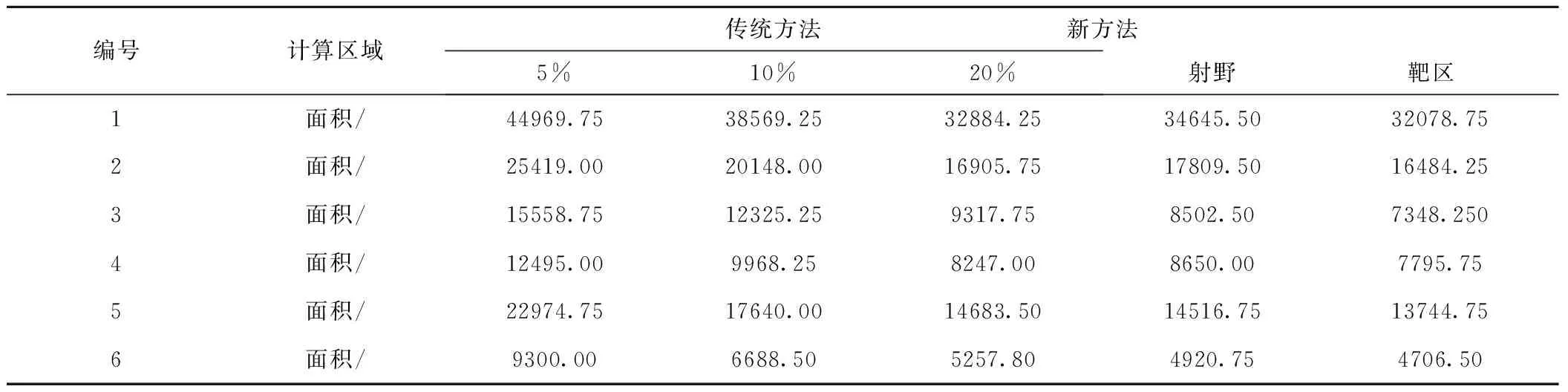
表6 新方法和传统方法计算区域的面积Table 6 The area of CR for the new method and traditional method
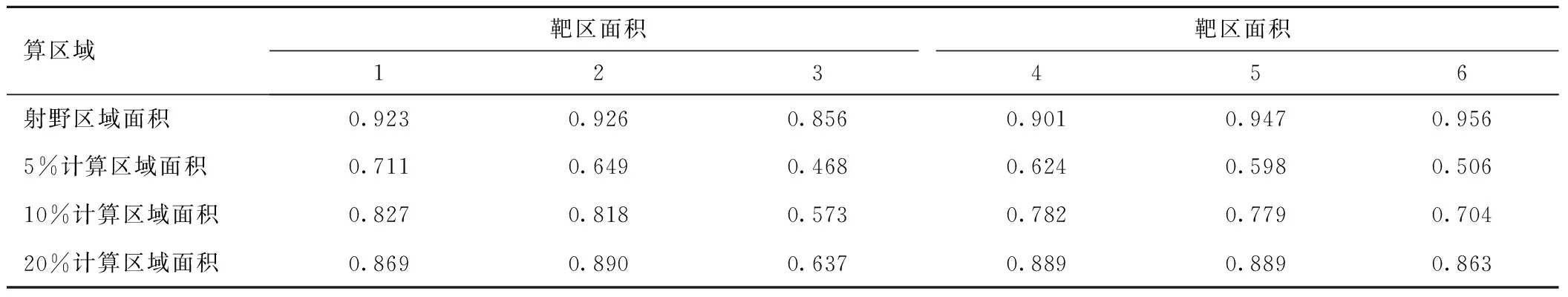
表7 靶区和计算区域适相似度指数Table 7 The index of the area of CR and target
2.5 基于新方法,绘制了绝对剂量平面图,以1号病人为例(见图4)包括平面剂量图,红色区域的靶区,黑色区域的射野区域和白色区域的脊髓轮廓;图红色区域是靶区的γ值区域(见图5a),图白色区域是处于射野内的脊髓的γ值区域(见图5b)。 对于靶区临床上关心:是否有剂量冷点,即图5a中红色区域中 γ<-1的点;对危及器官脊髓临床上关心:是否有剂量热点,即图5b中白色区域中γ>1的点。
2.6 MATLAB还绘制了3号患者剂量与感兴趣区域面积直方图,图6是靶区,图7是脊髓,面积是归一的,红色曲线是绝对剂量曲线,黑色线是TPS计算剂量曲线。图6和图7呈现的感兴趣区域DAH图能直观反应TPS与MatriXX模体测量得到的剂量差异。
图4MatriXX模体得到的正常器官、靶区和剂量在等中心平面的投影分布。
Figure4Theshapeofregion,ROIshape,targetshapeanddosedistributionincaseofMatriXXphantominisoplane
注:a.红色区域是靶区区域;b.白色区域是脊髓区域
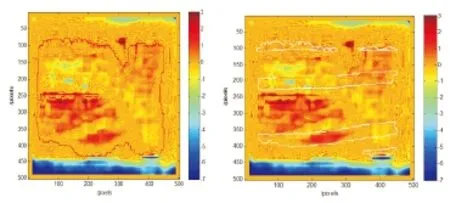
图5 MatriXX二维值平面图;Figure 5 MatriXX 2-D plane plan
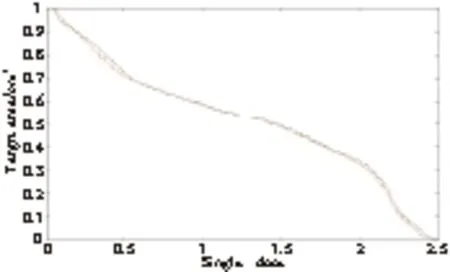
图6 靶区单次剂量和靶区面积的关系
Figure6Relationshipbetweentargetdoseandtargetarea
2.7 分别计算了靶区、脊髓(SC)、脑干(BS)、左晶体(LenL)、右晶体(LenR)的γ通过率(见表8);统计靶区剂量冷点(见表9);统计了射野内脊髓(SC)、脑干(BS)、左晶体(LenL)、右晶体(LenR)等器官剂量热点比例,见表10。
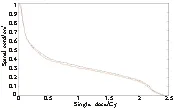
图7 脊髓单次剂量和脊髓面积的关系
Figure7Relationshipbetweensingledoseofspinalcordandareaofspinalcord

表8 靶区、危及器官的 通过率(×10-2,±s)Table 8 The %GP of the target and OARs
注:①表示相对剂量差别的比较;②表示绝对剂量的比较。
2.8 为验证新方法对验证计划偏差正确的响应,以6号患者为例,利用Ecilpse计划系统的Eidt Fuence功能对通量图进行编辑,通量图是一个2D函数,对应于通量区MLC头上每一个点的值,通量图的改变转换为MLC叶片的运动,用以通量图平面剂量分布的优化,根据需要可对不同的射野的通量图进行编辑,编辑后重新计算得到剂量分布。[8]在原计划第四个野的右视网膜中引入一个约为 的通量区域,重新计算得到带有误差的计划,(见图8和图9),然后将带有误差的计划移植加速器上,照射摸体,用摸体记录剂量分布,并与原计划进行gamma分析(见表11和表12)。对射野内感兴趣区域剂量冷热点进行分析,结果(见表13)。从表中可以看出引入误差前后传统方法计算得到的gamma通过率差别不是很大。与传统方法相比,新计算得到的通过率差异较大,因此新方法对误差的响应更敏感。从表13中可以看到脑干中的热点比例也比较高,这是由于不同危及器官在等中心平面出现了叠加,若对单野进行分析,则可以更好的凸显不同感兴趣区域的剂量特性,见表14。

表9 靶区剂量冷点比例Table 9 The statistics of cold dose spots of target
注:数值为百分制表示。①表示相对剂量差别的比较;②表示绝对剂量的比较。

表10 射野内的危及器官的剂量热点比例Table 10 Dose hotspots of the OARs within the field region
注:数值为百分制表示。①表示相对剂量差别的比较;②表示绝对剂量的比较。
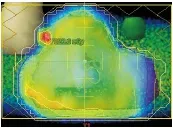
图8 在原计划的第四个视野中引入误差
Figure8Introducingerrorsinthefourthvisionoftheoriginalplan

图9 原计划的第四个射野Figure 9 The original planned fourth shooting fields
2.9 对于靶区,当引入剂量热点后,相应的剂量将增大,在用绝对剂量比较的时候,由于最大剂量值增大,最大值的2%、3%、4%、5%相应增加,导致剂量冷点减少的较明显。对危及器官,以右视网膜为例,剂量热点增加的较明显,从剂量面积直方图可直观的反应引入误差前后剂量差异,见图10和图11。

表11 误差引入前和后传统方法计算得到的gamma通过率(×10-2)Table 11 The traditional method is given for the %GP comparisons between the experimental measured plan with and without error
注:①表示相对剂量差别的比较;②表示绝对剂量的比较。
表12 误差引入前和后新方法计算得到的gamma通过率(×10-2)Table 12 The new method was given for the %GP comparisons between the experimental measured plan with and without error
注: ①表示相对剂量差别的比较;②表示绝对剂量的比较。

表13 误差引入前和后射野内感兴趣区域的剂量冷、热点比例(×10-2)Table 13 Analysis of the hot and cold spots of ROIs within the field region
注:①表示相对剂量差别的比较;②表示绝对剂量的比较。

表14 对第四个射野内的感兴趣区域进行分析(×10-2)Table 14 Analysis of the hot and cold spots of ROIs within the fourth field of region
注:①表示相对剂量差别的比较;②表示绝对剂量的比较。
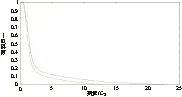
图10 无误差引入时射野内右视网膜总剂量与面积直方图.
Figure10TheDAHofretina_Rdifferencesbetweentheerror-freeMatriXXandTPS
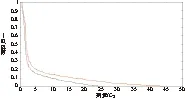
图11 有误差引入时射野内右视网膜总剂量与面积直方图.
Figure11TheDAHofretina_Rdifferencesbetweentheinduced-errorMatriXXandTPS
3 讨论
许多国内外研究者对ss-IMRT使用MatriXX验证[9-12]。MatriXX二维探测器的设计适用于垂直入射情形,照射野垂直于MatriXX检测器平面照射,为了减小电离室的角度依耐性[13-15],机架角度归零。在IMRT实施过程中需对TPS生成的放疗计划绝对剂量和相对剂量进行测量验证[1],以保证计划计算值与实际治疗结果之间的差别达到一个可以接受的范围内[2]。
分析表1和表6,反映了传统方法的一个缺陷,计算区域受阈值影响较大,而计算区域直接影响γ通过率的高低,所以γ通过率受阈值的选择较敏感,与其他发表文章结果一致[2,16],本文的表2和3也证实了计算区域选择对γ通过率的影响。从表1和表4中可以看出传统方法计算得到的γ通过率较新方法低,对 4号患者,传统方法计算得到的γ通过率为89.93%(最大值),未通过(按3/3 ,90%为通过标准),但新方法得到的通过率为99.92%(最小值)。主要是因为重新定义了γ通过率,新方法计算一个特定区域内的γ系数与传统方法不同,根据临床评估中医生主要关注靶区区域的剂量冷点,而靶区区域和计算区域高度适形,见表7,所以新方法中γ通过率是计算区域内γ≥-1的像素点所占的比例,没有考虑靶区剂量热点;此外新方法计算区域与传统方法的计算区域均有差异,也会造成通过率差异。表5结果表明传统方法和新方法平均γ通过率的差别具有统计学差异,这与两种方法不同计算区域差异相关;统计计算区域和靶区的相似度,传统方法中计算区域受人为影响因素较大,因此相似度值差异也较大,见表7,以阈值5%作为计算区域和以阈值20%作为计算区域时的相似度值相差较大;而新方法中计算区域面积始终大于靶区面积,且与靶区高度适形,计算区域不受阈值选择影响,故受人为影响因素较小;综上可见新方法能够更好的发现治疗计划中是否存在问题,能够更好的指导临床工作。
新方法中危及器官的热点可能超标,见表10,这是因为和射野交叠部分的体积很小,若考虑完整危及器官,热点的比例会大大降低。但与实际情况有关,由危及器官的剂量限制,例如放射治疗中脊髓的最大耐受剂量是45Gy[17],但在实际放疗计划中脊髓的最高剂量可能是20Gy,即使热点比例很高也不会造成脊髓剂量超过45Gy。在另一种情况下,如果实际计划中脊髓的最大剂量接近45GY,那么QA过程中脊髓的最大剂量就很关键,如果超出最大耐受剂量,可能会导致严重的后果,因此对危机器官热点的关注是临床迫切的需求,但传统的gamma通过率验证不能体现这一点。图6和图7,统计了3号患者感兴趣区域面积和剂量情况,单独分析靶区和脊髓的剂量特性,对计算区域分离分析,可直观显示出模体测量剂量和验证剂量二者的差异,为计划的评估提供一个新指标,这是比传统方法更优越的。表8统计了靶区和OARs的γ通过率,表9、表10中分别统计了靶区剂量冷点和危及器官剂量热点,从中可以看出γ通过率达标者(按3/3% 90%为通过标准)危及器官剂量热点和靶区剂量冷点明显低于未达标者。
对比表11和表12,即误差引入前后的一个对比,可以看到传统方法计算得到的通过率变化较小,对误差不敏感,而新方法计算得到的通过率差异较大,说明新方法对误差的响应较传统方法更敏感;同时对射野内部分危及器官做了分析,见表13,由于把空间危及器官投影到等中心平面上,因此出现不同器官的交叠,所以导致其他危及器官也会出现剂量热点,这样不容易判断误差所对应的可能区域;若采用单野分析可以一定程度上避免这一情况,见表14,反应出误差可能存在的区域,结合剂量面积直方图,通过单野在新方法下的比较可以探测误差而导致危机器官热点的敏感性;如图10和图11是右视网膜的剂量面积直方图,可以看到引入误差前后视网膜剂量的变化,可以看出视网膜对应位置的最大剂量由于误差的引入比TPS计算出的剂量要大很多,很有可能造成视网膜的超量(视网膜平均最高剂量为29Gy[18]),这在传统的gamma通过率分析中是无法提供的。通过对单野内危及器官的独立分析可以提供更多的临床信息,有助于物理师和医生提供轻松、快速的计划审查和TPS计算剂量检查。
本研究的不足:本文并没有研究VMAT的情况,因为目前的验证系统还不支持每个控制点的剂量输出[19-20],对于危及器官的伽玛通过率只告诉有多少个点不能通过,并且不提供有关失败的解剖位置的信息;因此危及器官的伽玛通过率的临床意义还需要进一步研究,下一步的研究工作将通过每个射野构建剂量反投影算法,实现基于二维矩阵的三维验证剂量重建。
4 结论
本文的研究为治疗计划QA提供一个新的思路和方法,其gamma通过率算法还是沿用传统算法,就计算方法本身而言并没有提出新的算法。新方法中,我们通过分区验证各个感兴趣区域的剂量特性,独立分析每个危及器官的gamma通过率,实现了%GP的临床可解释,及危及器官与靶区γ通过率和剂量冷热点的计算,这是新方法特有的优点。提供了更多额外的患者剂量信息,可以从局部评估中了解到患者整体的剂量特性,引入剂量面积直方图可直观呈现计算剂量与测量剂量之间的差异,能够更好的发现治疗计划是否存在问题,为物理师和医师提供多个计划评估指标,丰富了评估标准,使γ评估更贴合临床评估,更好的指导临床工作。因此新方法更有利于临床评估,对误差的响应更灵敏。

