小剂量奥氮平防治中高度致吐风险化疗相关性恶心呕吐的临床疗效观察*
何依群 席晓莉 何发群
(1.成都医学院第一附属医院肿瘤科,四川 成都 610500;2.成都军区总医院高压氧科,四川 成都 610083)
化疗所致恶心呕吐(chemotherapy-induced nausea and vomiting,CINV) 显著影响患者的生活质量,从而进一步降低患者对化疗或其他治疗的依从性[1]。延迟性 CINV 一般发生于化疗后 24~48h,有时可持续 1 周。在最新的 NCCN 指南中,包含奧氮平的方案被推荐用于中、高度致吐风险化疗药引起的急性或延迟性呕吐的预防,同时推荐使用奥氮平治疗爆发性呕吐[2]。目前国内用于防治化疗引起恶心呕吐的药物主要有5-HT受体拮抗剂、地塞米松、胃复安等,能使大部分患者恶心呕吐减轻,但仍有一部分患者效果不理想,尤其是高致吐性的化疗效果不佳[3]。奥氮平是已被临床广泛应用的非典型抗精神病药物,具有拮抗多种呕吐相关受体作用[4],近年国外来多项研究证明可有效防治CINV,特别是迟发性CINV非常有效[5-7]。而国内相关的研究报道较少,值得进一步探讨奥氮平防治中高度致吐风险化疗中的作用。本研究将通过回顾性分析本院 2015 年 1 月 ~2017年 4 月期间收治的接受奥氮平防治 CINV 的恶性肿瘤化疗患者的临床资料,进一步探讨奥氮平防治中高度致吐风险化疗方案 CINV 的安全性及有效性。
1 资料与方法
1.1 一般资料 本研究选取我科 2015年 1 月~2017 年 4 月接受中、高致吐性化疗药物化疗的101例恶性肿瘤患者作为研究对象,入组患者采用随机数字表法将患者分为实验组和对照组两组。实验组51例,对照组50例患者。其中男性 61例、女性 40例,年龄 39~75 岁,平均年龄(59.5±8.7)岁,肿瘤类型:其中非小细胞肺癌 20例,结直肠癌 44例, 乳腺癌 37例; 临床分期Ⅱ ~ Ⅳ期。实验组:非小细胞肺癌10例,结直肠癌22例,乳腺癌19例;对照组:非小细胞肺癌10例,结直肠癌22例,乳腺癌18例。均经病理组织学或细胞学确诊所有患者均经细胞学或病理确诊为恶性肿瘤者,ECOG评<=2分;无化疗禁忌,均接受两周期以上的化疗。排除病例:脑转移并颅内高压者,不全性肠梗阻患者,严重心脏病和糖尿病,肝肾功能及血常规异常,脑转移和其他可以导致恶心呕吐症状的原发疾病。两组临床一般资料无统计学差异(P>0.05),具可比性。
1.2 治疗方法 化疗方案为:肺癌:GP(吉西他滨与顺铂)/TP(紫杉醇与顺铂)/NP (长春瑞滨与顺铂)方案 ;结直肠癌 :FOLFOX(氟尿嘧啶+亚叶酸钙+奥沙利铂)/FOLFIRI(氟尿嘧啶+亚叶酸钙+伊立替康) ;乳腺癌 :AC(阿霉素,环磷酰胺)/TC(多西他赛,环磷酰胺)/TAC(多西他赛,阿霉素环磷酰胺)方案。对照组 50例采用托烷司琼 5mg/d 静滴及地塞米松注射液10 mg第1天静脉注射,化疗前30min,共1周。实验组 51例第采用托烷司琼 5mg/d、地塞米松注射液 10 mg第1天静脉注射,化疗前30min,共1周,同时服用奥氮平5mg 每日睡前口服,自化疗前 1 天开始,共 1周。
1.3 评价指标 本研究的恶心的定义是:反胃的感觉和/或呕吐的冲动;呕吐的定义是胃内容物从口中喷出的放射活动。本研究评价指标主要有:①参照按 NCI-CTCAEV 3.0版本0 级 :24 小时内无呕吐 ;1 级 :24h 内发生 1 次呕吐 ;2 级 :24 小时内发生 2~5 次呕吐,需静脉补液< 24h ;3 级 :24h 内发生> 5 次呕吐,需静脉补液或全胃肠外营养> 24h ;4 级 :出现危及生命的后果。完全缓解(complete response,CR):0 级 ;部分缓解(partialresponse,PR):1~2 级 ;以完全缓解率 + 部分缓解率计算有效率。末次化疗后 24 h 内发生的恶心呕吐为急性恶心呕吐,24 h 后发生的恶心呕吐为延迟性恶心呕吐。②患者体能状况采用KPS 得分,KPS 评分参照 Karnofsky 功能状态评分表。③两组化疗期间其他不良反应情况。

2 结果
2.1 两组患者的恶心呕吐分级及疗效比较 两组患者用药后,恶心呕吐分级(见表1)。实验组与对照组急性期CINV 的完全缓解率分别为62.7%和52.0%,(P<0.05),有效率分别为80.3%和66.0%(P<0.05)实验组均高于对照组;而实验组延迟期 CINV 的完全缓解率86.3%和有效率93.9%也均高于对照组的完全缓解率46.0%和有效率64.0%,且差异均具有统计学意义(P<0.05)。
表1两组患者的恶心呕吐分级及疗效比较
Table1Comparisonofgradeofnauseaandvomitingandefficacy
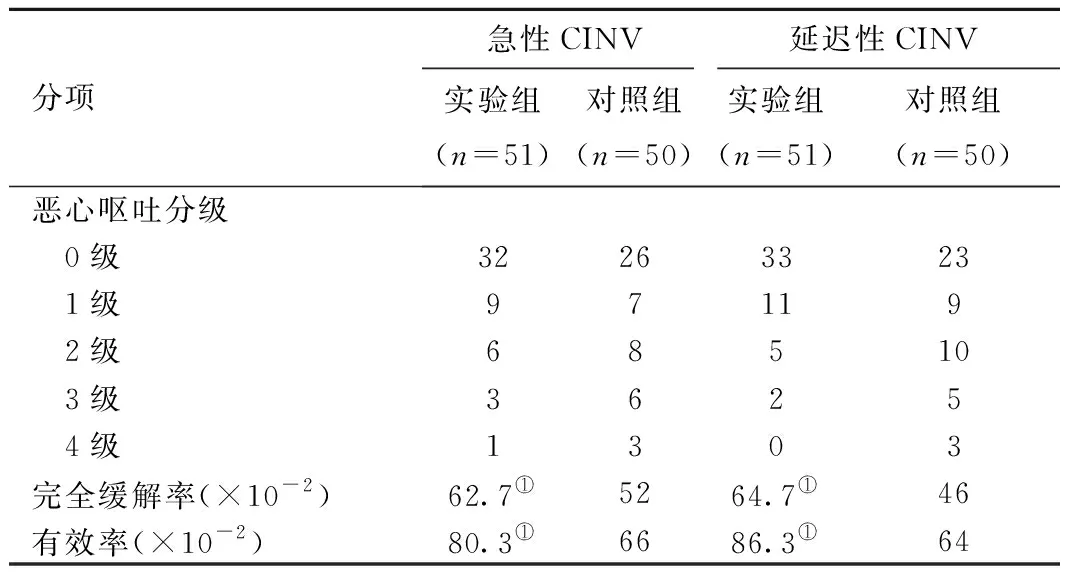
分项急性CINV延迟性CINV实验组(n=51)对照组(n=50)实验组(n=51)对照组(n=50)恶心呕吐分级 0级32263323 1级97119 2级68510 3级3625 4级1303完全缓解率(×10-2)62.7①5264.7①46有效率(×10-2)80.3①6686.3①64
注:与对照组相比,急性CINV的完全缓解率和有效率,①P<0.05。
2.2 两组患者化疗前及化疗1周后KPS评分的比较 两组患者化疗前的 KPS 得分无明显差异,而经过 1 周的化疗后,两组患者的 KPS 得分均降低,但对照组较实验组降低的更为明显(P< 0.05),见表2。
2.3 两组患者治疗后不良反应 两组主要的不良反应均为轻度,实验组食欲下降的发生率占11.8%低于对照组的18.0%,且差异有统计学意义(P< 0.05);组间头晕、乏力、便秘的发生率无统计学差异(P>0.05)。两组四种不良反应发生率差异无统计学意义(P>0.05),见表3。

Table2ComparisonofKPSscorebeforeandafter1weekofchemotherapy
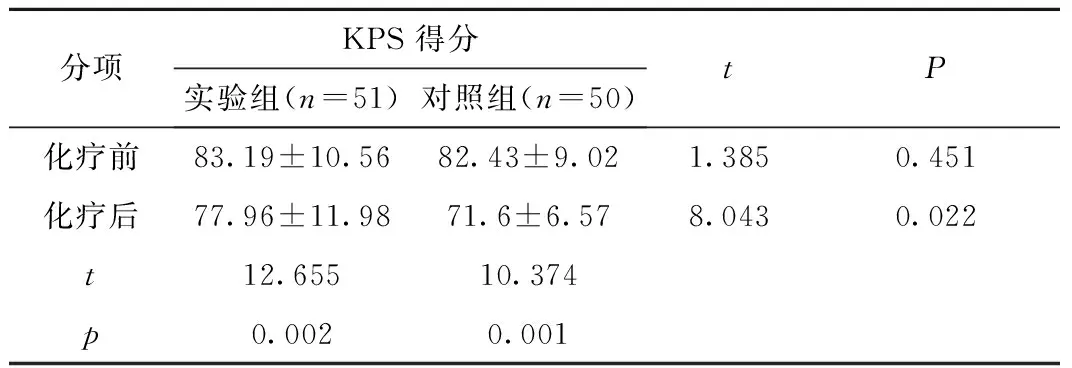
分项KPS 得分实验组(n=51)对照组(n=50)tP化疗前83.19±10.5682.43±9.021.3850.451化疗后77.96±11.9871.6±6.578.0430.022t12.65510.374p0.0020.001
3 讨论
化疗作为恶性肿瘤的四大治疗方法之一,可延长患者的生存时间,改善其预后,但与此同时,也带来不同程度的毒副反应。恶心、呕吐是化疗导致的最常见的消化道不良反应之一,可使病患电解质紊乱、酸碱平衡失调、营养不良等,严重降低患者的生活质量,同时影响患者对化疗的依从性,使化疗不能足量、按时完成,从而影响患者的预后[8]。约60%的肿瘤患者在化疗的过程中发生恶心,30%患者出现呕吐[9]。

表3 两组患者化疗期间其他不良反应情况Table 3 Side effects in chemotherapeutic period
CINV发生机制复杂 , 目前认为通过以下途径发生: ①化疗药物导致胃肠道载膜损伤, 载膜上皮的嗜铬细胞释放5-HT , 5-HT与受体结合产生神经冲动传人呕吐中枢引起呕吐。②化疗药物及其代谢产物刺激第四脑室底的呕吐中枢产生呕吐反应。③感觉、精神因素刺激大脑皮质通路引起呕吐[10-12]。不同类型阶段的呕吐反应中, 发挥主导作用的神经递质及其受体是不同的, 急性CINV与5-HT有关, 迟发性5-HT可能与P物质、胃肠动力破坏、肾上腺激素分泌、心理因素等因素有关, 最近也有研究报道 可能与化疗药物诱导细胞炎性因子释放有关[13]。
奥氮平在精神科作为一种新型非典型抗精神病药, 目前已经被广泛应用. 奥氮平受体药理学研究显示, 奥氮平与5-HT2A、5-HT2C、5-HT3、多巴胺D1-5、毒蕈碱 M1-5、肾上腺素α1和组胺H1受体有一定结合力, 从而发挥拮抗作用, 与止呕作用机制重叠, 为其用于CINV的治疗提供依据[14-15]。Navari 等[16]和 Passik 等[17]研究报道,奥氮平可以有效控制 CINV。本研究结果也显示奥氮平在急性期和延迟期的CINV防治中均优于常规止吐组,止吐分别有效率达到80.3%和86. 3%。在对患者生活质量改善方面,我们采用了KPS量表。KPS 是对于患者的生活自理能力、轻微体育活动、卧床时间等进行综合评分,进而反应患者的生活质量[18],本次研究中两组患者化疗前的KPS 得分无明显差异,而经过 1 周的化疗后,两组患者的 KPS 得分均降低,但对照组较实验组降低的更为明显,提示恶心呕吐的减少对于患者生活质量体验的改善作用。
在药物安全性方面,奥氮平常见的不良反应有嗜睡、食欲增加及便秘等。 小剂量、短期使用较安全,很多临床研究中均未发现明显不良反应,而且与对照组相比实验组患者的生活质量明显提高[19-20]。 本研究发现实验组患者的食欲下降较对照组明显要少,我们认为可能与奥氮平引起的食欲增加有关,而这对于化疗患者而言反而有益。
4 结论
本文资料显示,奥氮平对中高度致吐药物所致恶心、呕吐有较好的防治作用,特别是对延迟性恶心、呕吐的疗效更优,且能改善患者的生活质量,不良反应可耐受,可在临床推广应用。

