帕金森病患者血清α-SYN、LPO和MDA水平及临床意义
杨 清,李大光,陈 勃,张灵敏,袁翠玲,林 花
(1.吉林大学第一医院二部 输血科;2.吉林大学第一医院 检验科,吉林 长春130000)
PD是中老年人常见的神经系统退行性疾病,我国55岁以上人群PD患病率大约是1.7%。大部分PD患者为散发病例,仅有不到10%的患者有家族史,且随 老龄化现象的加剧,患病总数正持续增长[1]。PD最主要的病理改变是中脑黑质多巴胺(DA)能神经元的变性伴胞浆内Lewy body小体形成,导致黑质纹状体通路破坏及尾状核、壳核中DA含量显著性减少而致病,导致这一病理改变的确切病因目前仍不清楚。研究表明,氧化应激通过各种途径引起黑质多巴胺神经元的变性和凋亡,氧化应激是PD重要的发病机制之一[2]。本文通过观察PD患者血清α-SYN、LPO和MDA水平,探讨上述指标与病情严重程度的关系及其在PD发生机制中的作用。
1 资料与方法
1.1研究对象选择2012年6月至2015年3月我院住院和门诊PD患者120例,其中男性68例,女性52例,平均年龄(63.82±6.75)岁。依据Hoehn-Yahr分级将120例PD患者按1-5级分为5组,其中1级19例,2级23例,3级25例,4级27例,5级26例。诊断符合英国帕金森病协会脑库临床诊断标准[3]。30例健康体检者;男性16例,女性14例,平均(62.75±7.35)岁。
1.2方法所有研究对象于清晨空腹采取静脉血4 ml,离心后取上清液,标本放置-80℃保存待测。采用ELISA法、TBA荧光法和RIA法检测120例PD患者和30例健康对照组α-SYN、LPO和MDA水平,比较各组与对照组之间的浓度差异。试剂由美国Invitrogengon公司、上海试剂二厂和上海放射免疫分析技术研究所提供,严格按说明书操作。
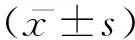
2 结果
PD患者Hoehn-Yahr分级1-5级血清α-SYN、LPO和MDA水平均显著高于对照组(P<0.01;P<0.05),并且3项指标水平随PD病情的加重而增高,表1。
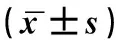
表1 120例PD患者30例对照组血清α-SYN、LPO和MDA水平
3 讨论
目前认为PD与遗传、环境因素、衰老、氧化应激、过多自由基生成及神经因子缺乏等有关,是多因素协同作用的结果,其中氧化应激脂质过氧化使机体氧化与抗氧化系统平衡失调,在PD的形成机制中尤为重要[4]。α-SYN是一种存在于神经元细胞质的突触前蛋白,分布于大脑皮质、基底神经节和小脑等处,可能与神经元发育、形成、突触功能维护及抗凋亡作用有关,α-SYN基因是最早发现的与PD相关基因,在部分家族性PD患者中存在该基因突变,并且在α-SYN转基因小鼠中也检测到了以磷酸化、氧化、硝化及泛素化形式存在的α-SYN积聚体[5]。有研究认为PD患者存在泛素-蛋白酶系统(UPS)降解障碍,PD是一种蛋白降解障碍性疾病,α-SYN的降解障碍和异常聚集与PD的发生密切相关,突变的α-SYN过度积聚可导致UPS降解障碍,对细胞产生毒性,同时UPS功能障碍可引起细胞内蛋白降解障碍、聚集,导致胞浆内Lewy body小体形成及DA能神经元变性坏死及凋亡[6,7]。LPO是氧自由基与多聚不饱和脂肪酸反应的产物,在正常情况下,LPO的含量极低,但在病理情况下,脂质过氧化反应增强可导致LPO升高,LPO升高可对细胞及细胞膜的结构和功能造成种种损伤[8]。MDA是脂质过氧化中最重要的代谢产物。自由基与PD之间存在密切关系,它能攻击生物膜中的多不饱和脂肪酸(FUFA)及核酸等大分子物质,引发脂质过氧化作用产生的MDA引起细胞损伤,故MDA含量可反映机体脂质过氧化程度,间接反映细胞受损程度[9]。尸检证实PD中存在氧化应激,PD患者黑质区过氧化产物LPO和MDA浓度高于正常人10倍之多[10]。实验结果表明,PD患者Hoehn-Yahr分级1-5级血清α-SYN、LPO和MDA水平均显著高于对照组,并且三项指标水平随PD病情的加重而增高。说明PD患者存在UPS降解障碍,造成α-SYN的折叠错误、排列混乱和寡聚沉积,作为Lewy body小体的核心成分,具有很强的神经毒性作用,诱导DA能神经元的变性凋亡[11]。也说明PD患者存在着随病情加重而持续的脂质过氧化反应,死亡的神经元继续激活小胶质细胞,促使DA能神经元不断变性死亡,PD进行性恶化的驱力就是这种自我促进的恶性循环过程的结果[12]。然而PD发生机制复杂,仍有诸多问题需要深入研究探讨。

