膀胱癌中缺氧诱导因子-1α和血管内皮生长因子与P53基因表达相关性的初探
王秀岩,范海涛,张 明,冯树强,李然伟
(吉林大学第二医院 泌尿外科,吉林 长春130041)
虽然膀胱恶性肿瘤的诊断手段和治疗方法在不断改进提高,但其术后复发率仍然很高。据资料统计,膀胱癌的术后复发率高达50%-70%[1]。其发生、发展和转移的各个阶段均有赖于新生血管的形成。研究证实有多种因子参与了实体肿瘤血管生成的全过程,其中血管内皮生长因子(vascular endothelial growth factor,VEGF)被认为是目前已知活性最强,特异性最高的新生血管生成诱导因子。新的研究结果表明,在很多促进VEGF表达水平上调的因子中,缺氧诱导因子-1α(hypoxia inducible factor-1α,HIF-1α)起中枢开关的作用[2]。另有报道称,VEGF和HIF-1α表达与P53基因突变存在一定关系,P53可能参与了肿瘤新生血管生成[3]。但也有报道认为P53与VEGF和HIF-1α表达无关[4]。见于上述因素,特别是有关肿瘤中VEGF,HIF-1α和P53基因表达相关性的研究截至目前鲜有报道,故本研究初步探索这三种蛋白在膀胱癌患者组织细胞中的表达状况,旨在改善分子靶向药物治疗膀胱癌的疗效,从而提高患者的生活质量和术后5年生存率。
1 资料与方法
1.1一般资料回顾性分析我科2010年1月至2016年12 月收治的196例经尿道膀胱肿瘤电切术(TURBT)和开放术治疗的膀胱癌患者,其中男性152例,女性42例,年龄31-82岁,平均年龄55.7岁。细胞病理分级:G1期118例,G2期54例,G3期24例。临床病理分期:非肌层浸润肿瘤114例,肌层浸润肿瘤82例。
1.2方法和判定标准对筛选收集的库存组织标本经常规脱蜡水化并经微波炉法修复抗原后备用。采用SABC免疫组化法。利用人单克隆抗体[VEGF单抗(Clone14 -12 4,ABCAM,5 μg/ml),HIF-1α单抗(Clone8911 5,R&D system,25 μg/ml)及P53单抗(DO-7,DAKO,1∶5)],即用型HIGH-SABC(免疫试剂盒)具体操作步骤参照VEGF抗体,HIF-1α抗体及P53抗体和即用型HIGH-SABC免疫试剂盒说明书。PBS代替一抗做阴性对照,阳性对照为瘤细胞膜或瘤细胞浆或瘤细胞核阳性染色。Tris缓冲盐溶液,冲洗3次,每次5 min,然后DAB显色,流水冲洗,苏木精复染,盐酸酒精脱水,二甲苯透明,树胶封片,光镜观察。光镜下见 VEGF和HIF-1α胞浆或胞膜呈现棕黄色颗粒而胞核无着色者为阳性(图1,2),P53胞核着色而胞浆和胞膜无着色为阳性(图3)。每一组切片由两位观察者各自随机选取2个视野,共约500个瘤细胞,计数阳性细胞的百分率。显微镜下随机选择5个视野,每个视野计数不少于200个细胞,计算阳性细胞的百分比。VEGF,HIF-1α和P53蛋白表达阳性标志为每个视野的着色细胞数分别在20% 左右。
1.3统计学方法采用SPSS 17.0统计软件对数据进行处理,所有数据均以平均值表示。使用χ2检验和Fisher’s精确检验进行统计分析对比,P<0.05为差异有统计学意义,P<0.01为差异有显著统计学意义。
2 结果
2.1膀胱癌患者中VEGF、HIF-1α和P53
表达及其与临床病理特征的关系 在196例膀胱癌患者标本的组织细胞中,VEGF、HIF-1α和 P53 的阳性表达率分别为70.5 %,57.2% 和49.3%,其表达与性别和年龄没有相关性。但与临床分期和细胞分级有密切关系,即肌层浸润膀胱癌中VEGF、HIF-1α及P53阳性表达率高于非肌层浸润者(P<0.05),细胞分化差的中级别和高级别中的上述三种基因阳性表达率与细胞分化好的低级别比较,其差异也具有统计学意义(P<0.05),见表1。
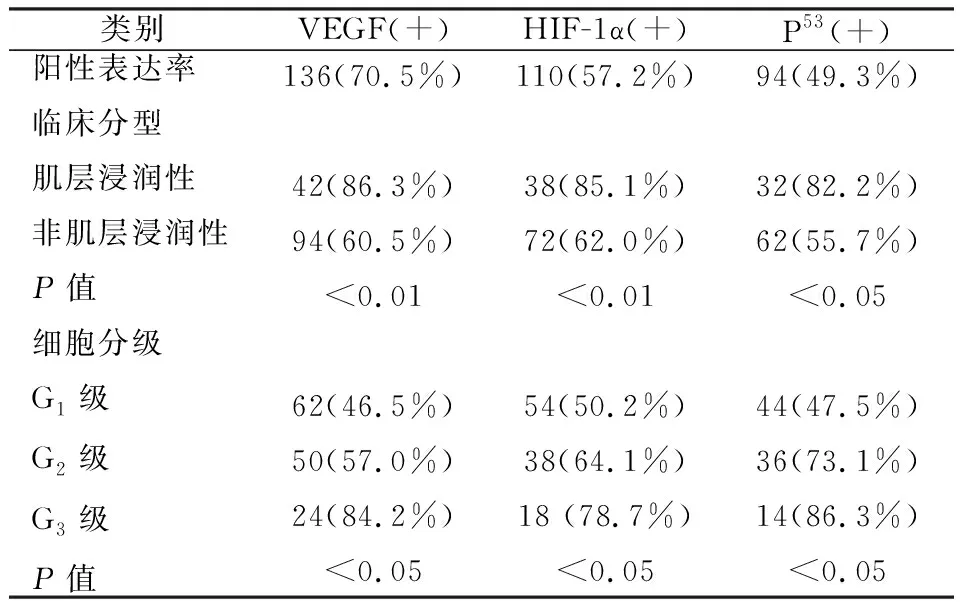
附表1 196例膀胱癌患者中VEGF、HIF-1α和P53表达与病理特征之间的关系
2.2膀胱癌患者中VEGF和HIF-1α表达情
如表2所示,除肿瘤血管内皮细胞外,瘤细胞中也存在VEGF和HIF-1α阳性共表达现象。以VEGF表达与否将患者分为两组,观察HIF-1α表达情况。结果显示在136例VEGF表达阳性和60例无表达的患者中,其阳性表达率分别为67.1% (90/136)和33.3%(20/60),两者间的表达差异有显著统计学意义(P<0.01)

附表2 196例膀胱癌患者中VEGF和HIF-1α表达之间的关系
2.3VEGF和HIF-1α与P53表达的相关性根据VEGF表达与否将患者分为两组,观察P53表达状况。结果提示在136例VEGF阳性表达和60例无表达的患者中,P53的阳性表达率分别为56.8% (76/136) 和30%(18/ 60)。这表明VEGF和P53间的表达呈正相关,其差异具有统计学意义(P<0.01)。同样以HIF-1α表达与否将患者分为两组,观察P53表达情况。结果显示在110例HIF-1α阳性表达和86例无表达的患者中,P53的阳性表达率分别为61.8%(68/110)和30.2%(28/86),显示二者表达密切相关,差异具有统计学意义(P<0.01),见表3。
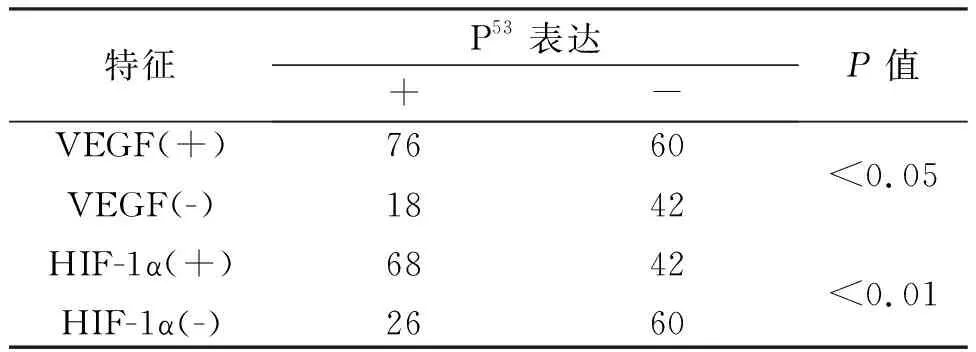
附表3 196例膀胱癌患者中P53表达与VEGF和HIF-1α表达之间的关系

图1 VEGF主要在细胞浆表达 图2 HIF-1α主要在细胞浆表达 图3 P53主要在细胞核表达
3 讨论
膀胱癌是泌尿系统中最常见的恶性肿瘤,近年来,其发病率有增高和年青化的趋势。美国癌症协会2015年对美国肿瘤发病率及死亡率的统计结果表明,膀胱癌占全部肿瘤死亡原因的第6位,5年生存率在50%以下,我国癌症协会2016年对国人肿瘤发生率及死亡率的统计数据显示,膀胱癌占所有肿瘤死亡原因的第9位,5年生存率在40%左右。膀胱癌是血管依赖性的,其生长转移离不开新生血管形成。研究证实,在肿瘤血管生成过程中,血管内皮生长因子VEGF和缺氧诱导因子HIF-1α起着至关重要的作用[2,5]。
在目前已知的促血管形成因子中,VEGF被认为活性最强,特异性最高。虽然影响VEGF的因素很多,而HIF-1α的作用则最大,有学者甚至将其称为VEGF的管家转录因子[6]。HIF-1α能与VEGF的一个增强子结合并启动VEGF转录,使VEGF表达增加,进而促进肿瘤新生血管生成,加速肿瘤生长转移[7]。本研究中我们观察到在196例膀胱癌患者中,HIF-1α和VEGF共同阳性表达者76例,仅单独阳性表达者,HIF-1α14例,VEGF24例,其差异均有显著统计学意义(P<0.01),提示两者表达关系极为密切。
随着研究的不断深入,人们广泛认为以往之所以以VEGF为靶点的抗血管生成治疗肿瘤未达到人们所期待的治疗效果是因为忽略了HIF-1α的信号转录作用。不过,也有近期研究认为对于极其复杂的肿瘤血管生成来说,它也可能受到一些原癌基因或抑癌基因调节的影响。由于野生型P53基因被证实是最重要的抑癌基因。野生型在正常组织细胞几乎不表达,当组织细胞的微环境发生变化时,则由野生型演变为突变型这种突变型P53在癌组织细胞高表达[8,9]。故本实验同时检测了VEGF、HIF-1α和P53这三种基因在膀胱癌中的表达情况,结果发现,VEGF和HIF-1α与P53表达之间存在着不同程度的正相关性,其相关性均具有统计学意义(P53 vs VEGFP<0.01,P53 vs HIF-1αP<0.05)。
我们的研究结果发现,VEGF,HIF-1α和P53这三种标志物在本组196例膀胱癌患者中均呈现出高表达率,尤其是肌层浸润和分化差的细胞其阳性表达率,与非肌层浸润和分化好的细胞阳性表达率相比较,两者差异均具有统计学意义(P<0.05)。这表明突变型P53基因参与了肿瘤组织的新生血管形成从而在肿瘤细胞的生长转移中扮演着不可忽略的角色。同时检测VEGF,HIF-1α和P53蛋白对了解肿瘤恶性度、预测预后和指导后续随访治疗更有帮助。因此在选择分子靶向膀胱癌抗血管生成治疗时,应重视双靶位甚至多靶点的综合治疗策略[10,11],如此才极有可能提升分子靶向用药的基因治疗膀胱癌的水平,从而为改善膀胱癌患者术后生活质量和提高术后5年生存率带来真正确实有效的帮助。

