基于脊髓 NLRP1-Caspase-1-IL-1β通路探讨电针治疗神经病理性疼痛的作用机制*
王志福 杨意州 刘建波 李长征 龚德贵 俞向梅△
(1福建中医药大学中西医结合学院,福州350122;2福建中医药大学附属康复医院,福州350003)
神经病理性疼痛常见于各种疾患中,治疗迁延反复。各种药物的治疗,仍存在一定的不良反应,电针治疗神经病理性疼痛具有安全、简便而无副作用的优点,临床及基础研究已证实电针镇痛的有效性,而其机制仍需进一步深入研究[1,2]。白介素-1β(Interleukin-1 beta, IL-1β) 作为重要的促炎细胞因子之一,在神经性病理性疼痛的产生和维持中起重要作用[3]。
核苷酸结合寡聚化结构域样受体蛋白 (nod-like receptor proteins, NLRP) 炎性体,是一类由NLRP蛋白家族成员、半胱氨酸-天冬氨酸蛋白酶1 (cysteinyl aspartate specific proteinase,caspase-1)和 接 头 蛋白(apoptosis-associated speck-like protein containing caspase-activating recruitment domain, ASC) 组成的蛋白复合物,已知其主要功能是参与IL-1β的成熟过程[4,5]。NLRP1是人类NLRP家族中最早发现的一个成员,基础及临床研究发现,NLRP1可识别和感知体内外各种伤害性信号,与各种疼痛(如复杂性区域疼痛综合征、佐剂关节炎、慢性盆腔疼痛综合征等)发生密切相关,表现为外周组织及脊髓内NLRP1、caspase-1、IL-1β等活化增加。炎症小体中,NLRP1及其产物caspase-1是IL-1β成熟的重要上游通路,激活的NLRP1参与疼痛敏化的形成过程[6~9]。外周神经损伤时,脊髓IL-1β 转录表达大量IL-1β前体分子,被重要蛋白酶caspase-1剪切为成熟IL-1β,从而发挥生物学活性[10]。
本项目组前期实验研究证实,在神经病理性疼痛发生时,脊髓内大量IL-1β成熟释放,与NLRP1及caspase-1活化密切相关;电针环跳、阳陵泉对神经病理性疼痛具有明显的抗炎镇痛作用,可减少脊髓内IL-1β的产生[6,11,12]。而电针是否可通过调节脊髓NLRP1及caspase-1活性,从而降低脊髓IL-1β释放,以发挥抗炎镇痛作用,是本研究关注的主要问题。
方 法
1.实验动物
SPF 级雄性 Sprague-Dawley大鼠42只,体重200~220 g,由上海斯莱克实验动物责任有限公司提供,生产许可证号 SCXK(沪)2012-0002。在福建中医药大学实验动物中心分笼适应性喂养1周,许可证号SYXK(闽)2013-009。将大鼠称重并编号。所有实验均遵照国际动物保护和使用指南的规定实施。
2.试剂与仪器
使用4-0铬制羊肠线(上海浦东金环医疗用品股份有限公司)。华佗牌一次性针灸针 (0.28 mm×15 mm)、电针治疗仪(苏州医疗用品厂有限公司)。Belnacasan,VX-765 (货号:S2228,50 mg粉末装),美国Selleck生物科技有限公司;胞壁酰二肽(Muramyl Dipeptide,MDP,货号:A9519,规格:5 mg), 美 国 Sigma公 司。NLRP1、Caspase-1,GAPDH引物,生工生物工程(上海)股份有限公司合成。IQ5多重实时荧光定量 PCR仪器,美国Bio-Rad公司。38450 -电子触觉测量仪(电子Von Frey),意大利Ugo Basile公司;辐射热测痛仪(深圳瑞沃德生命科技有限公司)。
3.实验分组及模型制备
采用随机数字表法将大鼠分为模型组(CCI)、假手术组(Sham-operation)、电针组(Electro-acupuncture, EA)、非电针组 (Sham-EA)、DMSO组、VX-765(Caspase1抑制剂)组、MDP (NLRP1激活剂)组,每组各6只。模型组建立坐骨神经慢性限制性损伤 (chronic constriction injury, CCI) 神经病理性疼痛模型,不干预;假手术组只切开皮肤,不结扎坐骨神经;电针组造模成功第7天后(P7),选取“环跳”、“阳陵泉”穴电针,每日1次,持续干预至P14;非电针组大鼠只进行针刺如上穴位,不接通电针治疗仪;DMSO组造模成功第7天后(P7),脊髓鞘内注射8% DMSO 3次,每次注射20 µl;VX-765(Caspase-1抑制剂)组分别在P7、P10、P14脊髓鞘内注射VX-765(溶解于8% DMSO,2 mg/kg注射)各1次;MDP组分别在P7、P10、P14脊髓鞘内注射MDP(溶解于8%DMSO,0.1 mg/kg注射)各1次。坐骨神经慢性限制性损伤 (chronic constriction injury,CCI)神经病理性疼痛模型制备过程如下:大鼠腹腔注射10%水合氯醛麻醉 (4 ml/kg) 后,右侧后肢皮肤切开,肌肉钝性分离,暴露坐骨神经,在坐骨神经中段用4-0铬制羊肠线松扎四道,致慢性CCI神经病理性疼痛大鼠模型,术后在伤口处撒适量青霉素粉末预防感染。模型建立后,术后第7日 (P7)和第14日 (P14) 观察实验大鼠机械痛、热痛行为学变化。
4.电针干预方法
电针穴位参照大鼠穴位图谱(华兴邦, 周浩良.大鼠穴位图谱的研制.实验动物与动物实验,1991),结合本课题以往研究经验[12],拟取手术患侧 (右侧) 肢体的“环跳”(GB30) 与“阳陵泉”(GB34)穴,给予“疏密波”(2 Hz/100 Hz 交替;强度≤1 mA;时间 30 min)电针治疗。安静环境中,室温20±2℃,将大鼠躯干固定于木架上,头部与四肢可自由活动,静置 20 min后,将 0.25寸一次性针灸针刺入大鼠右侧“环跳”与“阳陵泉”穴,通过G6805-1A型多功能电针治疗仪给予“疏密波”刺激,强度以引起大鼠后肢肌肉轻微抖动而不嘶叫为宜 (≤ 1 mA)。
5.脊髓鞘内注射方法
大鼠取俯卧位,实验者食指定位于大鼠脊柱L5-6间隙,右手持微量注射器从间隙垂直缓慢进针,以大鼠尾巴出现颤动或突然的侧向甩动作为穿刺成功的标志,注入相应的工具药 (VX-765、MDP) 或等剂量 DMSO 缓冲液 20 µl。
6.观测指标
(1)机械痛行为测试
测试环境为10 cm × 20 cm × 20 cm有机玻璃笼,将大鼠放入笼内静置10 min后,采用Ugo Basile原创设计的电子触觉测量仪(e-VF),自动记录大鼠的受刺激强度(即大鼠的缩爪反应阈值),以此反应大鼠的机械痛敏情况。
(2)热痛行为测试
安静环境中,室温 20±2℃,将大鼠放入测痛仪上方的玻璃格子中,自由活动。大鼠静置20 min后,采用336型辐射热测痛仪强光照射大鼠足掌,测定大鼠的缩爪潜伏期 (paw withdrawal latency, PWL)。测定时每次间隔不低于l min,大鼠 PWL 基本稳定后取后3次测定结果的平均值作为基础值 (baseline)。测定时热源强度维持在恒定水平,使基础痛阈控制在8~12 s左右。为防止大鼠热辐射烫伤,将PWL的上限值 (cut-off time) 定为20 s。
(3)脊髓IL-1β、NLRP1、Caspase-1检测
全部实验结束后 (P14),迅速新鲜取材脊髓 (L4-5节段)背角置于液氮中,最后储存于-80℃保存待测。ELISA法检测脊髓成熟蛋白IL-1β表达变化,real time-PCR检测脊髓NLRP1、caspase-1 mRNA表达变化。
7.统计学分析
采用 SPSS 20.0 统计软件进行统计学分析,所有数据均用均数±标准误 ()表示。实验数据符合正态分布,采用单因素方差分析;不符合正态分布,采用秩和检验中独立样本比较。P< 0.05为差异有统计学意义。
结 果
1.神经病理性疼痛大鼠机械痛、热痛行为学变化
与假手术组相比,模型组 (CCI) 大鼠从造模后第7天、第14天,机械痛、热痛阈值均显著降低 (P< 0.01);与模型组相比,多次电针可显著提高CCI大鼠机械痛、热痛阈值 (P< 0.01),非电针并未改变痛行为学变化(见图1A, 1B)。
与模型组相比,多次脊髓鞘内注射VX-765则可明显提高大鼠机械痛、热痛阈值(P< 0.01),而多次脊髓鞘内注射MDP却可进一步降低大鼠机械痛、热痛阈值 (P< 0.01、P< 0.05,见图 2A, 2B)。
2.神经病理性疼痛大鼠脊髓NLRP1、Caspase-1mRNA表达变化的影响
在造模后第14天,与假手术组相比,模型组大鼠脊髓背角NLRP1、Caspase-1mRNA表达显著增加(P< 0.01);与模型组相比,多次电针可显著降低脊髓背角NLRP1、Caspase-1mRNA的表达 (P< 0.01),鞘内注射caspase-1抑制剂 (VX-765)可显著抑制脊髓背角NLRP1、Caspase-1mRNA的表达 (P< 0.01);相反,鞘内注射NLRP1激活剂 (MDP)则进一步上调脊髓背角NLRP1、Caspase-1mRNA的表达 (P< 0.01,见图 3A, 3B)。
3.神经病理性疼痛大鼠脊髓IL-1β表达变化的影响
在造模后第14天,脊髓ELISA检测方法结果提示,与假手术组相比,模型组大鼠脊髓背角成熟蛋白IL-1β的表达显著增加 (P< 0.01);与模型组相比,多次电针可显著降低脊髓背角IL-1β蛋白的表达 (P< 0.01),脊髓鞘内注射caspase-1抑制剂 (VX-765)可显著抑制脊髓成熟蛋白IL-1β的表达 (P<0.01);相反,鞘内注射NLRP1激活剂 (MDP) 则进一步上调脊髓IL-1β的表达 (P< 0.01,见图4)。
讨 论
神经病理性疼痛是由躯体感觉神经系统的损害或疾病导致的疼痛;神经病理性疼痛发生时,脊髓中枢内出现显著的神经炎症,抑制脊髓中枢炎症可减轻痛敏反应[13,14]。经典CCI神经病理性疼痛大鼠模型,在一定程度上模拟临床干性坐骨神经病理性疼痛特点。本课题组前期研究证实,电针“环跳”、“阳陵泉”穴对神经病理性疼痛大鼠具有显著镇痛作用[12,15],临床应用二穴电针治疗坐骨神经病理性疼痛,疗效明确,其脊髓中枢机制有待进一步明确[16,17]。
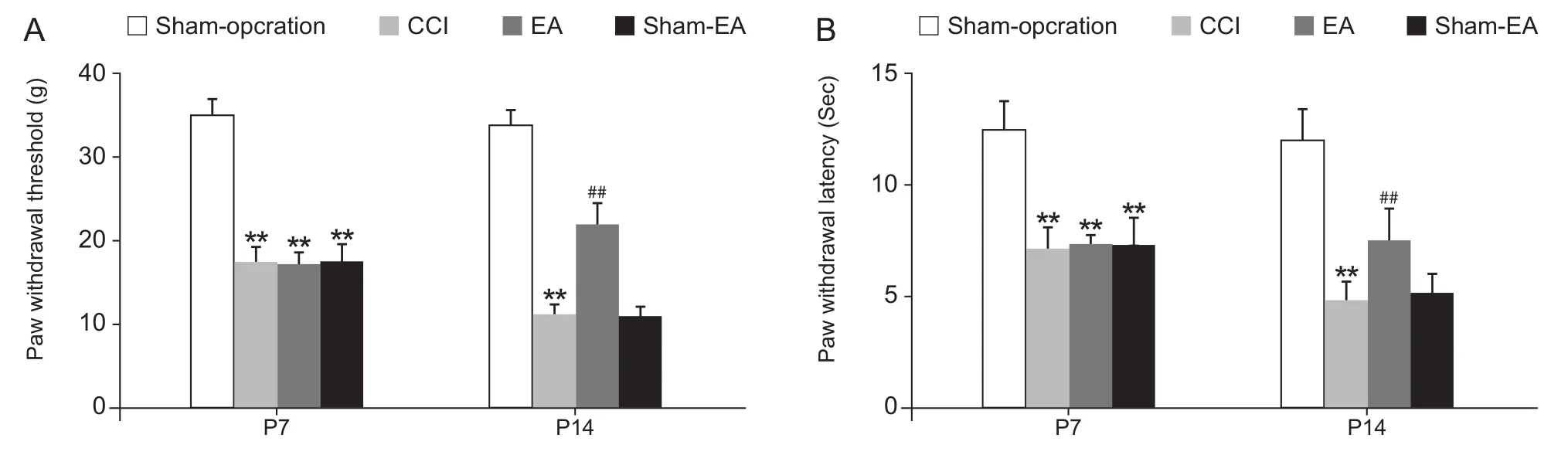
图1 电针对神经痛大鼠机械痛、热痛行为变化的影响(n = 6,EM)Fig.1 Changes of the paw withdrawal threshold and paw withdrawal latency with Electroacupuncture intervention (n = 6,EM)
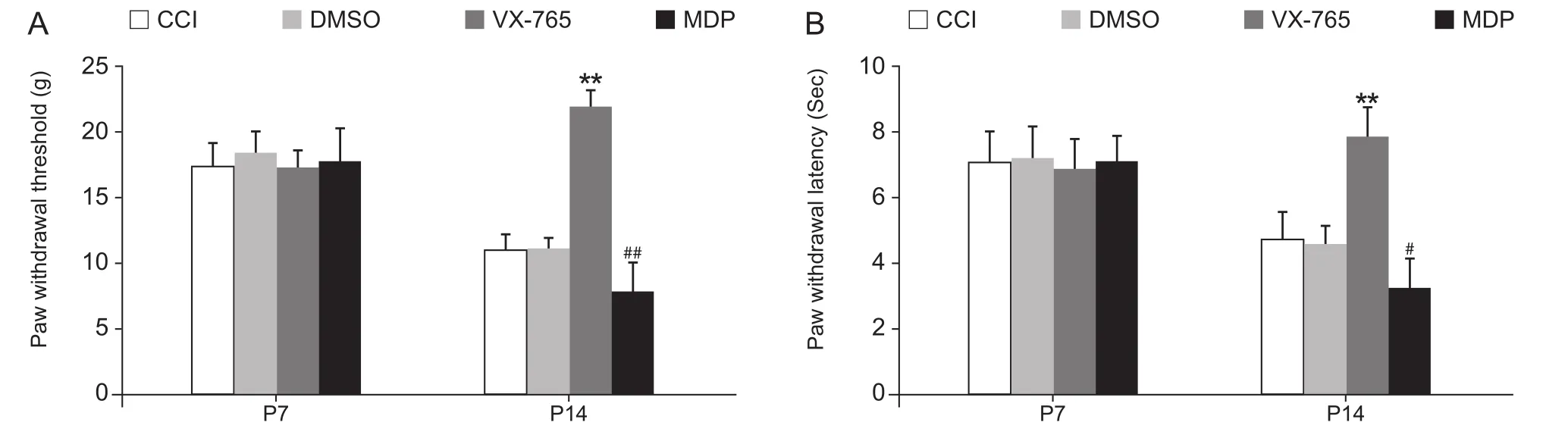
图2 NLRP1Caspase-1对神经痛大鼠机械痛、热痛行为变化的影响(n = 6,EM)Fig.2 Changes of the paw withdrawal threshold and paw withdrawal latency with NLRP1Caspase-1 pathway regulation (n = 6,EM)
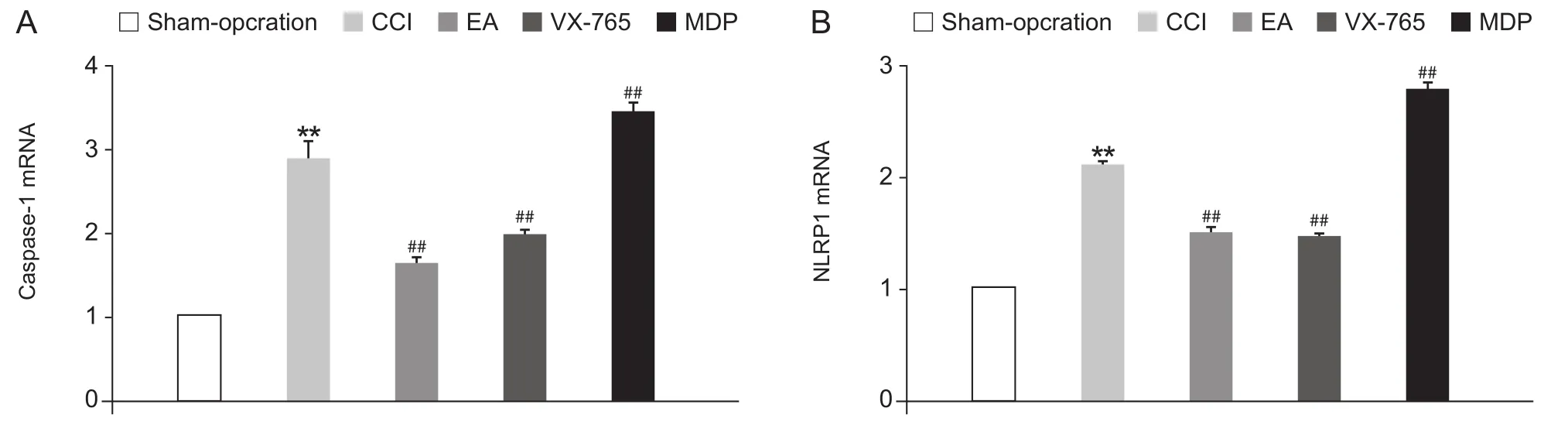
图3 电针对神经痛大鼠脊髓NLRP1、Caspase-1mRNA表达变化的影响(n = 4,EM)Fig.3 Changes of the spinal expression of NLRP1 and Caspase-1 mRNA with Electroacupuncture intervention(n = 4,EM)
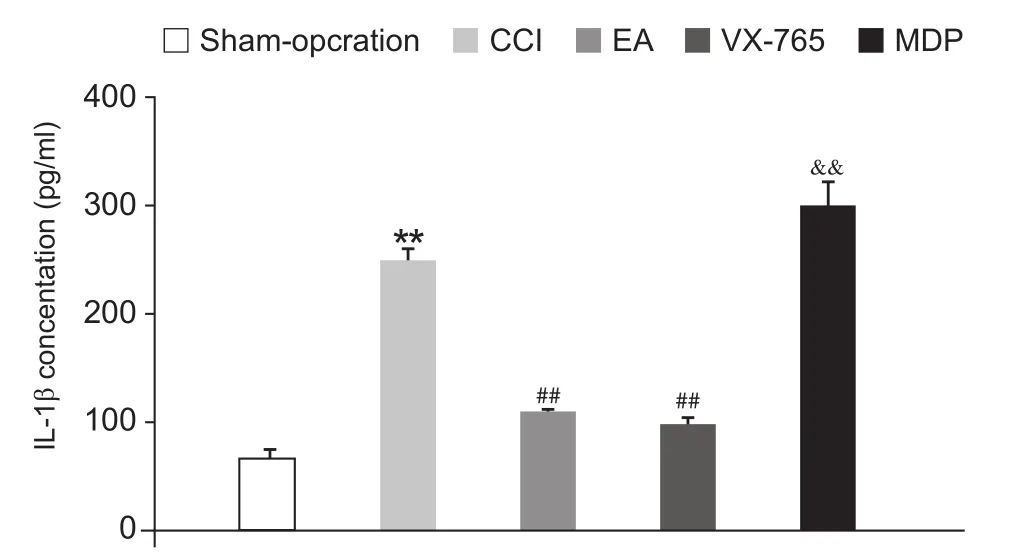
图4 电针对神经痛大鼠脊髓IL-1β表达变化的影响(n = 4,EM)Fig.4 Changes of the spinal expression of IL-1β protein with Electroacupuncture intervention (n = 4,EM)
坐骨神经病理性疼痛属中医学痹症的范畴,现代医学分析,环跳、阳陵泉穴深层解剖 为坐骨神经及其分支;针刺刺激穴位邻近神经及其周围血管,可促进局部血液循环,改善局部炎症和渗出,缓解神经病理性疼痛症状[18]。
本课题组前期研究表明,在神经病理性疼痛的发生及发展中,脊髓胶质细胞活化可释放促炎症因子(IL-1β、IL-6等),维持脊髓中枢敏化和神经炎症反应。在神经病理性疼痛大鼠脊髓中,NLRP-l炎症小体被显著激活,激活的NLRP-l及caspase-1主要表达于脊髓背角浅层星形胶质细胞中[6,11,19]。当受到外来刺激时,激活的炎症小体NLRP-l可水解其组成结构中的pro-caspase-1分子使其成为成熟caspase-1,成熟caspase-1大量释放并剪切IL-1β前体分子变成为成熟IL-1β,参与炎症反应过程[20]。结合既往文献报道及前期研究,本实验说明,神经病理性疼痛发生发展过程中,脊髓内炎症小体NLRP-l和caspase-1激活,促进脊髓IL-1β成熟释放,维持中枢敏化和神经炎症,表现机械痛和热痛过敏反应。应用电针或caspase-1抑制剂可降低脊髓IL-1β表达水平,提高神经病理性疼痛大鼠痛阈值,从而发挥抗炎镇痛作用;然而,经典NLRP-l激活物(胞壁酰二肽,MDP)鞘内注射可显著激活NLRP-l-caspase-1-IL-1β信号通路,促进脊髓IL-1β释放增多,进一步诱发痛敏反应。
综上所述,神经病理性疼痛发生发展与脊髓背角NLRP-l-caspase-1-IL-1β信号通路活化存在密切的联系,电针抗炎镇痛作用机制可能与抑制脊髓NLRP-l-caspase-1-IL-1β通路活化有关,今后可应用NLRP-l、IL-1β、Caspase-1等基因敲除小鼠深入开展实验,进一步明确电针抗炎镇痛的脊髓中枢IL-β调节机制。

