南太湖地区一典型青虾养殖池塘中微囊藻毒素 浓度与环境因子间的相关性
张荣飞,邓泽融,吴陈涛,金敏敏,胡晓斌
(湖州师范学院生命科学学院,浙江湖州 313000)
池塘是我国淡水养殖的主要水体。长三角地区是我国主要的淡水养殖区,遍布着大量的淡水养殖池塘。养殖水体必须施肥以维持一定种类和数量的有益藻类、原生动物、微生物等,俗称肥水,肥水会导致水体富营养化。另外,不当养殖也会加剧水体富营养化。主要原因:一方面,大量投喂外源性饲料导致的大量残饵和水生动物排泄物在水体中腐烂,使水中的溶解氧降低,氨氮上升,使养殖水体水质恶化、病原滋生;另一方面,养殖排出的水很少经过安全处理再排放,加剧了周围水域的富营养化程度,使公共水域被污染,蓝藻大量繁殖,导致蓝藻水华和藻毒素污染[1-2]。目前的养殖模式大大超过环境的容量和自净能力[3]。
微囊藻毒素(MCs)是一类结构上有联系的单环七肽化合物,有超过70种异构体。在我国太湖地区水体中存在最普遍、含量相对较多且毒性较大的两种MC异构体为MC-LR、MC-RR(L和R分别代表亮氨酸、精氨酸)[4]。MCs在有毒蓝藻死亡裂解时被大量释放出来。
Magalhaes等[5]和Mohamed等[6]的研究结果均认为,MCs在鱼体内的积累会对摄入人群造成健康隐患[7]。
青虾(Macrobrachiumnipponense)是我国产量最大的淡水虾,其肉质鲜嫩,营养丰富。近些年来,为提高养殖产量,养殖户大量使用人工饲料,导致水体中蓝藻大量繁殖,藻毒素增加,严重影响了养殖产品的质量[7-8]。因此,有必要了解MCs在养殖水体中的分布及其与养殖水环境因子的相互关系。本研究选取南太湖地区一典型的淡水青虾养殖池塘作为研究对象,对水体中MC-LR、MC-RR 及主要环境因子进行了监测,研究了MCs在养殖水体中的时间分布特征及影响因素,为淡水养殖水体的MCs控制提供依据。
1 材料与方法
1.1 养殖池塘基本情况
选取的淡水青虾养殖池塘位于浙江省湖州市南浔区,近似正方形,面积4600 m2,水深在1.2~1.4 m左右,人工池塘。虾塘在8月份干塘清淤,进行曝晒。在虾苗放养前7~10 d,用生石灰干法清塘。注水后施经发酵腐熟的有机肥,以培养虾苗的开口饵料。施肥后进行水生植物栽培,品种有喜旱莲子草(水花生)和苦草轮叶黑藻。浮面水生植物栽种面积占虾塘面积的10%~20%,在离塘埂1 m的浅水处,沿塘四周栽培,宽1 m左右。沉性水生植物栽种离塘埂2 m以上。饲料以投喂青虾颗粒饲料为主,并适当投喂小杂鱼、螺蛳、蚌肉等动物性饲料。饲料无发霉腐败变质、无污染。虾塘中配备增氧机,虾塘配备2台功率1.2 kW的增氧机。该虾塘初始放养青虾苗密度为30 000尾/kW,初始放养重量约为1.25 g/尾。饲料系数在1.36。
1.2 样品采集
将养殖池塘分为近似相等的四个区块,在每个区块中间位置进行取样。虾塘在8月份注水和调水, 9月份投放虾苗,12月份开始捕捞上市。因此,采样时间为2015年8—12月,上午11:00左右,每周采样一次,使用有机玻璃采水器,采集水面下0.3 m处的水样,将采集水样混匀后储存。气温和水温在采样时直接测定,总磷(TP)、总氮(TN)、氨氮(NH3-N)、pH值等指标也在现场测定,其他指标在水样送回实验室后,根据不同监测指标的具体要求保存样品,待测。
1.3 水质指标的测定方法
1.3.1 TP 、 TN、NH3-N等常规指标的分析测定
采用HACH公司的DR2800的便携式水质分析仪。TN采用过硫酸钾氧化显色分光光度法,TP采用过硫酸钾-钼酸盐-抗坏血酸显色光度法,NH3-N采用水杨酸显色光度法;叶绿素(Chl-a)含量采用0.45 μm滤膜过滤水样后丙酮提取,用分光光度法测定[9]。用Lugol试剂固定水样,然后沉淀、浓缩,用高倍显微镜计数得到蓝藻密度[10]。
1.3.2 MCs的分析测定
分别用10 mL 甲醇和10 mL 纯水以 5 mL/min 的流速流过Sep-pak SPE小柱,以活化小柱;量取1 000 mL 经0.45 μm 滤膜过滤的水样,连接SPE固相萃取装置将水样通过活化过的SPE小柱,进行富集,流速为4 mL/min;富集完毕,用10 mL 5% 的甲醇水溶液淋洗小柱,流速同上;用氮气吹干SPE小柱 10 min;用5 mL 纯甲醇洗脱两次;用氮吹仪将洗脱液浓缩至0.5 mL 以下,用甲醇定容至0.5 mL 并转移到棕色的色谱进样瓶内,待上机分析。
MCs 检测采用美国AB Sciex Instuments公司的API QTRAP@ 4000 LC-MS/MS液质联用系统,配有三重四级杆质量分析器和电喷雾(ESI)离子源。HPLC流动相:A为甲醇-乙腈(1+1)溶液(体积分数,下同);B为0.1%甲酸水溶液;流量为0.2 mL/min;进样量为10 μL。选择正离子监测模式(ESI+)选择反应监测(MRM);毛细管电压3.0 kV;测定MC-LR的监测离子为:母离子的m/z 995.7,定性离子的m/z 553.2,定量离子的m/z 135.0。测定MC-RR的监测离子为:母离子的m/z 520.0,定性离子的m/z 440.2,定量离子的m/z 135.0。
水质分析试剂为购自美国HACH公司的专用试剂。MCs标准样品购自中国国家标准物质研究中心(纯度>95%)。
1.4 数据统计和作图方法
用SPSS 17.0 对水质数据进行统计分析,用Origin 9.0作图。
2 结果与分析
2.1 虾塘水质结果
从表1可看出,TN含量为0.2~5.9 mg/L,TP含量为0.47~1.99 mg/L,水体处于严重的富营养化状态。
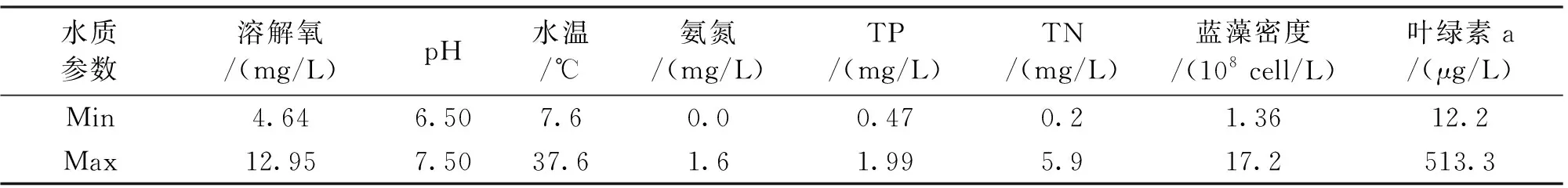
表1 2015年8—12月淡水青虾养殖池塘水质总体情况
2.2 池塘水体中MCs的浓度变化
监测结果显示,整个监测期间都检测到了MC-LR和MC-RR,MC-LR的最高浓度达到了102.3 mg/L,MC-RR的最高值为32.6 mg/L。MC-LR的浓度要高于相应时段的MC-RR,特别是在11月中旬,MC-LR的浓度远远高于MC-RR的浓度(图1)。监测数据的统计分析表明,MC-LR 和MC-RR的浓度随时间变化呈显著性正相关(P<0.05,r=0.440)。

图1 虾塘水体藻毒素的浓度变化
2.4 池塘水体中NH3-N、TN和水温的关系
从图2和图3可以看出,NH3-N和TN在检测期间波动上升,而水温总体波动下降。统计结果也显示,NH3-N与水温呈显著性负相关(P<0.01,r=-0.824),TN与水温呈显著性负相关(P<0.01,r=-0.794)。NH3-N含量在8月初虾塘刚蓄水时,随着蓄水放养青虾时间的增加一直波动上升,至12月上旬达到最高值1.6 mg/L,并在12月份维持在1.2 mg/L。TN含量也从蓄水初期的0.0 mg/L左右波动上升,10月中下旬 达最高值5.6 mg/L,在随后的监测时间段内保持在高位波动。水温随着季节的变化不断下降,从八月初的37.6 ℃,下降至12月底的7.6 ℃。

图2 虾塘水体氨氮浓度和水温的变化
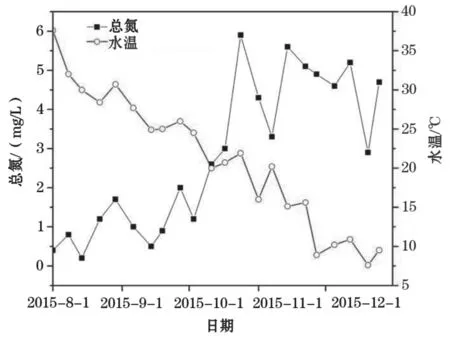
图3 虾塘水体总氮浓度和水温的变化
2.5 池塘水体中MCs和TN、TP的关系
对数据的统计分析表明:TN与MC-LR呈显著性正相关(P<0.05,r=0.436);TP与MC-LR也呈显著性正相关(P<0.05,r=0.500)。从图4、图5也可看出体TN、TP分别与MC-LR的波动趋势在整体上呈现出一定程度上的一致性。TP在整个检测期间波动也非常明显。从8月份虾塘蓄水初期的0.47 mg/L上升至11月初的1.99 mg/L,然后又下降至12月份的0.6 mg/L左右。TP与MC-RR在整个监测周期内呈极显著正相关(P<0.01,r=0.757)(图6)。
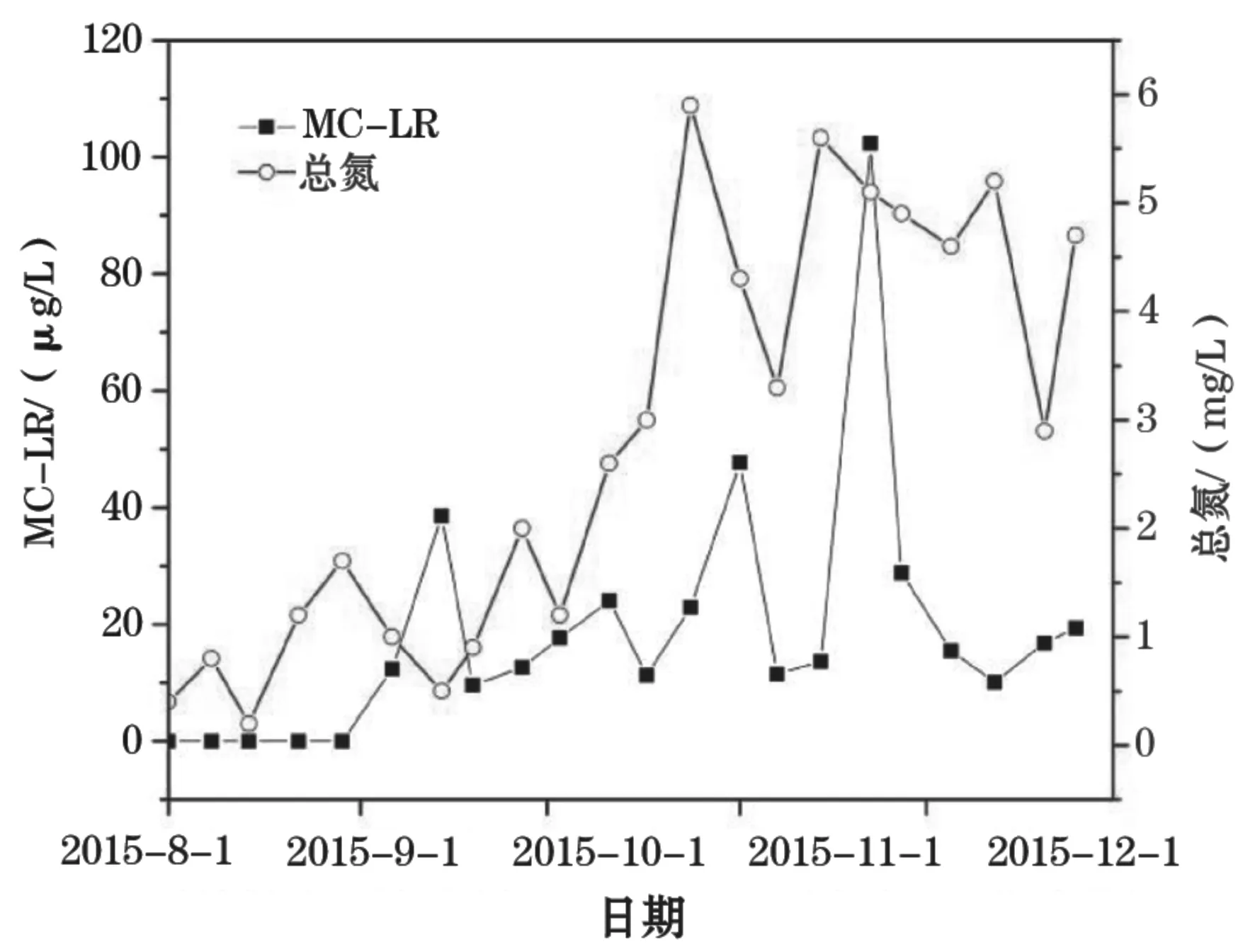
图4 虾塘水体MC-LR和总氮浓度的变化
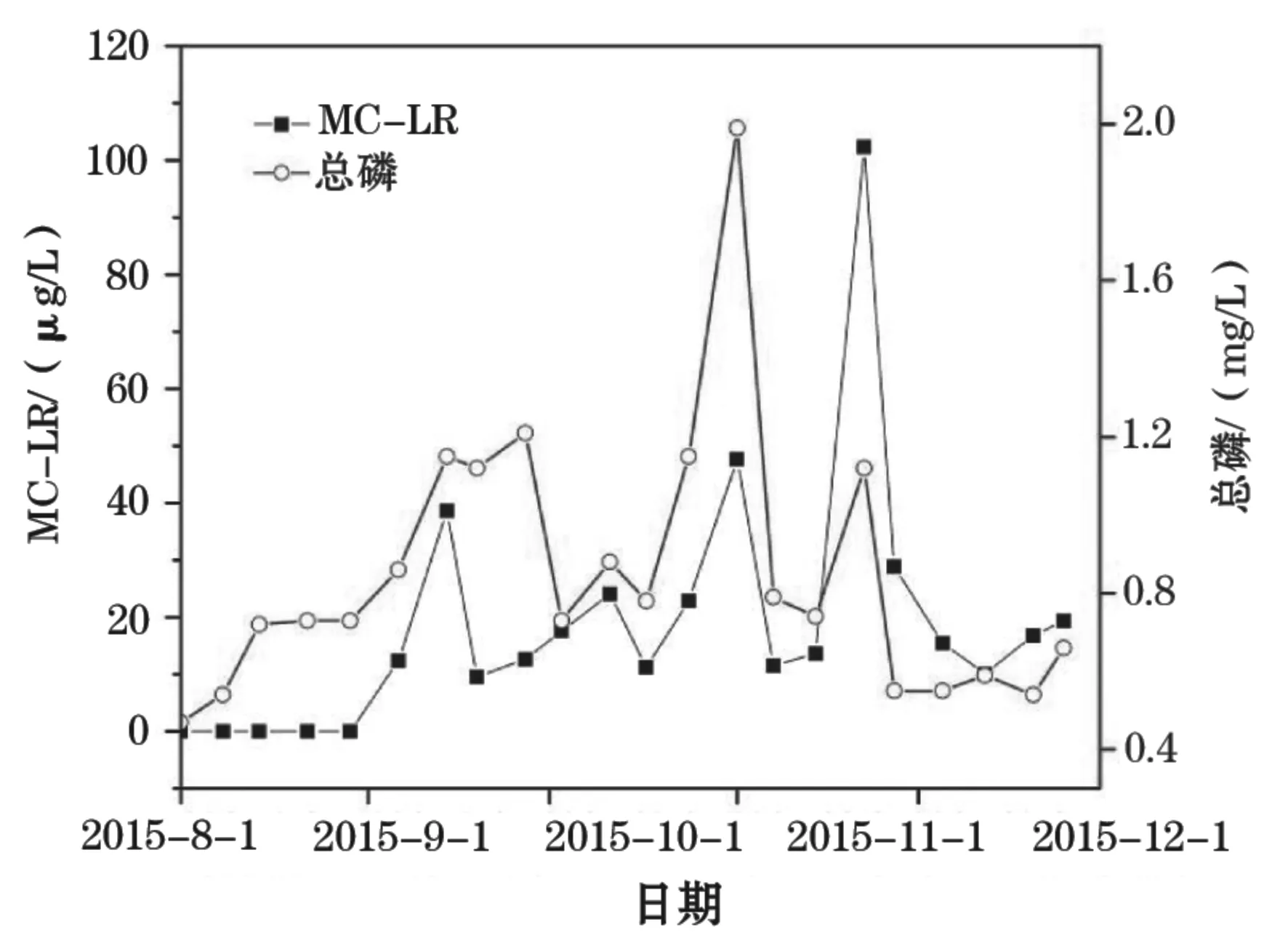
图5 虾塘水体MC-LR和T总磷浓度的变化
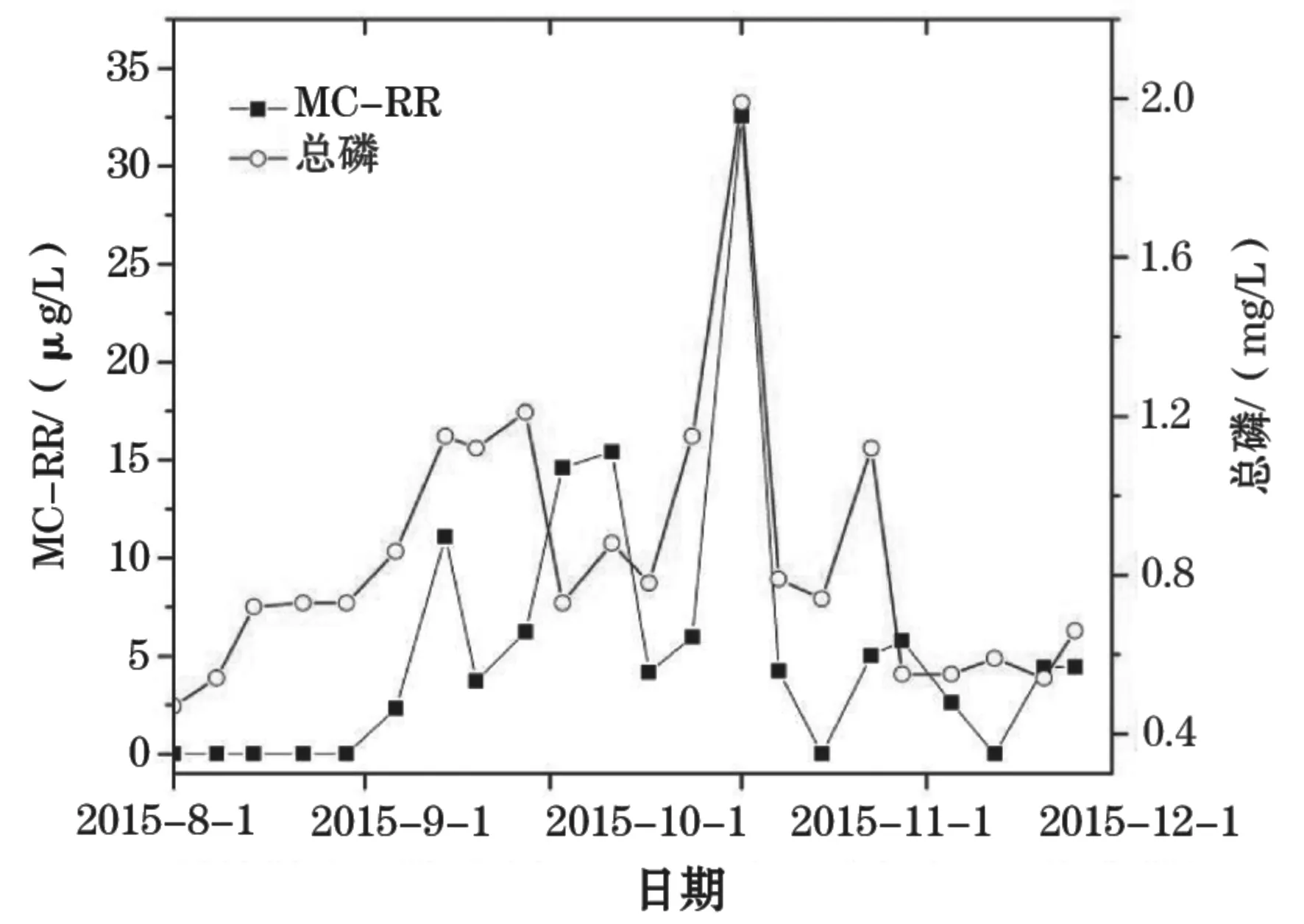
图6 虾塘水体MC-RR和总磷浓度的变化
2.6 池塘水体中Chl-a与TP、MCs的关系
对监测结果的统计分析结果表明:池塘水体中Chl-a与TP呈极显著正相关(P<0.01,r=0.692) (图7),Chl-a与MC-RR的浓度变化也表现出显著的正相关(P<0.05,r=0.454)(图8),Chl-a与MC-LR的浓度变化也表现出一定的正相关关系,但不显著(P=0.062,r=0.404)(图9)。Chl-a 的含量在12.2~513.3 μg/L之间波动巨大。在8月初刚蓄水时,水中Chl-a含量较低,然后不断上升,至9月上旬达到一个高峰,超过300 μg/L,然后是一个明显的下降过程,至10月上中旬下降至蓄水以来的最低浓度,接着在10月下旬迅速上升至整个检测期间的最高浓度,在11月中旬再次显著下降,至12月底一直维持在一个较低的浓度水平。

图7 虾塘水体Chl-a和TP浓度的变化
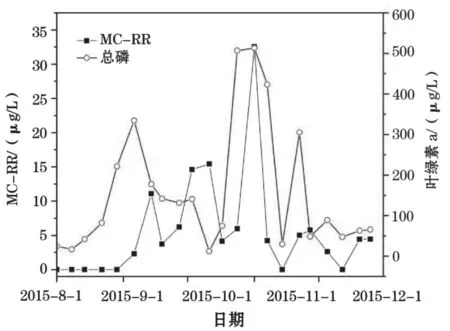
图8 虾塘水体叶绿素a和MC-RR浓度的变化

图9 虾塘水体叶绿素a和MC-LR浓度的变化
3 讨论
3.1 MCs浓度的变化
水质监测数据(表1)显示水体处于严重的富营养化状态。一般认为蓝藻生长繁殖的最适宜温度在 25~30 ℃[11],而从8月底至11月初,池塘水温主要为20~30 ℃,对蓝藻的生长繁殖较为有利。所以,在此期间,蓝藻繁殖速度较快,产生了明显的水华和MCs污染。但是,在9—11月,水体中游离的MCs浓度只是维持在10~50 mg/L,并未达到整个监测期间内的最高水平。其主要原因在于MCs 是一类受产毒基因调控,在胞内代谢产生的毒素,MCs主要集中在细胞的类囊体核区,只有当藻细胞死亡、破裂时才会释放到水体中[12]。当蓝藻处于旺盛繁殖阶段的时候,只有小部分蓝藻开始死亡[13-14],MCs没有大量释放到水中。另一方面,在此期间,富营养化的水体和相对较高的温度也有利于其它微生物的繁殖,其中包括可降解MCs的微生物[15-16]。同时,在自然光照条件下,水体中的光敏性物质会产生氧化性很强的活性氧自由基,被自由基氧化也是MCs分子消除的一个重要途径[17]。
在11月中下旬,游离MCs的浓度相比之前大幅上升,达到了整个监测期间的最高值。主要原因是水温下降至10 ℃以下,蓝藻细胞开始大量死亡,大量的MCs被释放到水体中,MCs的生物降解速度显著下降,同时,光照强度也显著减弱。进入12月份以后,由于水温很低,蓝藻繁殖受到极大抑制,MCs浓度显著下降。
3.2 营养盐浓度变化
从统计结果看,温度对TN和NH3-N有显著性影响。在监测期间TN含量和NH3-N含量保持上升趋势。由于季节变化,水温不断下降,使得NH3-N和TN含量与水温形成了一种显著的负相关关系。由于淡水青虾养殖池塘9月上旬才开始投放虾苗,所以在8—9月期间,水体TN含量不是很高,随着养殖时间的不断延长,投饵量和排泄物的增加,养殖水体TN含量显示出明显上升的趋势,从0.2 mg/L增加到最高5.9 mg/L,饲料投喂可能是TN保持较高浓度最重要的原因。另一方面,水温也会影响浮游植物的种类、数量和活动性,从而间接影响到水中营养物质的含量[18-19]。有研究表明,水温对沉积物中氮的释放速率有显著影响,温度上升有利于沉积物种营养元素的释放[20-21]。有些水体微生物倾向于在相对低温(5 ℃)的环境中展现出更高的降解有机氮的活性。因此,随着水温的降低,沉积物中的有机氮也会被转化为无机氮释放到水体中[21]。这可能也是NH3-N含量在12月份保持稳定的一个重要原因。
从8月份蓄水初期至11月,TP含量总体上升明显。其主要原因可能是随着养殖时间的增加,投饵量不断增加,同时,残饵量和排泄物的累积,使TP含量表现出明显上升的趋势。另一方面,水温对TP的含量也有一定的影响,一般来讲,大部分的无机磷以难溶盐形式存在于水体中,水温较高时,磷盐的溶解度增加,同时微生物活动能力强,增加了水体沉积物中有机质的矿化和分解,导致了沉积物中氧化还原电位降低,铁离子被还原,使磷从磷酸铁沉淀中释放出来。温度上升也会使各种水生动物活动性增强,增加水体的搅动性,导致沉积物颗粒处于悬浮态,也会导致TP增加[22]。到了12月份,水温明显下降,水生动物摄食量下降,投饵量也会有所降低,同时,从沉积物释放至水柱的TP也会随之下降。
氮不但是藻类生长的必需营养元素,而且也是合成MCs分子的必需元素,水体氮元素含量缺乏会抑制藻类的生长繁殖[23]。水体中TN从蓄水初期的0.2 mg/L不断增加至5.9 mg/L,均值为2.82 mg/L。水体中TN含量的增加会导致蓝藻的生长繁殖加快,MCs的浓度随之升高。另一方面,由于秋季水温低于夏季,适宜的水温又使蓝藻迅速繁殖形成水华,水面形成一层含有蓝藻的绿色膜,MCs的浓度也显著增加,但统计结果表明MC-RR与TN无显著相关性。
TP与MCs浓度变化表现出的显著性正相关可能与二者的季节变动存在一致性有关。关于TP 对MCs 的影响至今也没有一致的研究结论。Utkilen 等[24]认为磷对MCs的产生没有影响,而Sivonen[11]认为当磷的含量在0.1~0.4 mg/L范围内时,MCs 浓度与磷含量呈正相关,当磷含量进一步上升时,其与MCs 无显著相关性。也有研究表明微囊藻的产毒能力随着磷浓度的减小而增加[25-26]。
3.3 Chl-a与蓝藻密度的变化
一般认为,尽管不同的浮游藻类在其生长过程中对营养盐的需求不完全相同,在多数水体中,浮游藻类的生物量仍会与水体中的营养盐浓度变化基本一致[27]。藻类的生物量与Chl-a含量有正相关关系。有研究者认为,水体中营养盐增加会导致其中藻类生物量的显著增加[28],但也有研究报道,湖泊中水体藻类的生物量与水体中的营养盐浓度之间并不具有显著的相关性[29]。这表明营养盐对藻类生物量的影响不是一个单因素简单作用关系。
由于虾塘是人工投喂的养殖池塘,为水体提供了较为丰富的N、P营养,故N、P含量并不是藻类生长的限制因子。因此,Chl-a含量的变化可能不是由于N、P营养盐的浓度波动引起。监测期间阴雨天较多,但在10月中下旬,连续稳定的晴天,使得池塘藻类快速繁殖,Chl-a水平迅速上升,形成了一个峰值。
统计结果显示出Chl-a浓度与MCs浓度变化之间呈正相关,而Chl-a与蓝藻密度并无显著性相关。在蓝藻爆发季节,Chl-a浓度和蓝藻密度通常具有显著性正相关[30]。这表明,Chl-a最大峰值并非由于蓝藻爆发导致。由于MCs的峰值通常在蓝藻细胞大量死亡之后才出现,因此,此次统计上的Chl-a与MCs浓度变化之间的正相关关系并不意味着此二者之间有必然的一致性。

