紫杉醇对牛血清白蛋白诱导大鼠肝纤维化的抑制作用及机制
边虹铮,刘丽芳
(河北化工医药职业技术学院 制药工程系,河北 石家庄 050031)
肝纤维化是各种慢性肝病的共同病理基础,是一种以胶原纤维为主的细胞外基质弥漫性过度增生、沉积并逐渐发展致肝硬化的结缔组织主动增生过程[1]。肝纤维化的过程已被公认为是可逆的,因此早期控制或逆转肝纤维化,减少肝硬化从而可以抑制门静脉高压、肝癌的发生,具有重要意义。紫杉醇是在红豆杉的树皮分离提纯的天然次生代谢产物,具有良好的抗肿瘤作用,临床上广泛用于乳腺癌、卵巢癌和部分头颈癌和肺癌的治疗[2-3]。近年来国内外相关研究发现低剂量紫杉醇对肝纤维化具有明显的抑制作用,但主要集中在体外实验。本研究采用牛血清白蛋白(BSA)诱导的免疫性肝纤维化大鼠模型,探讨紫杉醇在体内的治疗作用及机制,为临床使用紫杉醇防治肝纤维化提供实验及理论依据。
1 材料与方法
1.1 动物
SPF级Wistar大鼠100只,均为雄性,4~6周龄,体质量为150~170 g,购自北京维通利华实验动物技术有限公司[批号:SCXK(京)2016-0032,合格证号:11600700047345],于我院实验动物中心适应性饲养7 d进行实验。温度20~26 ℃,湿度40%~70%,12 h明暗交替。
1.2 药品与试剂
注射用紫杉醇脂质体购自南京绿叶制药有限公司,给药时予葡萄糖生理盐水稀释至相应浓度。BSA及弗氏不完全佐剂购自美国Sigma公司;戊巴比妥钠北京大田丰拓化学技术有限公司;羟脯氨酸(Hyp)试剂盒及总蛋白(TP)、白蛋白(ALB)、天门冬氨酸氨基转移酶(AST)、丙氨酸氨基转移酶(ALT)测试盒均购自南京建成生物工程研究所;兔抗鼠透明质酸(HA)、层黏蛋白(LN)、III型前胶原(PCIII)、IV型胶原(IVC)及同型二抗ELISA试剂盒与抗α-SMA单抗、抗TGF-β1单抗及相关试剂盒均购自武汉博士德生物工程有限公司。Western blot全套试剂购自美国BD公司。TRIzol、M-MLV逆转录酶、Platinum Taq DNA聚合酶购自美国Invitrogen公司。
1.3 方法
1.3.1 肝纤维化大鼠模型制备 模型制备方法参照文献[4-5]方法并略加修改。实验大鼠于第2、4、5、6、7周皮下多点注射9 mg/mL BSA弗氏不完全佐剂乳剂冲击免疫接种,每次0.5 mL,共注射5次。第8周内眦采血通过琼脂平板双向扩散法验证大鼠是否产生BSA抗体。取BSA抗体阳性大鼠,尾静脉攻击注射BSA生理盐水溶液0.4 mL/次/只,每周2次,剂量为每次2.0 mg逐渐递增为3.6 mg,共攻击注射15次。对照组同期注射等体积生理盐水。
1.3.2 实验分组及处理 将成模大鼠随机分为模型组(尾静脉注射葡萄糖生理盐水)与紫杉醇组处理(尾静脉注射10 μg/g紫杉醇)。每天注射1次,连续给药28 d。另取10只正常大鼠作为对照组,处理同模型组。由于时间较长,部分大鼠实验过程中死亡,最终获得鼠数为模型组15只、紫杉醇组处理13只,对照组10只大鼠均存活。
1.3.3 标本采集 末次给药后10~12 h采用45 μg/g戊巴比妥钠麻醉,称重后腹主静脉取血并离心收集血清。放血处死大鼠后,迅速摘取肝脏并称重。肝脏分为3部分:⑴ 取大鼠肝脏右叶纵断面标本1块,厚度约为2 mm,4%多聚甲醛固定24~36 h后,移去固定液,双蒸水冲洗2次,梯度酒精脱水:75%15 min、85% 15 min、95% 15 min、95% 90 min、100% 20 min、100% 20 min; 二 甲 苯 I、II各20 min透明,浸蜡20 min,蜡温65 ℃包埋组织标本,采用McIlwain组织切片机切片,切片厚度4 μm,55 ℃摊片,HE及Masson染色,中性树胶封片。⑵ 剪取0.5 g肝组织检测Hyp含量。⑶ 剩余肝组织5 mL 0.1%胶原酶IV和5 mL 0.1%链霉蛋白酶消化后,200目尼龙滤网研磨制备成肝细胞悬液,参照文献[6]方法以40% Percoll分离液非灌流分离肝星状细胞(hepatic stellate cells,HSC),免疫组化鉴定α-SMA阳性率>95%。
1.3.4 指标检测 全自动生化分析仪检测血清中TP、ALB、AST、ALT浓度。按照ELISA试剂盒说明书检测血清HA、LN、PCIII、IV-C水平。采用样本水解法检测Hyp含量,按试剂盒说明书进行操作。肝脏石蜡包埋组织连续切片,切片厚度4 μm,HE染色进行细胞形态观察,并对纤维化程度进行分期及计分[7](0期:无纤维化;1期:汇管区纤维化扩大,限局窦周及小叶内纤维化;2期:汇管区周围纤维化,纤维间隔形成,小叶结构保留;3期:纤维间隔伴小叶结构紊乱,无肝硬化;4期:早期肝硬化);采用半定量计分系统[8]进行纤维化计分。EnVision二两步法α-SMA、TGF-β1免疫组化染色并进行分级及计分[9]。离心收集1×106个HSC,冰上裂解(RIPA裂解液和苯甲基磺酰氟按100∶1混匀)30 min,Western blot法检测转化生长因子β亚单位受体1(TβRI)、磷酸化(p)-smad2、p-Smad3、纤溶酶原活物抑制因子1(PAL-1)的蛋白相对表达水平,以β-actin为内参。TRIzol试剂盒提取HSC总RNA,M-MLV反转录成cDNA,real-time PCR反应检测TβRI、PAL-1 mRNA水平。引物序列见表1,由上海生工生物有限公司合成。反应条件:94 ℃预变性2 min;94 ℃变性 30 s、60 ℃退火 30 s、72 ℃延伸 1 min,35个循环;72 ℃延伸10 min。

表1 PCR引物序列Table 1 PCR primer sequences
1.4 统计学处理
采用SPSS 25.0软件处理,符合正态分布的数据用均数±标准差(±s)表示,方差齐的资料组间比较采用单因素方差分析,并采用LSD-t检验进一步行两两比较;方差不齐的资料组间比较采用Welch检验,并采用Tamhane's T2法进一步行两两比较。不符合正态分布的数据用中位数(范围)[M(范围)]表示,采用Kruskal-Wallis检验进行组间比较,组间比较有统计学意义的变量进一步进行两两比较,将P值进行Bonferroni校正。单项有序的分类资料采用Ridit检验进行分析。P<0.05为差异有统计学意义。
2 结 果
2.1 肝组织病理学观察
对照组肝组织结构基本正常,汇管区无扩大,小叶结构完整,未见纤维间隔。模型组肝小叶中央静脉增厚,呈环状并延伸至临近的肝细胞,窦周间隙增宽,弥散性纤维化,汇管区结节状改变,伴结缔组织沉淀及炎性细胞浸润。紫杉醇处理组大鼠汇管区及小叶纤维组织增生程度减轻,界板相对完整,小叶结构基本完整,窦周无明显纤维化,较少炎性细胞浸润(图1-2)。各组大鼠肝纤维化程度见表2。

图1 大鼠肝组织HE染色(×100) A:对照组;B:模型组;C:紫杉醇处理组Figure 1 HE staining of the rat liver tissues (×100) A: Control group; B: Model group; C: Paclitaxel treatment group

图2 大鼠肝组织Masson染色(×100) A:对照组;B:模型组;C:紫杉醇处理组Figure 2 Masson staining of the rat liver tissues (×100) A: Control group; B: Model group; C: Paclitaxel treatment group

表2 各组大鼠肝纤维化程度比较Table 2 Comparison of the degrees of liver fibrosis among groups of rats
2.2 血清肝功能生化指标比较
各组间TB差异无统计学意义(F=1.352,P=0.256),但ALB、AST、ALT差异均有统计学意义(均P<0.05)。与对照组相比,模型组ALB明显减低,AST、ALT水平明显增高(均P<0.05)。紫杉醇脂质体治疗后,ALB水平明显升高,与模型组比较有统计学差异(P<0.05),ALB与AST水平可基本恢复至正常水平,与对照组比较差异无统计学意义(均P>0.05)(表3)。

表3 各组大鼠血清生化指标比较Table 3 Comparison of the biochemical indexes among groups of rats
2.3 血清胶原相关指标及肝组织Hyp比较
模型组血清HA、LN、PCIII及IV-C水平与肝组织Hyp水平均明显高于对照组(均P<0.05)。紫杉醇治疗组血清HA、LN、PCIII及IV-C水平以及肝组织Hyp水平均较模型组降低(均P<0.05)(表4)。

表4 各组大鼠血清胶原相关指标及肝组织Hyp水平Table 4 Comparison of the collagen-related variables in the serum and Hyp levels in the liver tissues among groups of rats
2.4 肝组织α-SMA、TGF-β1表达比较
模型组α-SMA、TGF-β1阳性率均为100.0%,与对照组比较明显升高(均P<0.05)。紫杉醇处理组α-SMA、TGF-β1表达均较模型组减低(均P<0.05),且TGF-β1表达与对照组比较无统计学差异(P>0.05)(图3-4)(表5)。
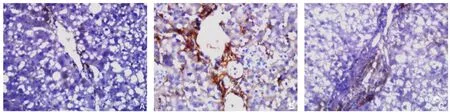
图3 α-SMA免疫组化染色(×400) A:对照组;B:模型组;C:紫杉醇处理组Figure 3 Immunohistochemical staining for α-SMA (×400) A: Control group; B: Model group; C: Paclitaxel treatment group

图4 TGF-β1免疫组化染色(×400) A:对照组;B:模型组;C:紫杉醇处理组Figure 4 Immunohistochemical staining for TGF-β1 (×400) A: Control group; B: Model group; C: Paclitaxel treatment group

表5 各组肝组织α-SMA、TGF-β1表达Table 5 Expressions of α-SMA and TGF-β1 in the liver tissues among groups of rats
2.5 HSC中TGF-β/Smad信号传导通路相关蛋白及mRNA表达情况
HSC中,各组p-Smad2蛋白表达无统计学差异(P>0.05);模型组TβRI、p-Smad3、PAL-1蛋白及mRNA均高于对照组(均P>0.05),而紫杉醇处理组TβRI、p-Smad3、PAL-1蛋白及mRNA均低于模型组(均P>0.05),且除PAL-1 mRNA水平高于对照组外,其他与对照组比较均无统计学差异(均P>0.05)(表6-7)。
表6 各组HSC中TβRI、p-Smad2、p-Smad3、PAL-1蛋白表达水平(±s)Table 6 The protein expressions of TβRI, p-Smad2, p-Smad3 and PAL-1 in HSCs among groups (±s)

表6 各组HSC中TβRI、p-Smad2、p-Smad3、PAL-1蛋白表达水平(±s)Table 6 The protein expressions of TβRI, p-Smad2, p-Smad3 and PAL-1 in HSCs among groups (±s)
注:1)与对照组比较,P<0.05;2)与模型组比较,P<0.05Note: 1) P<0.05 vs. control group; 2) P<0.05 vs. model group
组别 n TβRI p-Smad2 p-Smad3 PAL-1对照组 10 0.176±0.032 0.312±0.057 0.224±0.071 0.172±0.023模型组 15 0.502±0.0361) 0.337±0.052 0.455±0.0681) 0.350±0.0471)紫杉醇处理组 13 0.197±0.0202) 0.307±0.029 0.274±0.0582) 0.193±0.0622)
表7 各组HSC中TβRI、PAL-1 mRNA表达水平(±s)Table 7 The mRNA expressions of TβRI and PAL-1 in HSCs among groups (±s)
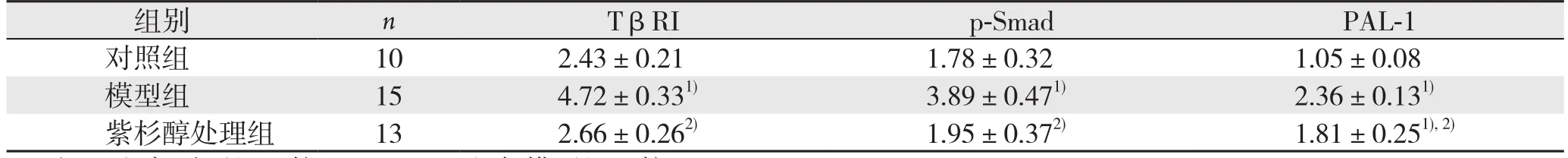
表7 各组HSC中TβRI、PAL-1 mRNA表达水平(±s)Table 7 The mRNA expressions of TβRI and PAL-1 in HSCs among groups (±s)
注:1)与对照组比较,P<0.05;2)与模型组比较,P<0.05Note: 1) P<0.05 vs. control group; 2) P<0.05 vs. model group
组别 n TβRI p-Smad PAL-1对照组 10 2.43±0.21 1.78±0.32 1.05±0.08模型组 15 4.72±0.331) 3.89±0.471) 2.36±0.131)紫杉醇处理组 13 2.66±0.262) 1.95±0.372) 1.81±0.251), 2)
3 讨 论
肝纤维化是肝脏中胶原蛋白等细胞外基质合成和降解失去平衡,在窦周间隙过度沉积,继之肝窦毛细血管纤维化,造成纤维在肝脏内沉积过多的病理过程[1]。目前肝纤维化大鼠有多种造模方式[10],本研究采用BSA诱导的免疫性肝纤维模型大鼠进行实验,此模型在致病因素上属于免疫损伤,更接近于病毒、炎症诱发的人类肝纤维化形成,且自愈性低,便于观察药物的治疗作用[4,10-11]。本研究模型组大鼠肝脏纤维结缔组织增生并存在弥漫性假小叶,窦间纤维间隔形成,而肝实质细胞可见轻微炎性浸润,血清HA、LN、PCIII、IV-C“肝纤四项”及肝组织α-SMA、TGF-β1、Hyp表达明显增高,提示纤维化模型构建成功。但本研究中模型组AST、ALT明显升高,ALB水平降低,考虑与本组肝脏细胞受损有关。
刘洋等[12]研究显示,低浓度紫杉醇(200 nmol/L)可以通过阻断TGF-β/Smad信号传导通路,下调胶原蛋白表达水平,从而逆转免疫性大鼠的肝纤维化状态。之后国内相关研究对博来霉素诱导的大鼠肝纤维模型[13]、CCl4诱导的SD大鼠肝纤维模型[14]、二甲基亚硝胺诱导的Wistar大鼠肝纤维化模型[15]进行研究,均证实低剂量紫杉醇对不同类型的大鼠肝纤维化模型有较好治疗作用。本研究参考上述文献及预实验数据,采用10 μg/g紫杉醇为动物实验所用剂量。
LN是细胞基底膜的主要成分,肝纤维化时明显增多,HA随着肝纤维化的加重而增高,血窦内皮细胞功能低下时HA升高更为明显。PCIII为反映肝脏纤维增生的指标,其含量与肝纤维化程度呈正相关。Hyp为胶原蛋白所特有,肝纤维化时肝内主要增多的成分即为胶原纤维。本研究发现,紫杉醇脂质体能明显降低肝纤维化时升高的血清LN、HA,PCIII、IV-C及肝组织Hyp含量,而且,紫杉醇亦能降低BSA诱导的纤维化大鼠血清AST、ALT水平,肝纤维化程度分期和积分均明显减低。
免疫组化结果显示,肝组织中HSC活化标志α-SMA与TGF-β1表达明显增高。TGF-β1是促肝纤维化重要的细胞因子,在肝纤维化的过程中发挥了重要作用。研究表明TGF-β/Smad信号传导通路是TGF-β1发挥生物作用的主要通路,TGF-β/Smad信号通路主要由配体(TGF-β超家族)、受体(TGF-βR超家族)、信号传递分子(Smad家族)构成。其主要过程为配体激活受体后,由多种Smad分子将膜信号传导到细胞核内引起基因的表达转录,使细胞外基质大量异常合成并抑制其分解,导致肝纤维化[20]。PAL-1是一种丝氨酸蛋白酶抑制剂,可阻止纤溶酶激活纤溶酶原导致ECM过多沉积。PAL-1的启动子上均存在有Smad结合位点(SBE),因而TGF-β1可能通过TGFβ信号通路传导促进PAL-1的分泌来促进肝纤维化[21]。相关研究[22]证实,在通过TGF-β1激活的大鼠HSC中,加入200 nmol/L浓度的紫杉醇能通过抑制磷酸化的Smad3来改善纤维化程度。本研究结果显示,紫杉醇组HSC中TβRI、p-Smad3、PAL-1蛋白及mRNA均较模型组明显下调,提示紫杉醇通过降低TRβI表达,减少TRβI的磷酸化作用,从而降低了Smad3的磷酸化水平,导致co-Smad转移至细胞核的信号相对减少。又通过抑制PAL-1基因的表达,使PAL-1蛋白质和mRNA的表达减少,从而促进了细胞外基质的降解,减轻了肝纤维化。
综上,本研究证实低剂量紫杉醇可下调TGF-β/Smad信号通路蛋白及mRNA的表达,同时下调HA、LN、PCIII、IV-C水平及血清AST、ALT水平,故推测其机制是通过抑制TGF-β/Smad信号通路,来下调HA、LN、PCIII、IV-C水平的,今后待进一步通过敲除TGF-β/Smad信号通路相关基因来进一步证实。

