慢性阻塞性肺疾病患者睡眠质量调查分析
张庆庆,黄玉蓉,罗 倩,刘盼盼,刘小丽
(1.石河子大学医学院,新疆 石河子 832003;2.新疆生产建设兵团医院石河子大学第二附属医院,新疆 乌鲁木齐 830002;3.北京京煤总医院,北京 100000)
慢性阻塞性肺疾病(Chronic obstructive pulmonary disease,COPD)是由有毒颗粒或气体导致气道和(或)肺泡异常的常见病、多发病,其主要特征为持续性呼吸道症状和气流受限。据世界卫生组织(WHO)的报告,于2012年COPD已成为全球第3大死亡原因,在我国40岁及以上人群患病率为9.9%,≥70岁人群患病率高达20.3%,且仍然呈上升趋势[1]。相关研究[2]表明53%~70%的COPD患者睡眠质量较差,这类患者更容易引起急性发作、二氧化碳潴留、低氧血症、肺动脉高压、心脑血管事件等,增加患者经济负担,降低患者的生活质量,预后更差。本文以COPD患者A组、B组为研究对象,采用PSQI对其睡眠质量进行调查分析。
1 对象与方法
1.1对象:随机选取我院2016年12月~2017年5月于门诊及住院COPD患者,根据GOLD指南病情严重程度综合评估后,入选两组患者各30例,收集其一般资料(包括性别、年龄、体重指数、病程)后,采用PSQI量表分析其睡眠质量。纳入标准:①所有患者均符合2017版GOLD指南[3]中COPD诊断标准: 在应用支气管扩张剂后,FEV1 /FVC<70%表明存在不完全可逆性气流受限,FEV1占预计值的百分比可判断COPD气流阻塞程度;②根据COPD评估测试(COPD assessment test,CAT)或改良英国医学研究理事会(MRC)呼吸困难指数(modified british medical research council,m MRC)评估COPD患者症状,A组:CAT<10,mMRC<2,近1年内急性加重次数0次或1次未导致住院,B组:CAT≥10,mMRC≥2,近1年内急性加重次数≥2次或1次导致住院;改良医学研究理事会(mMRC)呼吸困难评分。排除标准:①合并有肺癌、肺栓塞、心肌梗死、不稳定型心绞痛等引起急慢性疼痛者;②合并支气管哮喘、胸腔积液或积气、心力衰竭等影响睡眠疾病;③合并有睡眠呼吸暂停综合征,或长期服用催眠或镇静类药物者;④合并有焦虑、抑郁及精神系统疾病,影响沟通和认知能力者;⑤急性加重期并发呼吸衰竭,行通气治疗者。本研究经院伦理委员会审批通过,患者均知情同意。患者基本资料见表1。
1.2方法:睡眠质量评估 所有患者填写匹兹堡睡眠质量指数量表(Pittsburgh sleep quality index,PSQI)评定近1个月的睡眠质量,该量表包含19个自评和5个他评条目组成,而其中参与计分的18个自评条目可以组合成7个因子:主观睡眠质量、入睡时间、睡眠时间、睡眠效应、睡眠障碍、催眠药物、日间功能,每个因子按0~3分等级计分,累计各因子得分为匹兹堡睡眠质量指数量表的总分,最低0分,最高21分,分数越高睡眠质量越差。国内成年人睡眠质量的参考界值总分定为7分,>7分为睡眠质量差,≤7分为睡眠质量好,PSQI子项目>1分,表示该项目异常。

2 结果
2.1两组一般资料比较:A组、B组各30例,A组男19例,女11例,平均年龄(64.23±7.51)岁,平均病程(10.20±5.33)年,平均BMI(23.36±3.42)kg/m2,平均颈围(33.94±2.65)cm;B组男17例,女13例,平均年龄(64.60±7.62)岁,平均病程(10.73±6.83)年,平均BMI(24.47±3.49)kg/m2,平均颈围(34.4±2.70)cm。A组、B组之间性别构成比、年龄、体重指数、病程比较,差异无统计学意义(P>0.05),具有可比性。见表1。

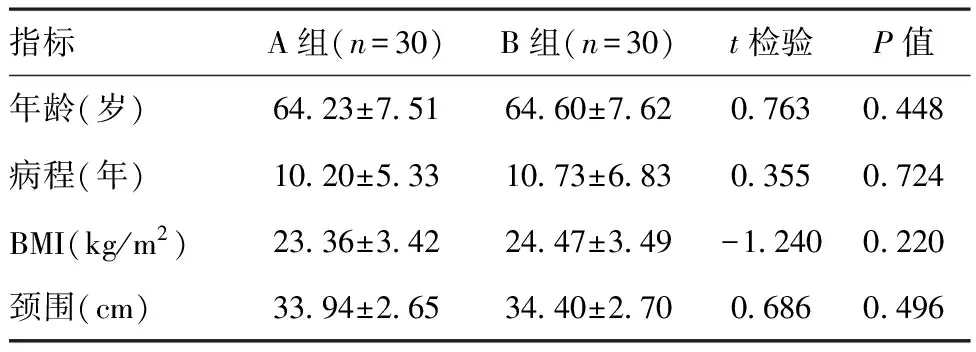
指标A组(n=30)B组(n=30)t检验P值年龄(岁)64.23±7.5164.60±7.620.7630.448病程(年)10.20±5.3310.73±6.830.3550.724BMI(kg/m2)23.36±3.4224.47±3.49-1.2400.220颈围(cm)33.94±2.6534.40±2.700.6860.496
注:BMI:体重指数
2.2两组睡眠情况比较:60例COPD患者经PSQI问卷调查,睡眠差者(总分>7分)共40例,阳性率为66.68%。A组PSQI总评分(7.53±0.604)分,阳性16例(53.33%),B组PSQI总评分(10.30±0.557)分,阳性24例(80.00%),见图1。B组患者的睡眠质量、睡眠时间、入睡时间、睡眠效应、睡眠障碍均高于A组,差异有统计学意义(P<0.05)。见表2。
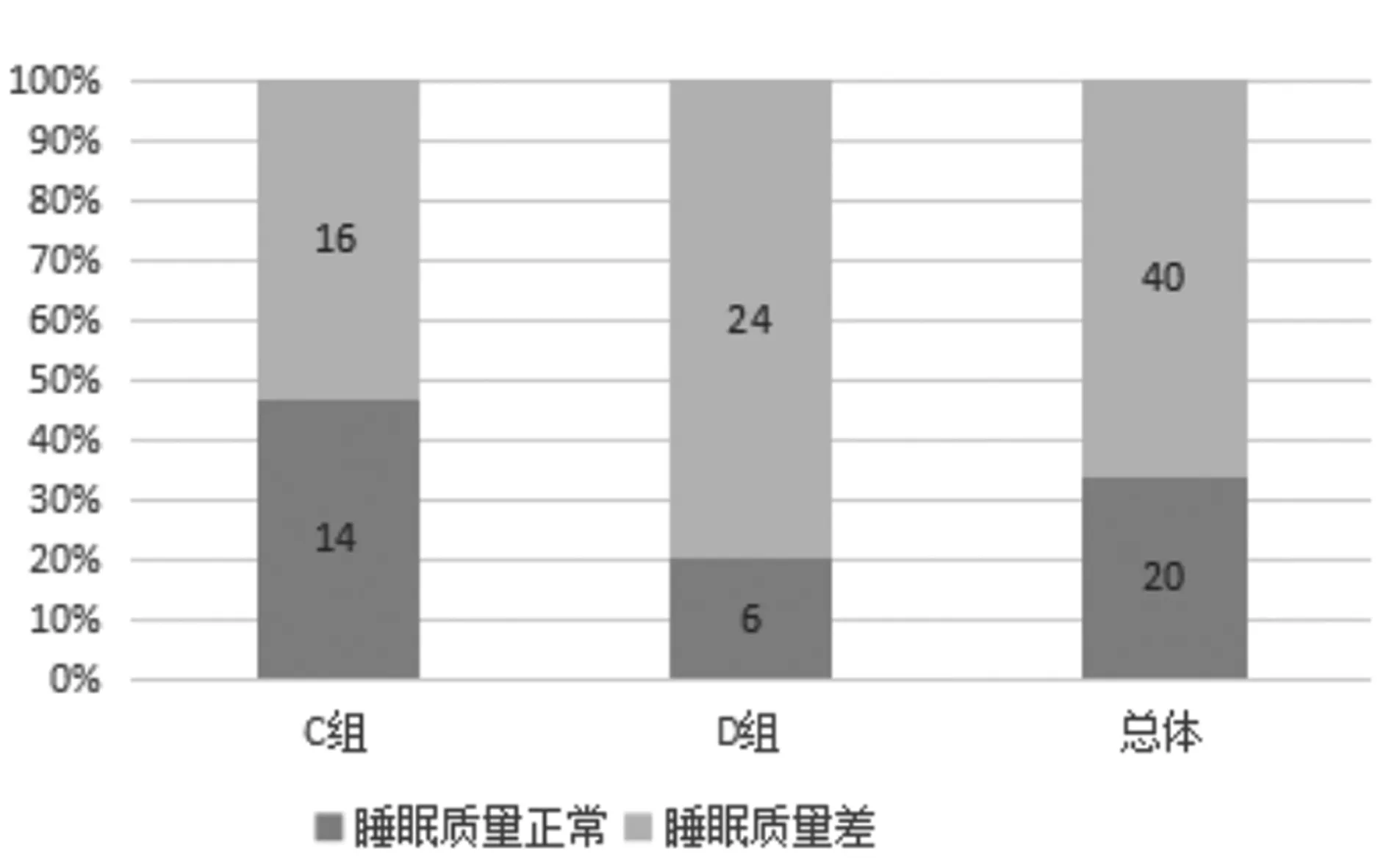
图1 两组患者睡眠质量下降发生率的比较
表2两组患者睡眠质量比较
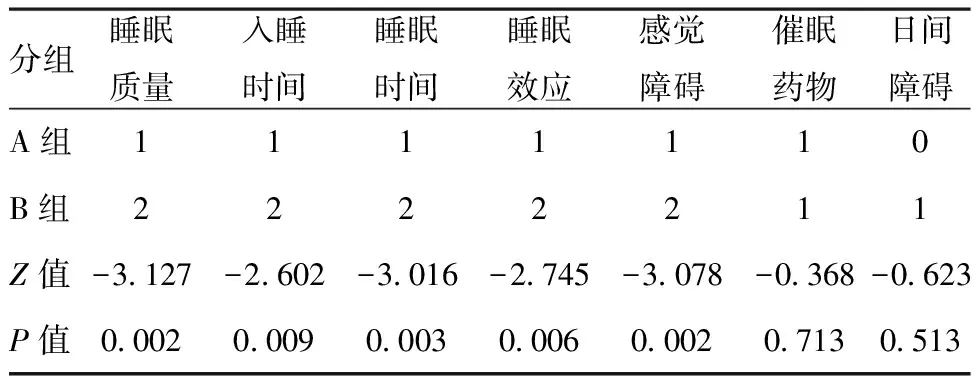
分组睡眠质量入睡时间睡眠时间睡眠效应感觉障碍催眠药物日间障碍A组1111110B组2222211Z值-3.127-2.602-3.016-2.745-3.078-0.368-0.623P值0.0020.0090.0030.0060.0020.7130.513
3 讨论
慢性阻塞性肺疾病(Chronic obstructive pulmonary disease,COPD)是由有毒颗粒或气体导致气道和(或)肺泡异常的常见病、多发病,其主要特征为持续性呼吸道症状和气流受限。COPD是呼吸系统常见病、多发病,我国每年约有100万人死于COPD,居中国疾病负担的第2位[4]。新版全球倡议指南中强调了其肺外效应是影响患者住院和死亡的独立危险因素,如心血管疾病、代谢综合征、骨质疏松、抑郁、睡眠障碍等,并指出作为COPD全身不良效应表现之一的睡眠障碍,可以发生在气流受限进展的各个时期[5],但因其症状的隐蔽性未能如其他并发症一样引起人们足够重视,而目前关于睡眠的研究多侧重于睡眠呼吸暂停低通气综合征或是重叠综合征,关于单纯COPD患者睡眠质量尚未被广泛的研究。睡眠是人类维持正常神经精神状态、认知能力和生产力所必不可少的生理过程,临床上多采用PSQI对COPD患者的睡眠质量进行综合评估,该量表简单易用,具有极高的信度、效度,另外刘贤臣等对PSQI的研究结果显示,当临界点为7分时,其敏感度和特异度均高于其他临界点,可提供科学的参考依据,适合国内患者的睡眠质量评估[6]。好的睡眠质量本身可能对COPD患者有益,睡眠质量差则是糖耐量异常、高血压、心血管疾病、导致COPD气流阻塞恶化的高危因素,增加疾病的死亡率。Omachi团队证明睡眠质量差是COPD不良预后的预测因子,包括死亡和急性发作,但肯特等指出,睡眠下降与COPD不良预后因果关系是不明确的,其预后较差可能是由于恶化的生理或者不匹配的医疗条件有关[7],改善睡眠的治疗是否能改善COPD预后仍有待确定。
本研究与国内外相关研究结果具有一致性,入选的COPD患者半数以上存在睡眠质量下降。睡眠质量差可能反映了COPD的某些潜在的病理生理反应,包括加重的气道慢性炎性反应、气流受限等,使其急性加重甚至死亡,同样,COPD亦可以扰乱睡眠结构。在一篇COPD合并睡眠障碍的发生率达53%的文献[7]中指出,睡眠质量差会缩短COPD患者2次急性发作之间的缓解时间、增加急性发作率,加速患者的病情进展,加重患者的合并症及服用更多的药物,增加患者致残率、病死率。另有研究发现约有34%~76%的COPD患者出现夜间频繁觉醒,50%和70%的患者报告在入睡困难或睡眠维持困难,70.6%有睡眠障碍,67.7%通常的睡眠醒来感到疲惫后,考虑与其慢性缺氧、高碳酸血症、氧化应激使自主神经系统失衡与交感神经活性升高有关[8]。
因我国国情导致COPD的早期诊断率低,在临床确诊的COPD患者中,我国GOLD分级高风险的两组患者占总人数的81%[9],远高于国外47%[10]的比例,相关研究也显示两组的COPD患者具有更多的临床症状、更高的急性加重的风险以及更差的生活质量。这部分患者进一步增加了家属的经济负担及护理劳动强度,更容易使其家属产生抑郁、焦虑等负面情绪,故本研究入选了临床比例相对较高的A组、B组。有研究者表明[11],吸入糖皮质激素、CAT评分、改良医学研究理事会(mMRC)呼吸困难评分与睡眠质量下降呈正相关,其中CAT评分是影响这些患者睡眠质量的独立因素。B组较A组拥有更高的CAT评分、mMRC评分,另外A组和B组患者在急性期大多需要接受糖皮质激素治疗,且激素使用量与病情严重性相关,病情越严重,激素使用量亦越多,故笔者认为B组较A组睡眠质量下降的发生率更高、睡眠质量更差,这正与本研究结果相符,且B组在PSQI多个维度如睡眠质量、睡眠时间、入睡时间、睡眠效应、睡眠障碍均高于A组。
COPD患者有半数以上存在睡眠质量下降问题,本研究得出B组的睡眠质量较A组更差,旨在提高各级医师对COPD夜间睡眠情况的认识,为其临床定期监测和长期管理提供参考。因本研究仅对纳入的两组患者睡眠质量进行主观描述,未采用多导睡眠(PSG)进行客观的描记,无法确定COPD患者睡眠质量下降具体表现及其是否随病情进展而呈现上升趋势,有待更大样本量的前瞻性研究的支持。

