淫羊藿次苷Ⅱ通过下调ERK1/2-NF-κB信号通路抗野百合碱所致大鼠肺动脉重构
李叶丽,吴红丹,付 舒,吴雨婷,岳 云,杨丹莉
(遵义医学院 基础药理教育部重点实验室暨特色民族药教育部国际合作联合实验室,贵州 遵义 563099)
肺动脉重构是肺动脉内皮细胞、中膜平滑肌细胞及外膜成纤维细胞的增殖与凋亡失衡所致,主要表现为肺动脉壁内皮细胞减少、中膜血管平滑肌细胞增殖、外膜胶原和弹性蛋白等细胞外基质异常沉积,其中肺动脉平滑肌细胞的异常分化、增殖和迁移在肺动脉重构中起重要作用[1-2]。细胞外信号调节激酶1/2(extracellular signal-regulated kinase 1/2,ERK1/2)是丝裂原活化蛋白激酶家族中的一个重要亚族,在调节细胞分化及增殖中起重要作用[3]。已有研究发现,ERK1/2的活化可引起肺动脉平滑肌细胞的增殖,导致肺动脉重构和右心重构的发生[4]。活化的ERK1/2通过级联反应作用于核因子-κB(nuclear factor kappa B,NF-κB),并激活NF-κB使其磷酸化,进而激活抑制性核因子κB激酶(inhibitor of nuclear factor kappa B kinase,IKK),最终参与多种炎症反应的发生。研究表明,NF-κB信号通路可通过促进炎症反应的发生,引起肺血管收缩及血栓形成,诱发肺动脉重构,最终导致肺动脉高压的发生[5-8]。因此,通过抑制ERK1/2-NF-κB信号通路,减轻炎症反应是抑制肺动脉重构的关键。
淫羊藿次苷Ⅱ(Icariside Ⅱ,ICSⅡ)是小檗科植物淫羊藿的主要活性成分之一,具有抗炎、抗氧化、抗癌等作用[9-11]。已有研究表明,ICS Ⅱ可抑制黑色素瘤细胞的增殖[10],也可通过抑制炎症反应逆转β淀粉样蛋白引起的认知功能障碍[11]。故本课题组推测ICSⅡ可能通过抑制肺动脉平滑肌细胞的增殖、减轻炎症反应,进而产生抗肺动脉重构的作用。因此,本研究以野百合碱(monocrotaline,MCT)诱导的肺动脉重构大鼠为研究对象,观察ICSⅡ对肺动脉重构的作用,并初步探讨其机制。
1 材料与方法
1.1 实验动物 雄性SD大鼠,体重200~220 g,清洁级,购自第三军医大学实验动物中心,许可证号:SCXK-(军)2017-0011。
1.2 主要仪器设备 BX43+DP2b光学显微镜(奥林巴斯);Leica RM2245轮转式切片机(Leica公司);TKY-TKA摊片烤片机(湖北泰康);GZX-9070MBE电恒温热鼓风干燥机(上海博讯实业有限公司医疗设备厂);Elix-15 MiNi QA 纯水处理器(Millipo Trading 有限公司)。
1.3 主要试剂 淫羊藿次苷Ⅱ(≥98%)购自南京泽朗医药有限公司;野百合碱购自Sigma公司;DAB显色试剂盒(ZLI-9018)购自北京中杉金桥生物技术有限公司;免疫组化染色试剂盒(SP-0023)购自北京博奥森生物技术有限公司;兔抗p-NF-κB多克隆抗体(D155004)购自生工生物工程(上海)有限公司;兔抗PCNA多克隆抗体(D120014)购自生工生物工程(上海)有限公司;兔抗p-ERK1/2抗体(4370S)购自美国Cell Signaling Technology公司。
1.4 实验方法
1.4.1 实验动物分组与造模 36只SD大鼠随机分为对照组(Control)、ICS II单纯给药组(Control + ICSⅡ-H,16 mg/kg)、模型组(Model)、ICS II 低中高剂量组(ICS II-L、ICS II-M、ICS II-H,4、8、16 mg/kg),每组6只。Control和Control + ICSⅡ-H组经颈背部一次性皮下注射生理盐水5 mL/kg,其余4组注射MCT 50 mg/kg诱导肺动脉重构模型。ICSⅡ各给药组于造模后当天开始给药至第28天结束(ig,qd)。对照组和模型组给予等量溶媒(ig,qd)。
1.4.2 H&E染色 取远离肺门处5 mm左右的肺组织,于4%甲醛溶液中固定48 h后,脱水、包埋、切片、进行H&E染色,光镜下观察肺小动脉形态学变化并拍照记录。采用Image-Pro Plus 6.0 图像分析软件测量肺小动脉中膜厚度,计算肺小动脉中膜相对厚度:中膜相对厚度/% =(2×中膜厚度)/外径×100。每组分别取6只动物的石蜡包埋组织,每个组织进行连续切片,每隔10片取一片,每只动物共取5张切片进行H&E染色,分别测量每张切片中的5个肺小动脉,取其平均值。将对照组的中膜相对厚度设定为100,计算各组中膜相对厚度的相对值。
1.4.3 免疫组织化学法检测肺小动脉PCNA、p-ERK1/2、p-NF-κB蛋白的表达 石蜡切片脱蜡,0.3% Triton X-100于37 ℃孵育15 min,PBS浸洗5 min × 3次;3% H2O2避光37 ℃孵育15 min,PBS浸洗5 min × 3次;抗原修复后滴加山羊血清于37 ℃孵育30 min;分别滴加一抗PCNA(1∶50)、p-ERK1/2(1∶50)、p-NF-κB(1∶50)于切片上并置于湿盒中4 ℃过夜;37 ℃复温30 min,PBS浸洗5 min × 3次;滴加二抗,于37℃孵育30 min,PBS浸洗5 min × 3次;DAB显色,镜下控制显色时间,自来水冲洗10 min;苏木素复染数秒,盐酸乙醇分化,自来水冲洗5 min;脱水、封片。每组随机选取5只动物的石蜡包埋组织,每个组织进行连续切片,每隔10片取1片,每只动物共取5张切片进行免疫组织化学法染色,每张切片中分别拍取5个400倍视野下的肺小动脉,用Image-Pro Plus 6.0图像分析软件分别统计阳性细胞数和总细胞数,求出阳性细胞百分比,即阳性细胞数/细胞总数×100%,取其平均值。将对照组的阳性细胞百分比设定为100,计算各组阳性细胞百分比的相对值。

2 结果
2.1 ICSⅡ对大鼠肺小动脉形态学的影响 H&E染色结果显示,Control组和Control + ICSⅡ-H组肺小动脉中膜较薄、官腔较大。与Control组比较,Model组大鼠肺小动脉中膜及管壁明显增厚、管腔变窄,血管周围及肺间质炎症明显;与Model组比较,ICSⅡ-M、ICSⅡ-H组肺小动脉中膜增厚及肺部炎症情况均有所改善(见图1)。
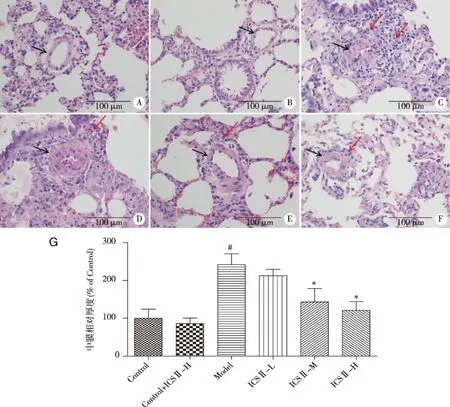
A:Control;B:Control+ICSⅡ-H;C:Model;D:ICSⅡ-L;E:ICSⅡ-M;F:ICSⅡ-H;G:中膜相对厚度。黑色箭头所指为肺小动脉,红色箭头所指为炎症细胞。#:vs Control,P<0.05;*:vs Model, P<0.05。
2.2 ICSⅡ对肺小动脉PCNA蛋白表达的影响 PCNA表达于胞核,棕黄和(或)褐色为阳性表达。Control组和Control + ICSⅡ-H组肺小动脉平滑肌上PCNA的表达较少。与Control组比较,Model组肺小动脉平滑肌上PCNA表达明显增多(P<0.05);与Model组比较,ICSⅡ-M、ICSⅡ-H组PCNA表达减少(P<0.05,见图2)。

A:Control;B:Control+ICSⅡ-H;C:Model;D:ICSⅡ-L;E:ICSⅡ-M;F:ICSⅡ-H;G:PCNA阳性细胞百分比。#:vs Control,P<0.05;*:vs Model,P<0.05。
2.3 ICSⅡ对肺小动脉p-ERK1/2蛋白表达的影响 p-ERK1/2表达于胞核,棕褐色为阳性表达。Control组和Control + ICSⅡ-H组肺小动脉平滑肌上p-ERK1/2几乎不表达。与Control组比较,Model组肺小动脉平滑肌上p-ERK1/2表达明显增多(P<0.05);与Model组比较,ICSⅡ-M、ICSⅡ-H组p-ERK1/2表达减少(P<0.05,见图3)。
2.4 ICSⅡ对肺小动脉p-NF-κB(p65)蛋白表达的影响 p-NF-κB(p65)表达于胞核,其阳性表达为棕褐色。Control组和Control + ICSⅡ-H组肺小动脉平滑肌上p-NF-κB(p65)的表达较少。与Control组比较,Model组肺小动脉平滑肌上p-NF-κB(p65)表达明显增多(P<0.05);与Model组比较,ICSⅡ-M、ICSⅡ-H组p-NF-κB表达减少(P<0.05,见图4)。

A:Control;B:Control+ICSⅡ-H;C:Model;D:ICSⅡ-L;E:ICSⅡ-M;F:ICSⅡ-H;G:p-ERK1/2阳性细胞百分比。#:vs Control,P<0.05;*:vs Model,P<0.05。
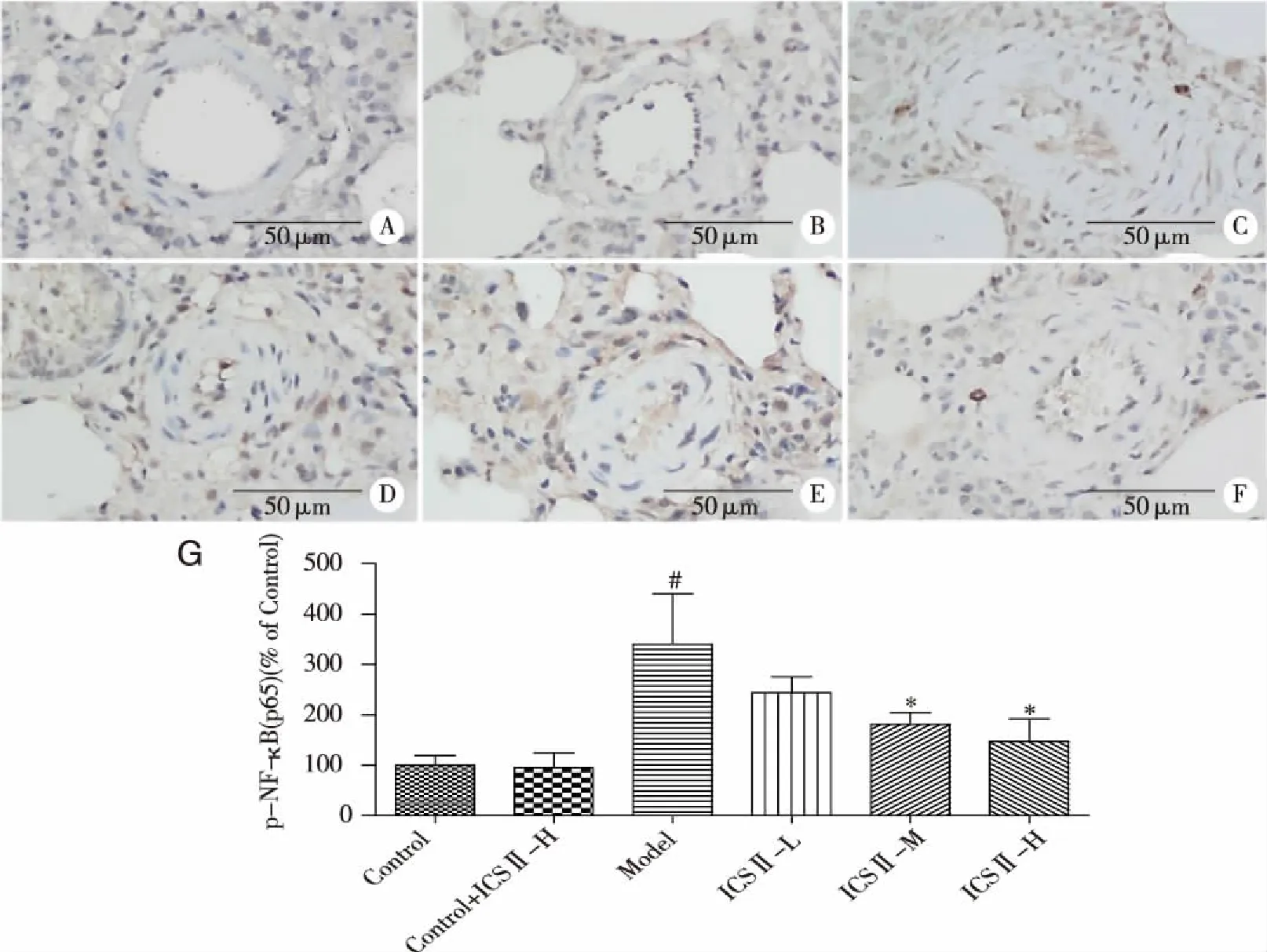
A:Control;B:Control+ICSⅡ-H;C:Model;D:ICSⅡ-L;E:ICSⅡ-M;F:ICSⅡ-H;G:p-NF-κB(p65)阳性细胞百分比。#:vs Control,P<0.05;*:vs Model,P<0.05。
3 讨论
野百合碱(MCT)经肝代谢后选择性作用于肺血管床,损伤肺动脉内皮细胞,使血管屏障功能受损,血液中弹性蛋白酶、凝血酶等外渗,触发单核细胞等炎症细胞在受累动脉周围浸润,继发肺动脉平滑肌细胞增殖,从而诱发肺动脉重构,并伴有明显的炎症反应[12-13]。本研究结果显示,与Control组相比,Control + ICSⅡ-H组各项指标均无明显变化,提示给予最大剂量的ICSⅡ对正常大鼠无明显影响;而Model组大鼠肺小动脉中膜明显肥厚、管腔狭窄,血管周围及肺间质炎症细胞浸润明显,提示造模成功,与文献报道一致[14]。与Model组相比,ICSⅡ-M、ICSⅡ-H组大鼠肺小动脉中膜变薄、肺部炎症情况减轻,提示ICSⅡ具有抗肺动脉重构的作用。
肺动脉平滑肌细胞的异常增殖是肺动脉腔变窄、肺血管阻力增加、诱发或加重肺动脉重构的重要因素[15]。增殖细胞核抗原(proliferating cell nuclear antigen,PCNA)是反映细胞增殖的重要指标,在细胞增殖的启动上起重要作用[14]。已有研究表明,在MCT诱导的肺动脉重构模型中,PCNA蛋白的表达明显升高[14-15]。本研究结果显示,与Control组相比,Model组大鼠肺小动脉中膜PCNA蛋白的表达明显上调,而中膜主要由血管平滑肌细胞组成[16],说明在MCT诱导的肺动脉重构中肺动脉平滑肌细胞发生了明显的增殖。与Model组相比,ICSⅡ-M、ICSⅡ-H组大鼠肺小动脉中膜PCNA蛋白的表达下调,提示ICSⅡ可能通过抑制肺动脉平滑肌细胞的增殖发挥抗肺动脉重构的作用。
已有研究发现,ERK1/2信号通路的激活可引起肺动脉平滑肌细胞的增殖,加重肺动脉高压的发生与发展[4]。活化的ERK1/2可通过级联反应调控其下游基因NF-кB、AP-1等的表达[17]。NF-κB是真核细胞转录因子Rel家族成员之一,被认为是调控炎症的关键因子。静息状态下,NF-κB与其抑制蛋白IκB以三聚体的形式结合存在于胞浆,当受到多种因素刺激时,IκB在IKK的调节下被降解,NF-кB被激活并移位到核内,促进炎症因子的释放及肺动脉平滑肌细胞的增殖,引发肺动脉重构[7]。提示抑制ERK1/2-NF-κB信号通路的激活可抑制肺动脉重构。本研究结果显示,与Control组相比,Model组大鼠肺小动脉中膜p-ERK1/2、p-NF-κB蛋白的表达均明显上调,说明在MCT诱导的肺动脉重构中ERK1/2-NF-κB信号通路被激活。与Model组相比,ICSⅡ-M、ICSⅡ-H组大鼠肺小动脉中膜p-ERK1/2、p-NF-κB蛋白的表达均下调,提示ICSⅡ可能通过抑制ERK1/2-NF-κB信号通路的激活发挥抗肺动脉重构的作用。

