胃双重造影诊断胃神经鞘瘤1例
杨德斌,卢国丰,陆 敏,徐 荣,王迎春
1. 上海市嘉定区中心医院超声影像科,上海201800;2. 上海市嘉定区中心医院病理科,上海201800
1 临床资料
患者,女性,55岁,因胸闷气短1个月入院,无嗳气、反酸等其他消化道症状。常规超声检查:胰尾与胃交界处见低回声团块,大小约55 mm×34 mm×36 mm,内部回声尚均匀,边界清。彩色超声:内见少许血流信号(图1A、1B);饮水后观察,肿块来源于胃壁,与胰腺界限清楚,肿块随着胃充盈后向右中腹移动至胰颈处(图1C、1D)。超声造影:注入造影剂声诺维9 s后,肿块包膜首先出现造影剂灌注,呈环状高增强,并向内部均匀性填充,内部呈等增强(图1E、1F)。超声提示胃壁实性占位(可能是胃神经鞘瘤或胃间质瘤)。术后病理学检查结果:(胃体)结合组织学形态和免疫组织化学结果符合神经鞘瘤(图2),肿块大小60 mm×35 mm×32mm。免疫组织化学检测结果:Dog-1(-)、CD117(-)、CD34部分(+)、Vimentin(+)、SMA部分(+)、S-100(+)、NSE(-)、GFAP(+)、Ki-67<5%(+)(图3)。
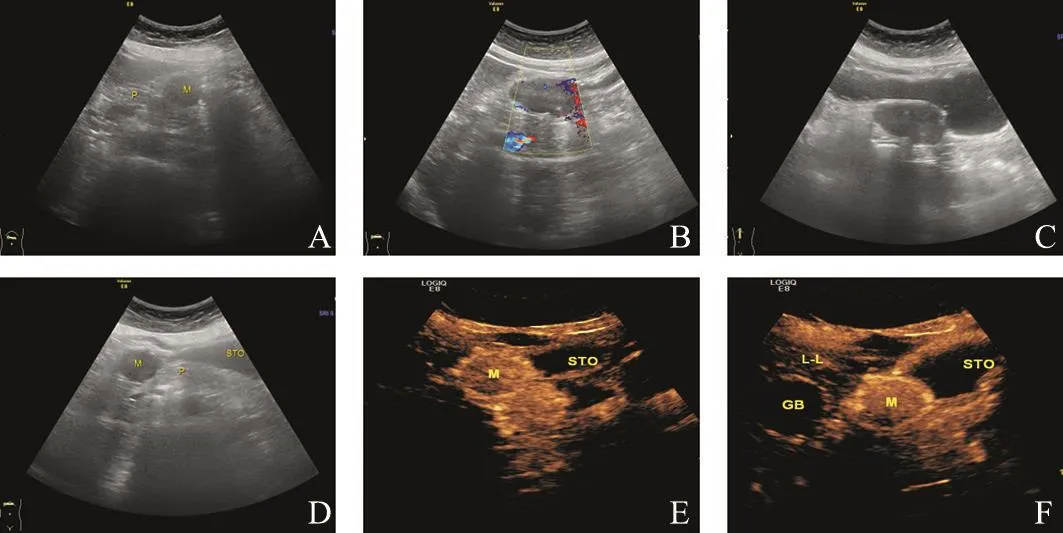
图 1 患者超声诊断图像
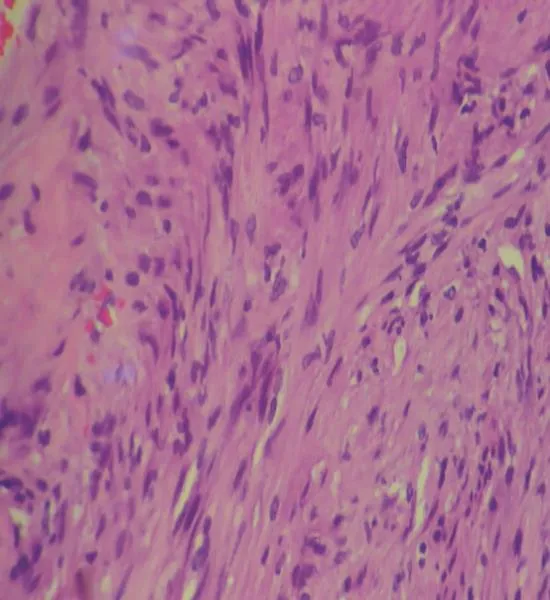
图 2 神经鞘瘤的病理诊断(H-E染色,×400)
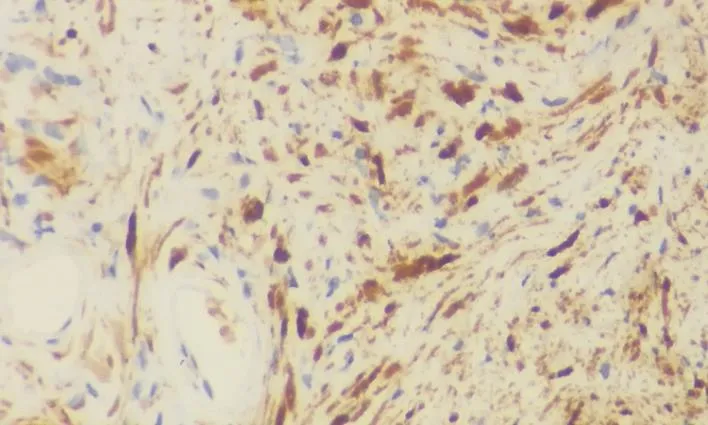
图 3 免疫组织化学结果显示S-100弥漫强阳性表达(S-P法,×400)
2 讨 论
神经鞘瘤是良性神经源性肿瘤,起源于雪旺细胞,可发生于任何有雪旺细胞膜的神经组织,好发于头部、颈部和四肢,胃肠道(主要发生于胃)少见。胃神经鞘瘤主要涉及黏膜下层和肌层,仅占所有胃肿瘤的0.2%,可发生于胃的任何部位,以胃体多见,其次是胃窦、胃底。一般无临床症状,大多数在剖腹手术时或影像学检查中偶然发现;肿瘤发展到一定程度时可出现梗阻症状,主要表现为上腹部不适、腹痛、反酸及嗳气等。既往对胃神经鞘瘤的诊断主要依靠胃镜及CT。胃镜主要表现为黏膜下隆起样病变,由于胃神经鞘瘤很少引起黏膜异常,难以定性诊断[1]。胃神经鞘瘤的CT检查多表现为腔外或腔内外生长,强化均匀,但对CT增强特点仍存在争议[2]。近年来,随着胃肠道超声的广泛开展,超声在胃隆起性病变中的诊断水平得到很大提高。
本例患者病变发生于胃小弯,紧贴胰尾部,最早曾误认为胰腺肿瘤。胃充盈后检查,动态观察到肿块的蠕动,清晰显示肿块与胃壁和周围组织的关系,准确定位肿块来自胃而非胰腺。然而,胃神经鞘瘤与其他胃间质肿瘤在声像图上均表现为低回声,仅依靠常规超声常难以鉴别。超声造影能实时观察肿块的微血流灌注方式,根据增强特征有助于定性诊断。文献报道,>50 mm的胃间质瘤常有溃疡、出血坏死,表现为不均匀性增强,而胃神经鞘瘤多表现为均匀性增强[3]。本例患者行胃双重超声造影检查(即在胃充盈检查的基础上对病变进行超声造影检查),不仅能予以准确定位,还为定性诊断提供了重要参考。超声造影表现为周边环状高增强而内部均匀性等增强,故首先考虑神经鞘瘤的可能。
由于胃神经鞘瘤罕见,目前缺乏大样本量的影像学数据[1],且形态上与胃肠道间质瘤相似,其准确诊断还需依靠病理学检查,根据不同肿瘤的独特免疫组织化学结果确诊。S-100染色阳性是鉴别胃神经鞘瘤与其他间质肿瘤的重要依据[4],本例患者胃S-100(+)可支持神经鞘瘤诊断。

