N-乙酰半胱氨酸对乙酸刺激仔猪肠黏膜生长及肠道屏障功能的影响
周 颖, 宋 转, 张俊梅, 刘文凯, 余 魁,吴梦郡, 赵 迪,2, 王 蕾 ,2*, 易 丹,2, 侯永清,2,
(1.武汉轻工大学动物营养与饲料科学湖北省重点实验室,湖北武汉430023;2.动物营养与饲料安全湖北省协同创新中心,湖北武汉430023)
N-乙酰半胱氨酸(NAC)是左旋半胱氨酸以及谷胱甘肽合成的前体物质,具备供给巯基的能力,能够消除活性自由基以及减少细胞的凋亡、增进生长,另外,还具有促进组织抗药、缓解毒物损伤等多种药理效应(Hou等,2015),临床上应用于呼吸、神经系统的病症成效显著,然而NAC对乙酸刺激仔猪肠黏膜屏障功能及肠黏膜生长的影响鲜见报道。
肠道黏膜屏障功能的损害主要是由炎症引发肠道黏膜损伤导致的,研究表明免疫失调以及肠道炎性因子失衡,可破坏黏膜的渗透性、黏附性以及完整性(Rendon等,2013),从而损伤肠道屏障
功能,进一步引发肠道炎性因子释放失调、内部菌群转移,最终诱发相关机体器官衰竭(Bahloul等,2017)。本研究采用乙酸刺激仔猪肠黏膜是基于化学因素导致的肠道黏膜组织出现相应的毁坏机制,病症包含有肠黏膜弥漫性充血水肿,淋巴组织溃疡,甚至出现部分黏膜缺失,造模简单且稳定(李亚欢等,2017),在此基础上,进而研究NAC对乙酸刺激仔猪小肠肠黏膜屏障功能及肠黏膜生长的影响。
1 材料和方法
1.1 试验材料 NAC:市售医药级产品,纯度不低于99.0%。乙酸(ACA):国产分析纯,纯度≥98%。1.2 基础日粮 试验采用玉米-豆粕型饲粮作为基础饲粮,参照NRC(2012)营养标准配制,满足仔猪的营养需要量。基础饲粮组成及营养水平见表1。
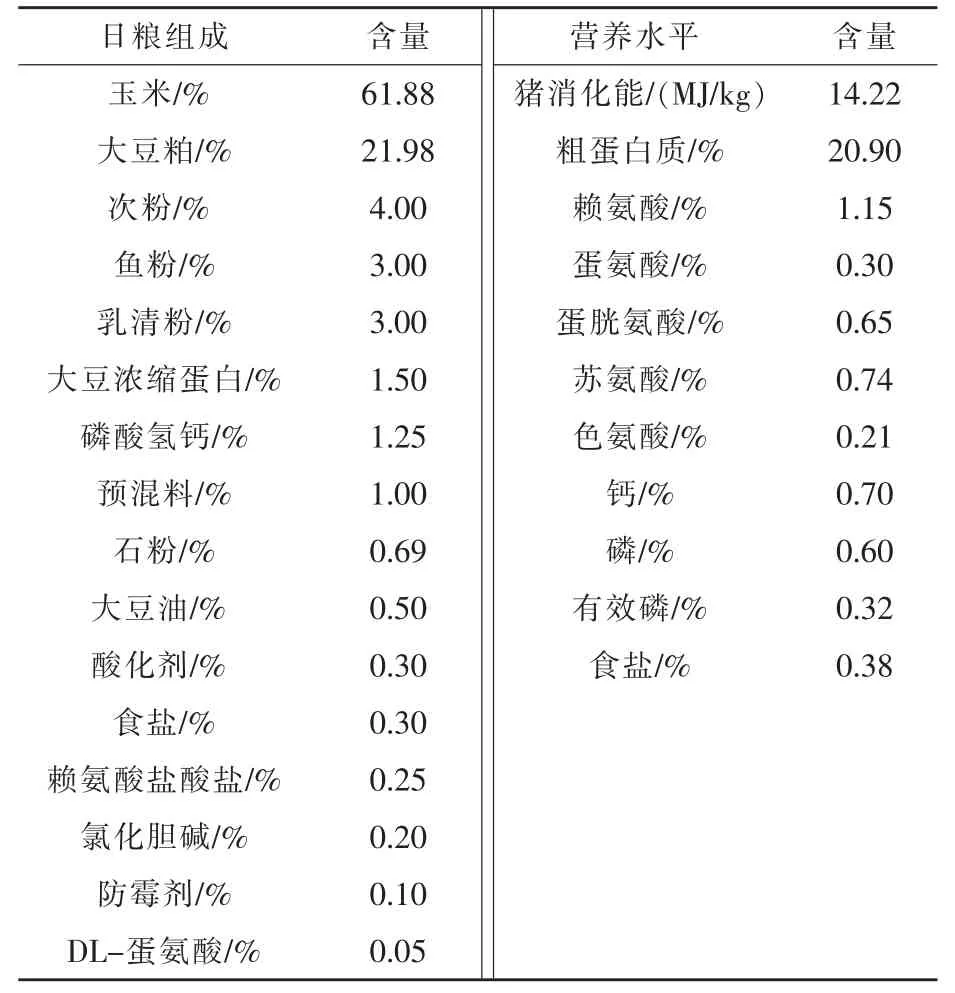
表1 基础饲粮组成与营养水平(风干基础)
1.3 试验设计 选用18头(28±2)日龄、平均体重(5.79±1.17)kg“杜×长×大”三元杂交健康仔猪,随机分为对照组、ACA组和NAC组。每组6个重复,每个重复1头猪。仔猪预饲时间为7 d,其中前两组饲喂基础饲粮,第三组在饲喂基础饲粮的基础上添加 0.05%的NAC。于正式试验第15天,对ACA组和NAC组仔猪直肠灌注10 mL浓度为10%乙酸溶液,对照组灌注相应剂量的灭菌生理盐水。第21天按仔猪每千克体重0.1 g由口腔灌入D-木糖溶液,1 h后从前腔静脉采集血样。然后采用戊巴比妥钠进行肌肉注射,其中肌注浓度按仔猪体重每千克50 mg,待深度麻醉后屠宰。取小肠黏膜样品,存于-80℃待测。
1.4 饲养管理与屠宰 试验期间猪舍温度保持22~25℃,并保证舍内清洁。试验仔猪单体饲养,自由采食。于第21天屠宰收集样品,采集距胃贲门大约5 cm处十二指肠,采集回肠、空肠中段样品,所取肠段均为3 cm和10 cm的两段相邻肠段。3 cm肠段制作切片,10 cm肠段刮取肠黏膜,研磨,分装,冻存于-80℃冰箱,待测。
1.5 指标测定
1.5.1 血浆D-木糖、EGF含量及血浆、小肠黏膜DAO活性的测定 血浆样本中D-木糖水平检测,采用间苯三酚比色法(张伟等,2011)。
取用肠黏膜0.5 g,冰浴匀浆,以3000 r/min离心15 min。采集上清液,使用放射免疫分析法检测样品中表皮生长因子(EGF)含量(方法灵敏程度:0.1 μg/mL,误差:< 5%)。
血浆以及肠黏膜样品中DAO活性的检测参考张伟等(2011)的方法。
1.5.2 小肠黏膜形态结构的测定 分别取十二指肠、空肠、回肠各约3 cm长,制作组织切片(冷炜博等,2014),光镜下测量绒毛高度、隐窝深度,以及绒毛表面积,根据结果计算绒毛高度/隐窝深度。
1.5.3 小肠黏膜 DNA含量、RNA/DNA、TP/DNA比值的测定 参考Sambrook(2006)测定小肠黏膜中DNA和RNA浓度,计算TP/DNA和RNA/DNA比值。
1.5.4 小肠黏膜EGF、EGFR及AR mRNA水平的测定 采用RT-PCR检测肠黏膜EGF、EGFR和AR mRNA表达量,其中引物序列表2。
RNA样品处理:使用Trizol法提取Total-RNA。在260 nm吸光度条件下检测RNA纯度以及浓度 (使用NanoDropRND-2000 UV-VIS核酸蛋白检测仪),然后选择吸光度260 nm与280 nm比值大于1.8的总RNA试验。
逆转录反应:将 4 μL 5×PrimeScriptRbuffer、1 μL PrimeScriptRRT enzyme mix、1.0 μL RT primer mix、10 μL DNA eraser-treated RNA 和 4 μL RNase free water混合制成20 μL反应体系,在37℃反应15 min,85℃反应5 s,cDNA于-80℃保存。
PCR 反应:20 μL 反应体系中包含 10.0 μL SYBRRPremix Ex TaqTM(2×)、0.4 μL ROX reference dye II (10×)、2.0 μL cDNA、6.8 μL RNase free water、0.4 μL forward primer (10 μM)、0.4 μL reverse primer (10 μM)。 反应条件为:95 ℃, 30 s;95℃,5 s和60℃,34 s,40个循环。反应结束后做产物的熔解曲线分析,检验PCR产物的特异性。以GAPDH作为内参,根据被测基因与内参基因的 Ct差值,使用 2-△△Ct法(Fu 等,2010)计算结果。1.6 数据处理 试验数据经由Excel 2007整理后使用SPSS 23.0作统计分析,采用单因素方差分析和Duncan’s多重比较,处理结果中P<0.05则判定为存在显著性差异,结果用“平均值±标准差”表示。

表2 RT-PCR的引物序列
2 结果
2.1NAC对ACA刺激仔猪血浆D-木糖、EGF含量及血浆、肠黏膜DAO活性的影响 由表3可知,与对照组相比,ACA组血浆中EGF含量降低了8.13%,血浆DAO活性提高了94.80%(P<0.05),十二指肠DAO活性提高17.95%(P<0.05);与ACA组相比,NAC组血浆D-木糖和EGF含量及十二指肠DAO活性提高了 17.29%、26.20%、21.35%(P<0.05);血浆 DAO 活性降低了13.35%(P <0.05)。
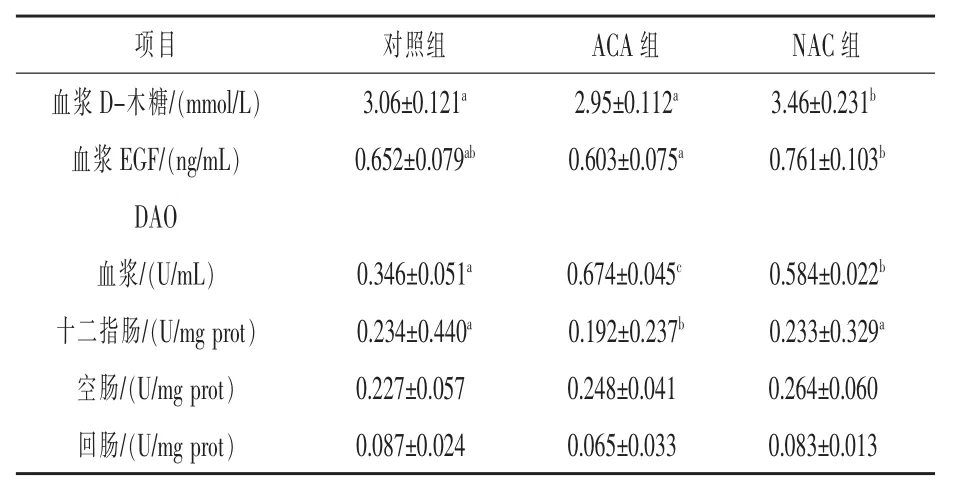
表3 仔猪血浆D-木糖含量及血浆、肠黏膜DAO活性
2.2 NAC对ACA刺激仔猪小肠黏膜形态的影响 由表4可知,相较于对照组仔猪,ACA组仔猪空肠绒毛高、十二指肠以及回肠绒毛高与隐窝深比值降低了14.03%、26.72%、14.97%,同时其十二指肠、空肠的绒毛表面积也下降了12.40%、37.11%(P<0.05),十二指肠和回肠的隐窝深度分别提高了14.31%、8.14%(P<0.05);与ACA组相比,NAC组空肠绒毛高、十二指肠和回肠的绒毛高度/隐窝深度比值以及十二指肠和空肠绒毛表面积分别提升了 20.62%、29.41%、13.84%、41.23%、61%(P<0.05),十二指肠和回肠的隐窝深度分别降低了7.79%、19.99%(P<0.05)。

表4 仔猪小肠黏膜形态结构
乙酸灌肠对仔猪肠道形成刺激后,仔猪出现少动、嗜睡、无食欲、稀便、血便等病症,经由光镜观察组织染色切片得出,对照组仔猪肠壁纹理清晰,上皮构成完全,绒毛平整且体例规整,有正常的上皮细胞结构,未出现膜充血和炎性细胞浸润,且小肠绒毛未出现萎缩以及坏死等现象。ACA组小肠绒毛表现出较多残缺,小肠肠壁变薄,腺体变少,上皮细胞充血水肿,杯状细胞缩减,炎性细胞浸润,表现出有差异的灶性糜烂,甚至出现部分组织脱落。此结果和高永利(2017)以及Ghalwash等(2017)的研究结果类似,NAC组仔猪肠黏膜形态构造相较于ACA组有明显提升。
2.3 NAC对ACA刺激仔猪肠黏膜细胞生长的影响 由表5可知,与对照组相比,ACA组回肠RNA/DNA比值和TP/DNA比值分别降低了38.91%和 26.35%(P<0.05);与 ACA组相比,NAC组十二指肠和空肠DNA含量、回肠RNA/DNA比值及十二指肠、空肠和回肠TP/DNA比值分别提高了 56.36%、13.51%、63.69%、17.29%、32.97%、34.03%(P < 0.05)。

表5 仔猪小肠DNA含量、RNA/DNA、TP/DNA比值
2.4 NAC对ACA刺激仔猪小肠黏膜EGF、EGFR及AR mRNA水平的影响 由表6可知,与对照组相比,ACA对小肠黏膜EGF、EGFR及AR mRNA水平没有显著影响;与ACA组相比,NAC组回肠EGF mRNA水平提高了90.17%(P<0.05)。
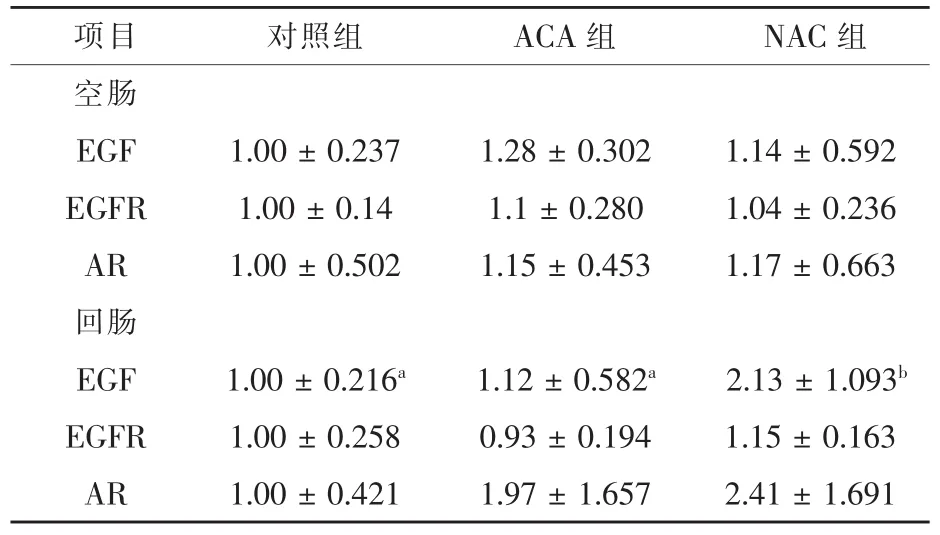
表6 仔猪小肠黏膜EGF、EGFR及AR mRNA水平
3 讨论
3.1 NAC对ACA刺激仔猪血浆D-木糖含量及血浆、肠黏膜DAO活性的影响 仔猪口腔灌服D-木糖后,经由小肠吸收,最后直接随尿液排出,过程中不被动物机体所利用,所以将D-木糖吸收量的测定作为肠道吸收能力常用的评定途径 (杨彩梅等,2005)。本试验中,饲粮中添加NAC可以提高血浆D-木糖含量,说明NAC可以提高小肠吸收功能,这与Hou等(2012)研究结果一致,日粮中添加NAC可以提高磷酸脂多糖(LPS)刺激仔猪D-木糖含量。
DAO存在于哺乳动物体内,其可参与肠道黏膜组织代谢,肠黏膜因各种原因受到损伤后导致胞内DAO大量进入血液。由此可见,血液中DAO含量能够反映肠黏膜结构完整性 (刘飞飞等,2015)。研究表明,肠道绒毛的损伤能够导致血液中DAO浓度上升,从而导致肠道组织活性下调,具体机理为肠道对自身应激损伤进行自我修复时DAO活性上升或下降(许文达等,2016)。本试验中,ACA组刺激提高了的血浆DAO活性,同时又降低了小肠中DAO活性,这表明乙酸刺激给仔猪肠黏膜造成了损伤。有报道指出,补充NAC可以缓解炎症性肠病所引起的肠黏膜病症如充血、水肿、溃疡等,同时也可以抑制肠道细胞的凋亡(Hou 等,2015)。 杨晨等(2017)研究证明 NAC 能够有效减轻黄疸病症大鼠肠道屏障功能的损伤。本试验中NAC缓解了乙酸刺激所致的血浆DAO活性上升以及小肠黏膜DAO活性降低,说明NAC对肠道黏膜的损伤起到了一定的缓解作用。研究表明,NAC可以缓解磷酸脂多糖刺激所致的血浆DAO活性升高以及小肠黏膜DAO活性的降低(Hou 等,2012)。
3.2 NAC对ACA刺激仔猪小肠黏膜形态的影响 仔猪的肠道系统处于快速生长发育阶段,肠道屏障功能的稳定依靠完整的肠黏膜细胞来维持(晏利琼等,2016)。小肠作为消化道内重要的一部分,除了正常屏障功能外,还能吸收养分以及输送养分至其他部位,所以肠道黏膜形态对其功能的体现尤为重要(王蕾等,2010)。仔猪肠道黏膜形态的评定主要根据其物理形态判定,判定主要指标有绒毛高度、隐窝深度、绒毛表面积、绒毛高度与隐窝深度之比,小肠黏膜的形态表现出小肠消化吸收能力的高低(黄其春等,2014)。其中绒毛高度与细胞数量呈显著相关,隐窝具有分泌功能,其深浅反映了肠上皮细胞生成率,绒毛高度与隐窝深度的比值常用来表示上皮细胞的更新代谢程度(汤海鸥等,2014),比值降低表明动物肠道黏膜受损,升高则表明黏膜细胞生长良好,功能改善。本试验研究结果显示乙酸刺激降低了小肠的绒毛高度、绒毛高度与隐窝深度的比值和绒毛表面积,说明乙酸刺激对小肠道黏膜造成了损伤,添加NAC后可有效缓解ACA刺激造成的这些负影响,表明NAC能够在一定程度上增加肠上皮细胞的代谢替换速率,加快细胞生长,强化细胞自我恢复功能,使乙酸刺激引发的肠黏膜形态损伤得到缓解。
3.3 NAC对ACA刺激仔猪肠黏膜细胞生长以及肠黏膜EGF、EGFR及AR mRNA水平的影响肠道黏膜蛋白质(TP)及其DNA对小肠细胞的生长和修复极其重要,单位组织中DNA含量的变化可以反映出细胞数量的多少(林谦等,2016),RNA与DNA的比值能够准确反映蛋白质合成水平;TP/DNA比值可用来衡量细胞大小和蛋白质沉积效率的高低 (Foley等,2016)。本试验结果表明,NAC补充能够使乙酸刺激仔猪小肠DNA含量、RNA/DNA比值及TP/DNA比值上升,表现出NAC补充能够缓解乙酸刺激所引发的生长抑制,其原因是由于过氧化物受到抑制而引发DNA断裂以及因化学因素诱发的细胞转变,令DNA甲基转移酶活性增强,从而修复受损DNA。蛋白质以及DNA含量上升说明肠细胞合成代谢加快(Groschwitz等,2009),于修善小肠形态结构至关重要,NAC补充或许是经由增进肠黏膜蛋白合成途径使得受损肠道得以修复。
表皮生长因子(EGF)是机体肠道受损后自我修复与再生的关键内源调控因素之一,主要通过增进细胞增殖从而加速损伤修复 (刘淑杰等,2016)。表皮细胞生长因子受体(EGFR)作为受体酪氨酸激酶,与其结合的配体还有TGF-α、Amphiregulin (AR)、Epiregulin、HB-EGF 等 (刘淑杰等,2014),与EGF等配体结合后经由细胞内信号转导通路表达,从而调控相关基因表达。回肠EGF以及EGFR的mRNA水平在饲粮补充NAC以后得到显著提升,其修复的机制或许是经由EGF及其受体在组织中呈正向表达,进一步激活酪氨酸激酶、蛋白G和磷酸脂酶C,进而使钙离子浓度变化,促进糖酵解过程,增加损伤的自我修复与增殖再生,从而避免其向内发展(刘淑杰等,2016)。与此同时,EGF能够抑制细菌在黏膜迁移(吴秀群等,2011),加快与其相关的内源性因素提升,加速上皮细胞和成纤维细胞转移,实现创伤的愈合(胡莹莹等,2013)。研究表明EGF直肠灌注应用到急性肠炎上成效显著 (苏凤哲等,2015)。EGF家族中AR通过与EGFR结合激活EGFR信号通路,减少上皮细胞坏死,从而保证肠黏膜形态结构齐整性(刘淑杰等,2016),最终达到NAC补充后对肠道损伤修复与保护的效果。
4 结论
饲粮中添加0.05%的NAC可以在一定程度上缓解ACA刺激导致的小肠黏膜损伤,促进肠黏膜生长,这可能与EGFR信号通路有关。

