基于甘蔗热带种(LA-purple)全基因组序列的SSR开发及特征分析
王恒波 肖乃衍 朱专为 刘翠翠 Intikhab ALAM 陈平华 卢运海
基于甘蔗热带种(LA-purple)全基因组序列的SSR开发及特征分析
王恒波 肖乃衍 朱专为 刘翠翠 Intikhab ALAM 陈平华 卢运海*
福建农林大学农业部福建甘蔗生物学与遗传育种重点实验室 / 作物遗传育种与综合利用教育部重点实验室 / 作物科学学院, 福建福州 350002
现代甘蔗栽培品种(2= 100~130)是由甘蔗热带种(2= 80)与割手密(2= 40~128)种间杂交而来, 形成异源多倍体、非整倍体作物, 使得甘蔗栽培品种中80%~90%的染色体来源于热带种。开发热带种基因组SSR分子标记, 有助于甘蔗遗传多样性分析、分子标记辅助选择、遗传图谱的构建等。本研究基于热带种LA-purple的全基因组测序数据的255 398个预测基因序列(累计总长为1 029 222 285 bp), 利用Perl程序与生物信息学软件结合, 发掘SSR位点, 获得了153 150个SSR位点, 平均每1.67个基因有1个SSR位点, 其中二、三核苷酸重复基序分别为39 556个和50 072个, 占总SSR位点数的58.5%。在二核苷酸重复基序中, TA/AT所占比例最高, 占41.4%, CG/GC所占比例最低, 占4.6%; 在三核苷酸碱基重复基序中, TGT/ACA所占比例最高, 为15.6%。在TA/AT重复类型中选取100个基序重复次数在60~90之间的SSR位点, 进行引物设计与合成, 在12个甘蔗属材料中进行PCR扩增分析, 从中筛选出52对具有多态性SSR引物, 其中有27对引物在研究的2个甘蔗栽培品种间表现为多态。这些基因组SSR标记的开发, 不仅可以用于甘蔗栽培品种DNA指纹图谱分析, 而且为甘蔗属不同种的遗传图谱构建、遗传多样性分析和重要性状的遗传机制解析奠定基础, 为甘蔗分子育种研究提供重要支撑。
甘蔗; 基因组; SSR; 标记开发; 多态性
甘蔗为禾本科(Poaceae)甘蔗属(L.)植物, 是一种多年生、可宿根栽培的C4作物, 具有生物量高、二氧化碳补偿点低等优点, 是世界上最重要的糖料作物之一, 是人类食糖的重要来源[1], 在我国农业经济中占有重要地位[2]。现代甘蔗栽培品种绝大多数都是由热带种(L., 2= 80, x = 10)和割手密(L., 2= 40~128, x = 8)种间杂交而来, 且与热带种进行了多次回交[3], 其染色体数目在2= 100~130之间, 其中80%~90%的染色体来自于热带种, 10%~20%来自于割手密, 而染色体的5%~17%为2个种间的染色体重组类型[4-5]。由于甘蔗的高度多倍体及非整倍体的复杂遗传背景, 使得甘蔗的遗传、育种及基因组测序等都面临巨大的困难和挑战[5-6]。
简单重复序列(simple sequence repeats, SSR), 也被称为微卫星(microsatellites)序列, 是指由1~6个核苷酸组成的不同类型基序多次重复而形成的相对较短、广泛分布于真核生物基因组上的DNA序 列[7-8]。它们在基因组上虽然是随机分布[9], 但更偏向于低重复、富含基因的区域[10]。每一个SSR序列在DNA复制时产生错误的比率较高, 因而可以在种内或种间产生大量的SSR序列长度的变异[11]。作为分子标记, SSR具有多态性高、重复性好、操作简便及共显性等优点, 因而被广泛应用于各种动、植物的品种指纹图谱鉴定、遗传图谱构建及目标性状分子标记筛选等领域[12]。
SSR标记在甘蔗属植物上也得到了较为广泛的应用[13-30], 已有数个关于在甘蔗上开发SSR标记的报道, 如Oliveira等[20]从甘蔗SUCEST (sugarcane EST database)数据库中找出2005个含有SSR的EST序列, 对其中的342个EST-SSRs进行了PCR分析, 发现有224个(65.5%)呈多态性; Singh等[27]从2个甘蔗栽培品种的4085个EST序列中鉴定出351个EST-SSRs, 对其中227个进行了PCR分析, 发现有134个呈多态性; Shamshad等[28]从NCBI数据库中获得10 000个EST序列(累计长4201kb), 从中鉴定出406个SSRs, 对其中的63个进行了PCR分析, 发现有42个具有多态性。但是目前可公开获得的甘蔗属的SSR分子标记数量仍然十分有限, 大部分甘蔗属的SSR标记的引物序列依然没有公开, 而传统的SSR标记开发存在诸多缺点, 耗费人力、物力、且效率低下, 尤其是对于多倍体的甘蔗; 加之, 甘蔗又为同源多倍体, 其基因组大小预测为10 Gb[31], 远远高于其他禾本科作物, 而甘蔗的“高贵化”育种策略造成现代甘蔗品种遗传基础狭窄[3-6]{McCouch, 2002 #23;Dobrovolskaya, 2016 #27}{McCouch, 2002 #23;Dobrovolskaya, 2016 #27}。因此, 甘蔗SSR标记的开发和应用比较缓慢, 现有的SSR标记数目有限, 不能满足在甘蔗属植物上开展各项研究的需要, 严重制约了甘蔗的分子遗传研究进展[22]。
本研究旨在挖掘热带种(LA-purple)的基因组数据, 利用生物信息学方法, 分析全基因组基因序列上SSR位点的数量和分布规律, 包括基序结构和类型、比例、重复次数, 进而设计和合成SSR引物, 开发多态的SSR分子标记, 为未来甘蔗属不同种的遗传多样性分析、遗传图谱构建、重要农艺性状形成的遗传机制研究及开展分子育种研究提供SSR标记数据库支撑。
1 材料与方法
1.1 材料
所有材料均为甘蔗属材料, 包括2个大茎野生种()、4个热带种()、4个割手密()和2个栽培品种(hybrid), 除科5来自广州甘蔗糖业研究所海南甘蔗育种场外, 其他材料都来自国家甘蔗种质资源圃(National Germplasm Repository of Sugarcane)(表1)。
1.2 基因组序列的来源
福建农林大学基因组与生物技术研究中心Ming Ray教授团队采用第三代高通量测序技术, 从头组装, 对热带种(LA-purple)进行了全基因组序列测定工作(数据暂未公布), 并对获得序列上的基因进行了预测。本研究采用的序列(genomic gene sequence)为其中的 255 398个基因, 累计总长1 029 222 285 bp, 平均每个基因的长度为4030 bp。
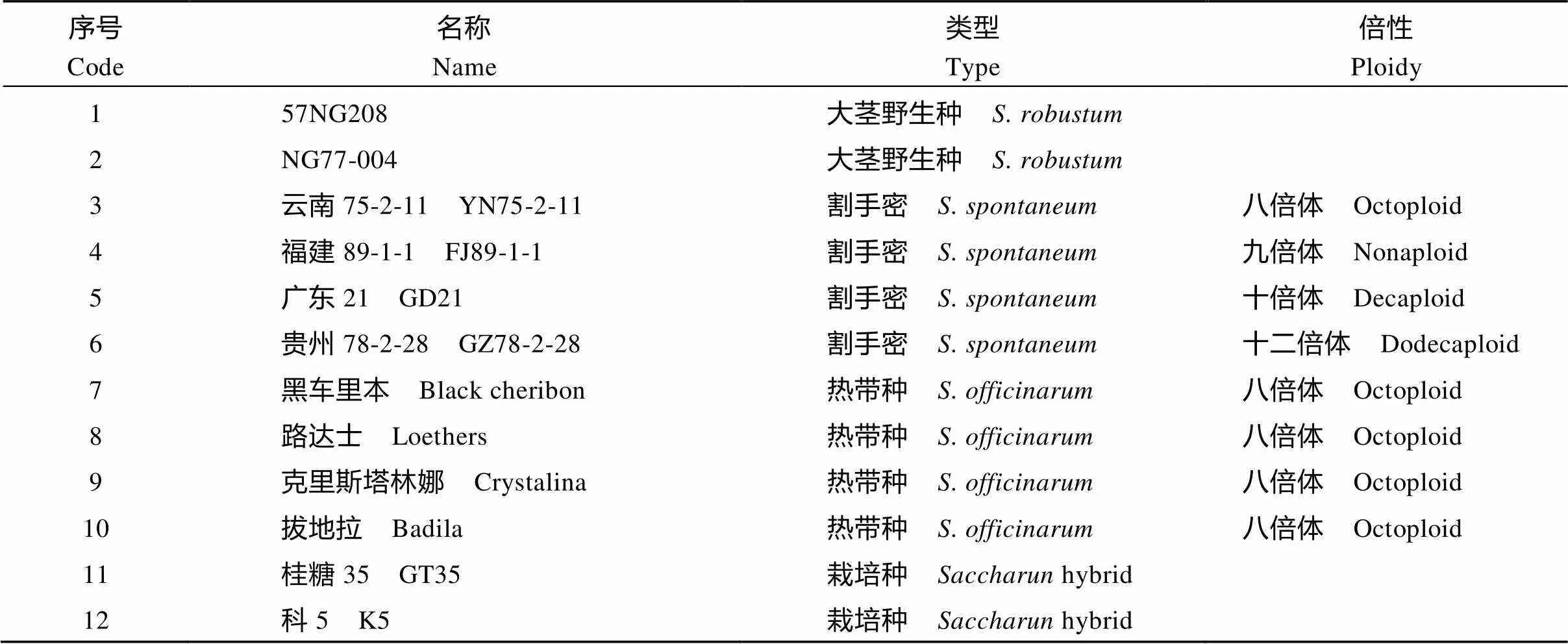
表1 供试甘蔗种质资源名称及来源
1.3 SSR位点的查找与SSR引物的开发
本研究采用Perl语言编写的MISA (microsatellite identification tool)软件扫描甘蔗基因组序列, 查找序列中的SSR位点, 该软件下载自http://pgrc.ipk- gatersleben.de/misa/, 以MISA工具高通量识别和查找简单重复序列。该软件还提供一个与批量设计引物Primer 3的接口工具, 把MISA识别出来的SSR序列转为Primer 3需要的格式, 从而方便批量设计引物。SSR位点查找标准条件为, 将核苷酸重复基序(motif)分为二(dinucleotide repeats, DNRs)、三(trinucleotide repeats, TNRs)、四(tetranucleotide repeats, TtNRs)、五(pentanucleotide repeats, PNRs)、六(hexanucleotide repeats, HNRs), 其最低重复数分别定为6、5、4、3、3; 剔除掉重复的SSR引物设计位点, 对SSR位点两侧保守序列设计引物, 用Primer 3 (http://frodo.wi.mit.edu/primer3/)在线设计引物, 引物参数设计为primer length 18~28 bp; annealing temperature 55~65℃; amplicon size 100~500 bp; GC content 45%~65%[27]。
1.4 DNA的提取、PCR扩增及电泳分析
在幼苗期采集幼嫩叶片, 用液氮研磨后, 按照CTAB方法[32]提取基因组DNA。提取所有参试材料的基因组DNA后, 用NanoDrop 2000超微量紫外分光光度计(Thermo Fisher Scientific)检测基因组DNA的纯度和浓度, 以1×TE (上海生工生物)将其稀释至25 ng μL–1。于–20℃冰箱保存, 用于后续实验。PCR反应体系含25 ng μL–1DNA样品2.0 μL、10×PCR buffer (Mg2+plus) 2.5 μL、25 mmol L–1dNTPs 1.2 μL、10 μmol L–1引物各0.5 μL、0.5 U μL–1酶 0.1 μL, 最后用ddH2O补足25 μL。PCR扩增程序为94℃预变性5 min; 94℃变性30 s, 65℃退火30 s, 72℃延伸30 s, 共10个循环, 每个循环退火温度降低0.7℃; 94℃变性30 s, 55℃退火30 s, 72℃延伸30 s, 共25个循环; 最后72℃延伸7 min, 4℃保存。酶、dNTP等试剂购自北京康为世纪生物科技有限公司。参照Liu等[23]方法, 所有PCR产物在1.5%的高强度琼脂糖凝胶中分离, 120 V恒压下, 电泳1.5 h, 染色、照相及保存。
1.5 统计分析
参照梅嘉洺等[33]SSR电泳图谱统计分析方法, 针对每一对SSR引物, 首先在12个甘蔗属材料上PCR产物的电泳图谱整体分析比较, 鉴定出所有变异类型, 依次被命名为a、b、c、d、e、f等。然后针对每个变异类型(可被看作1个分子标记)统计其在12个材料中的分布情况, 属于该变异类型的记为1, 不属于该变异类型的记为0, 根据统计的结果建立原始数据(0, 1)矩阵。利用NTSYS-pc 2.1软件中的子程序SIMQUAL对矩阵进行样本间的相似性系数(SM)计算, 然后用子程序SAHN中的非加权类平均法(UPGMA)进行聚类分析, 最后用Tree plot绘制树状聚类图。
2 结果与分析
2.1 SSR位点的数量、类型及频率分布
通过MISA软件扫描热带种LA-purple的255 398个基因序列(累计总长为1 029 222 285 bp)来查找二、三、四、五、六碱基5种基序类型的SSR, 共找到153 150个SSR位点, 其中三核苷酸重复基序类型出现的频率最高, 共找出50 072个位点, 占总数的32.70%; 二核苷酸重复基序类型次之, 共找出39 556个位点, 占总数的25.83%, 两者合计占总数的58.53%。而四、五、六核苷酸类型及复合型所占的比例相对较低, 分别为9.53%、16.66%、13.73%和1.55%, 合计占总数的41.47%。平均每1.67个基因或6720 bp含有1个SSR位点(表2)。
针对每个SSR核苷酸重复基序类型, 重复次数越少, 出现的频率就越高。在二核苷酸重复基序类型中, 35.0%的SSR位点含有6个重复, 72.3%的SSR位点的重复次数集中在6~10之间; 在三核苷酸重复基序类型中, 59.4%的SSR位点含有5个重复, 97.1%的SSR位点的重复次数集中在5~10之间; 在四核苷酸重复基序类型中, 71.3%的SSR位点含有4个重复, 99.8%的SSR位点的重复次数集中在4~10之间; 在五核苷酸重复基序类型中, 83.1%的SSR位点含有3个重复, 99.6%的SSR位点的重复次数集中在3~10之间; 在六核苷酸重复基序类型中, 82.7%的SSR位点含有3个重复, 99.4%的SSR位点的重复次数集中在3~10之间(表2)。
在二核苷酸重复基序类型中, TA/AT所占的比例最高, 为41.3%; 而CT/GA、TC/AG、TG/AG、GT/CA和CG/GC所占比例相对较低, 分别为17.9%、14.5%、11.5%、10.2%和4.6% (图1)。在三核苷酸重复基序类型中, TGT/ACA所占比例最高, 为15.6%; CGC/GCG、GGC/CCG和GCC/CGG所占比例次之, 分别为10.8%、9.3%和9.2%; 而其余类型单个所占比例分布在0.5%~4.0%之间(图2)。由于四、五、六核苷酸重复基序类型呈现指数上升(分别为252、1020和4092), 因而使其不同类型基序所出现的频率远远低于二、三核苷酸重复基序。
2.2 开发的SSR标记在甘蔗属不同种间的扩增效率和多态性验证
为了验证上述从热带种(LA-purple)全基因组基因序列上查找出的SSR位点的扩增效率和多态性, 从二核苷酸SSR位点中选择绝对数量最多的AT/TA重复基序类型开发引物, 根据Schlötterer[34]的研究结果, SSR位点基序重复次数越多, 多态性表现越好,鉴于此, 本研究选取基序重复次数在60~90范围内的100个SSR位点开发引物, 对其进行了引物设计和合成, 然后利用合成的100对引物对12个甘蔗属遗传材料的DNA进行PCR扩增和多态性分析, 结果显示, 共有84对引物能够给出清晰的PCR扩增条带, 而其余16对引物没有给出条带或者给出的条带不够清晰, 有52对引物在12个实验材料上呈现多态性, 每对引物给出2~7种扩增类型, 共给出159个扩增类型(平均每一对引物给出3.1种扩增类型), 其中有27对引物在2个甘蔗栽培品种(科5和桂糖35)之间给出多态性扩增(表3)。图3仅展示了其中4对不同SSR引物在12个供试甘蔗属材料上的代表性PCR分析图谱, 其中除引物SoLaSSR096外, 其他3对引物均给出清晰的PCR扩增条带, 并且SoLaSSR007和SoLaSSR070在12个试验材料上呈现多态性。
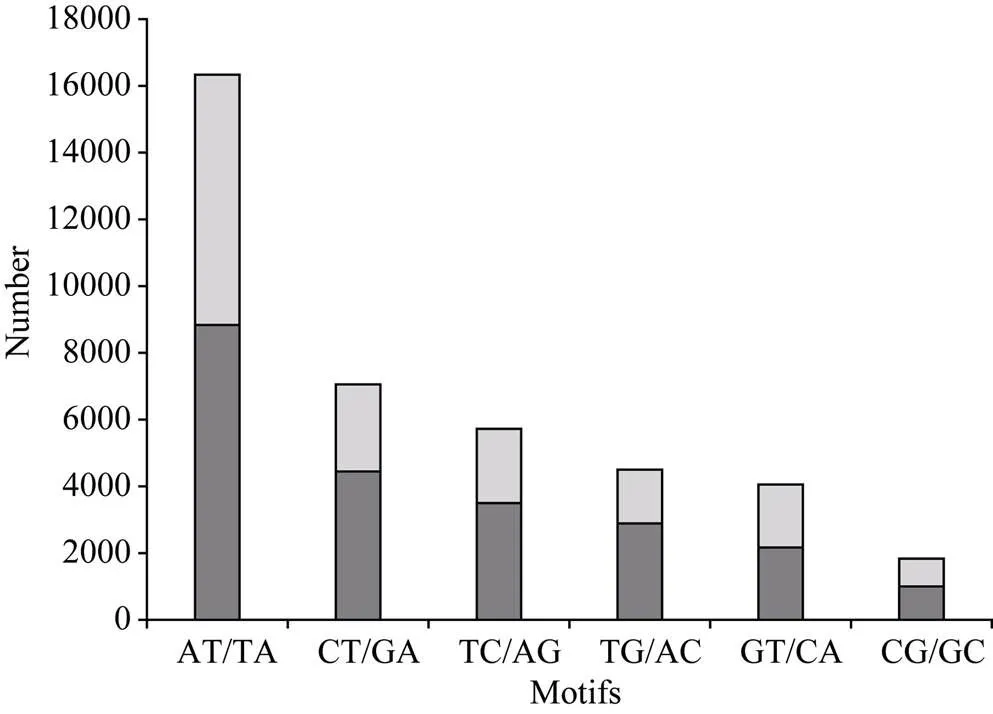
图1 二核苷酸重复基序的次数分布
基于上述52对SSR引物所给出的159种PCR扩增类型, 对12个甘蔗属材料进行了UPGMA聚类分析, 从图4可以看出, 供试材料之间的遗传相似系数分布在0.64~0.86之间, 其中热带种材料之间的相似性系数为0.64~0.77, 2个大茎野生种材料之间的相似性系数为0.66, 割手密材料之间的相似性系数为0.77~0.87, 2个甘蔗栽培品种(科5和桂糖35)之间的遗传相似系数为0.715。整体来看, 12个试验材料没有明显按照种类分组, 但4个割手密材料(云南75-2-11、福建89-1-1、广东21和贵78-2-28)被聚合到同一个小组, 而2个栽培品种与3个热带种(路达士、克里斯塔林娜和拔地拉)聚在一个大组, 表明栽培品种与热带种血缘关系较近。
3 讨论
随着测序技术的快速发展, 越来越多植物基因组序列被测序并公布于众, 这给全基因组水平上查找SSR位点、大规模开发SSR标记创造了极好的条件[35]。到目前为止, 基于基因组测序数据来查找、开发SSR标记的报道越来越多[36–50], 比如, 拟南芥基因组上平均每1.14 kb就有1个SSR位点[36], 水稻基因组上平均每3.6 kb就有1个SSR位点[37], 甘蓝基因组上平均每4 kb就有1个SSR位点[39], 大豆基因组上平均每4.5 kb就有1个SSR位点[41]等。本研究从甘蔗热带种(LA-purple)全基因组的255 398个预测基因序列(累计总长为1 029 222 285 bp)中共找到153 150个SSR位点, 平均每1.67个基因或6720 bp含有1个SSR位点。由于甘蔗热带种(LA-purple)的全基因组测序工作还没有结束, 本研究只用到其部分基因序列, 因此该结果还不能与上述其他植物上的SSR数据直接比较, 但足以证明SSR在甘蔗热带种(LA-purple)基因组上的广泛分布。
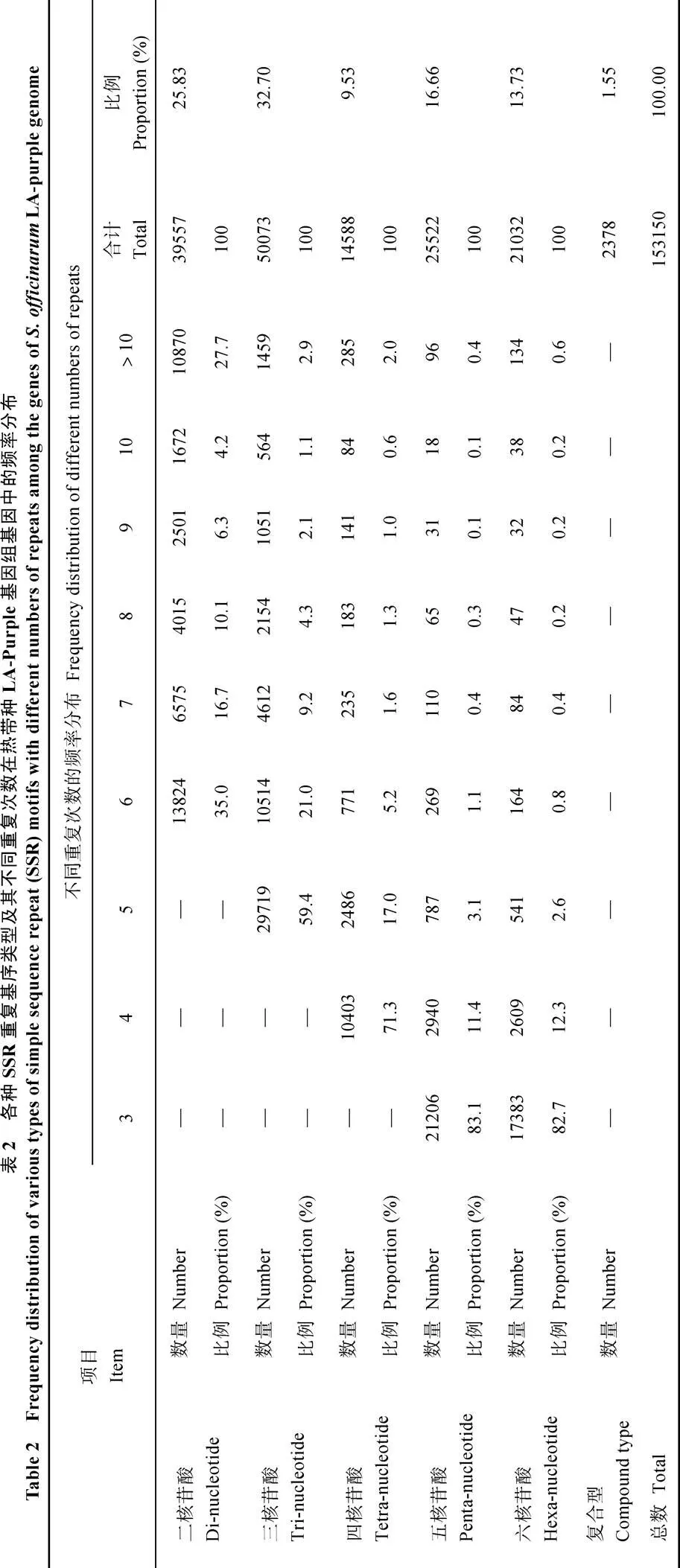
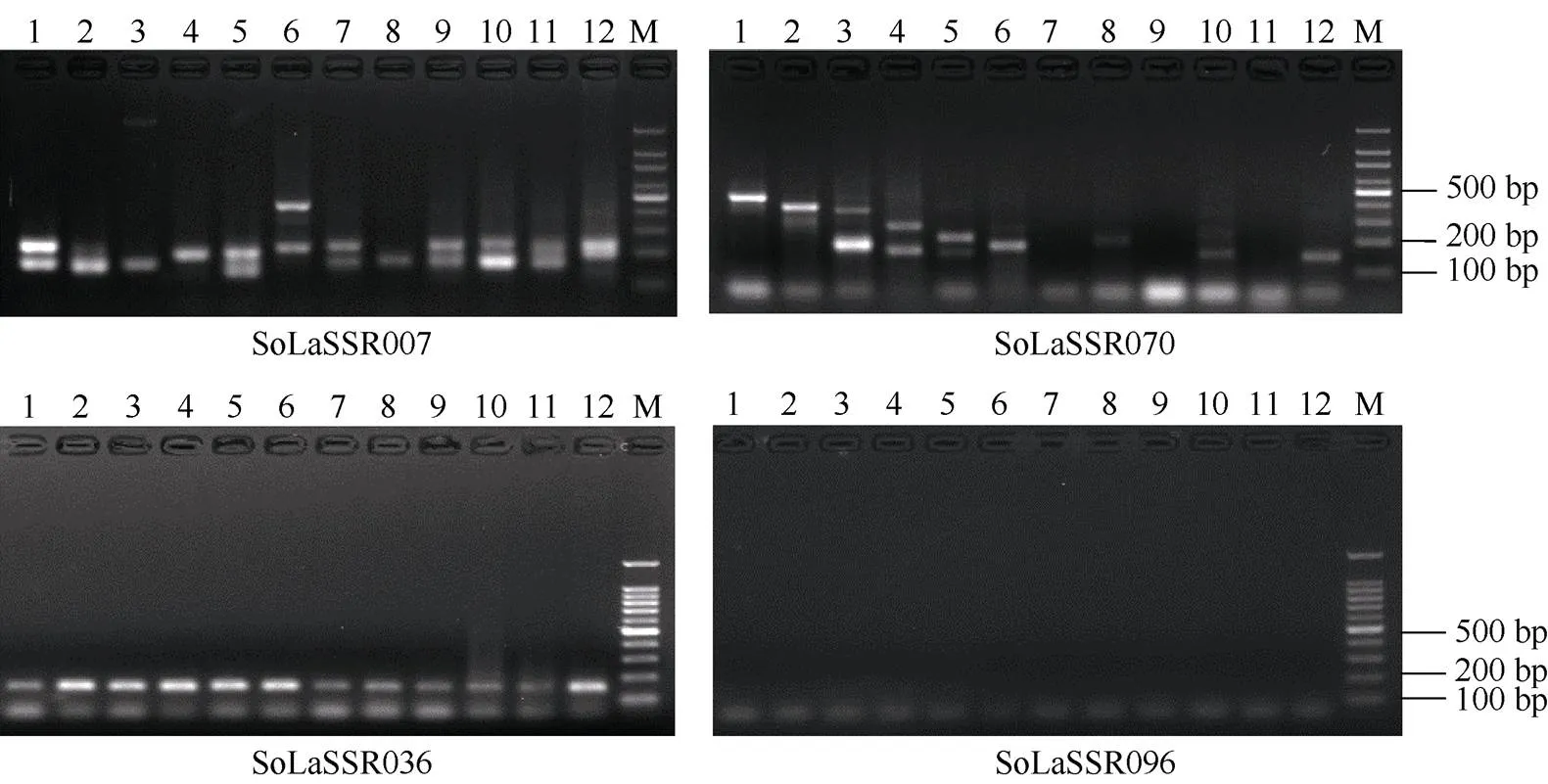
图3 4对不同SSR引物在12个供试甘蔗属材料上的代表性PCR扩增图谱
1: 57NG208; 2: NG77-004; 3: 云南75-2-11; 4: 福建89-1-1; 5: 广东21; 6: 贵州78-2-28; 7: 黑车里本; 8: 路达士; 9: 克里斯塔林娜; 10: 拔地拉; 11: 桂糖35; 12: 科5; M: 100 bp DNA ladder。
1: 57NG208; 2: NG77-004; 3: YN75-2-11; 4: FJ89-1-1; 5: GD21; 6: GZ78-2-28; 7: Black cheribon; 8:Loethers; 9: Crystalina; 10:Badila; 11: GT35; 12: K5; M: 100 bp DNA ladder.
在SSR基序的类型方面, 本研究结果显示甘蔗热带种全基因组基因上三核苷酸重复最多(32.70%), 二核苷酸重复次之(25.83%)。这可能是因为本研究找出的SSR位点位于基因内部, 富集了基因上可翻译成蛋白质序列的三核苷酸重复序列。这个结果和基于表达序列标签(EST)中开发SSR (EST-SSR)的结果相一致[35,37,42], 虽然大多数基因组序列上查找SSR位点的结果都显示基因组上均以二核苷酸重复的SSR位点最多, 而三核苷酸重复的SSR位点次之[36,46-47]。
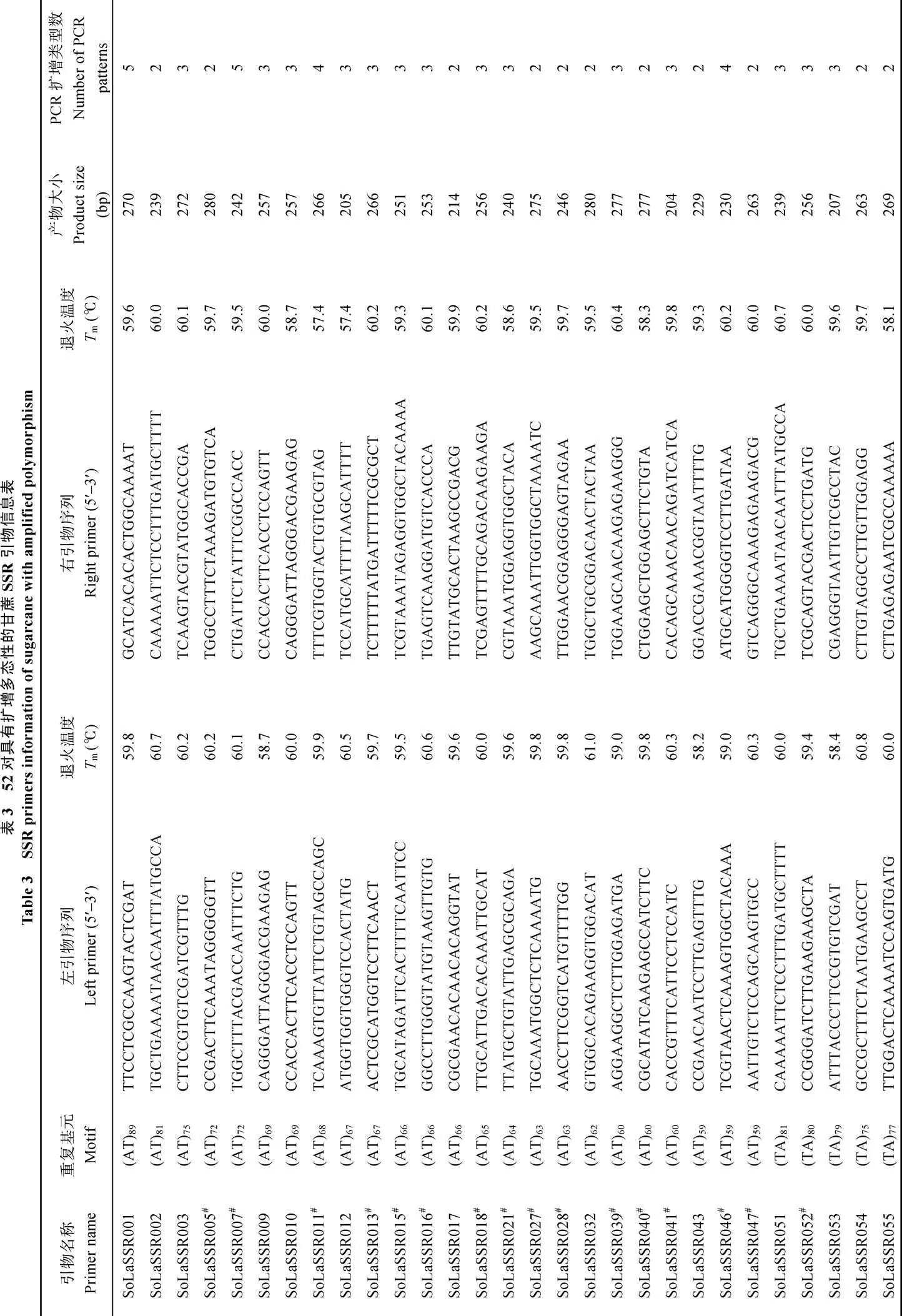
在SSR基序的结构方面, 本研究结果显示甘蔗热带种基因组基因序列中的二核苷酸重复基序SSR类型以AT/TA基序结构出现次数最高, 该结果与烟草[47]、玉米[44]、大豆[38]、可可[45]、高粱[42]的研究结果一致, 但是与水稻、二穗短柄草等AG/TC结构出现次数最高的结果不一致[42]; 三核苷酸重复基序类型以TGT/ACA出现次数最多, 其次是CCG/CGG类型, 这与拟南芥[36]、玉米[44]、水稻[36,42]、高粱[42]、二穗短柄草[42]相类似。产生这种结果很可能是和碱基对所含氢键有关, 即改变GC键需要的能量要高于AT键所需, 因此, DNA复制时滑移产生的SSR重复序列, 需要较少能量的AT结构类型就比较容易产生[47]。
在查出的SSR位点的遗传变异水平方面, 本研究在数量最多的AT/TA重复基序类型中, 选取了100个基序重复次数最高(60~90)的SSR位点, 分析它们在12个甘蔗属材料上的PCR扩增及多态性情况。结果显示, 共有84对引物给出期望的PCR扩增条带, 其中有52对引物在12个实验材料上呈现多态性, 每对给出2~7种扩增类型(平均每一对引物给出3.1种扩增类型); 有27对引物在2个甘蔗栽培品种(科5和桂糖35)之间给出多态性扩增, 这27对引物可以直接用来分析已经制成的“科5´桂糖35”杂交后代分离群体, 参与甘蔗遗传连锁图谱的构建。这个扩增结果及多态性引物的比例可望在今后使用优化的PCR扩增条件及改良的电泳条件(如聚丙烯酰胺电泳技术)而得到进一步的改进和提高, 特别在对本研究找出的SSR位点进行大规模的PCR扩增测试和SSR标记开发时, 需要结合优化的实验条件以便获得最好的效果。
本研究鉴定出的SSR位点全部来自甘蔗热带种基因组基因序列, 这将有利于在甘蔗上寻找与性状显著关联的功能SSR标记。但是由于基因在进化过程中的保守性, 这些基于基因序列的SSR位点(特别是那些位于外显子区域)的多态性会低于那些来自基因组上非编码区的SSR。此外, 热带种基因组为同源多倍体, 现代甘蔗品种80%~90%的染色体都来自热带种, 这些特征都会降低SSR位点的多态性以及PCR扩增质量。因此, 未来在热带种全基因组序列被公布之后, 需要进一步开发非编码区的SSR位点, 同时也要开发来自于甘蔗属内其他种(特别是割手密)的SSR标记, 以便在甘蔗上开发大量的高质量多态性SSR标记。这些新开发的以及前人[13-30]已经开发的SSR标记, 需要在改良的实验条件下统一分析、鉴定和去重复, 从而筛选出一批扩增效果好、扩增谱简单、数量充足的多态性SSR标记, 可以被广泛应用在甘蔗及其近缘种的种质资源鉴定、遗传多样性分析、遗传连锁图谱构建及QTL定位等方面的研究, 为甘蔗的品种鉴定、种质资源的管理和利用、重要农艺性状的遗传研究及分子辅助育种等提供良好的条件。
4 结论
甘蔗热带种(LA-purple)全基因组预测基因序列对开发高质量、多态性SSR标记具有巨大的潜力, 为甘蔗及其近缘种的品系鉴定、遗传多样性分析、遗传图谱构建及重要性状的遗传机制解析等提供了重要的分子标记库支撑。
[1] 刘燕群, 李玉萍, 梁伟红, 宋启道, 秦小立, 叶露. 国外甘蔗产业发展现状. 世界农业, 2015, (8): 147–152 Liu Y Q, Li Y P, Liang W H, Song Q D, Qin X L, Ye L. Current situation of sugarcane industry in the world., 2015, (8): 147–152 (in Chinese with English abstract)
[2] 李明, 田洪春, 黄智刚. 我国甘蔗产业发展现状研究. 中国糖料, 2017, 39(1): 67–70 Li M, Tian H C, Huang Z G. Research on the development status of sugarcane industry in China., 2017, 39(1): 67–70 (in Chinese with English abstract)
[3] Hermann S, Aitken K S, Jackson P A, George A W, Piperidis N, Wei X, Kilian A, Detering F. Evidence for second division restitution as the basis for 2+maternal chromosome transmission in a sugarcane cross., 2012, 187: 359–368
[4] D'Hont A, Grivet L, Feldmann P, Glaszmann J C, Rao S, BerdingN. Characterisation of the double genome structure of modern sugarcane cultivars (spp) by molecular cytogenetics., 1996, 250: 405–413
[5] Piperidis G, Piperidis N, D’Hont A. Molecular cytogenetic investigation of chromosome composition and transmission in sugarcane., 2010, 284: 65–73
[6] Wang H B, Chen P H, Yang Y Q, D’Hont A, Lu Y H. Molecular insights into the origin of the brown rust resistance gene1 amongspecies., 2017, 130: 2431–2443
[7] Ellegren H. Microsatellites: simple sequences with complex evolution., 2004, 5: 435–445
[8] Sharma P. Mining microsatellites in eukaryotic genomes., 2007, 25: 490–498
[9] Smith D N, Devey M E. Occurrence and inheritance of microsatellites in., 1994, 37: 977–983
[10] Morgante M, Hanafey H, Powell W. Microsatellites are preferentially associated with nonrepetitive DNA in plant genome., 2002, 30: 194–200
[11] Klintschar M, Dauber E M, Ricci U, Cerri N, Immel U D, Kleiber M, Mayr W R. Haplotype studies support slippage as the mechanism of germline mutations in short tandem repeats., 2004, 25: 3344–3348
[12] 张增翠, 侯喜林. SSR分子标记开发策略及评价. 遗传, 2004, 26: 763–768 Zhang Z C, Hou X L. Strategies for development of SSR molecular markers., 2004, 26: 763–768
[13] Cordeiro G M, Casu R, McIntyre C L, Manners J M, Henry R J. Microsatellite markers from sugarcane (spp.) ESTs cross transferable toand., 2001, 160: 1115–1123
[14] Aitken K S, Jackson P A, McIntyre C L. A combination of AFLP and SSR markers provides extensive map coverage and identification of homo(eo)logous linkage groups in a sugarcane cultivar., 2005, 110: 789–801
[15] Pan Y B. Highly polymorphic microsatellite DNA markers for sugarcane germplasm evaluation and variety identity testing., 2006, 8: 246–256
[16] Edmé S J, Glynn N G, Comstock J C. Genetic segregation of microsatellite markers inand., 2006, 97: 366–375
[17] Aitken K S, Jackson P A, McIntyre C L. Quantitative trait loci identified for sugar related traits in a sugarcane (spp.) cultivar ×population., 2006, 112: 1306–1317
[18] Garcia A A, Kido E A, Meza A N, Souza H M, Pinto L R, Pastina M M, Leite C S, Silva J A, Ulian E C, Figueira A, Souza A P. Development of an integrated genetic map of a sugarcane (spp.) commercial cross, based on a maximum-likelihood approach for estimation of linkage and linkage phases., 2006, 112: 298–314
[19] Aitken K S, Jackson P A, McIntyre C L. Construction of a genetic linkage map forincorporating both simplex and duplex markers to increase genome coverage., 2007, 50: 742–756
[20] Oliveira K M, Pinto L R, Marconi T G, Mollinari M, Ulian E C, Chabregas S M, Falco M C, Burnquist W, Garcia A A, Souza A P. Characterization of new polymorphic functional markers for sugarcane., 2009, 52: 191–209
[21] Parida S K, Kalia S K, Kaul S, Dalal V, Hemaprabha G, Selvi A, Pandit A, Singh A, Gaikwad K, Sharma T R, Srivastava P S, Singh N K, Mohapatra T. Informative genomic microsatellite markers for efficient genotyping applications in sugarcane, 2009, 118: 327–338
[22] 刘新龙, 毛钧, 陆鑫, 马丽, Aitken K S, Jackson P A, 蔡青, 范源洪. 甘蔗SSR和AFLP分子遗传连锁图谱构建. 作物学报, 2010, 36: 177–183 Liu X L, Mao J, Lu X, Ma L, Aitken K S, Jackson P A, Cai Q, Fan Y H. Construction of molecular genetic linkage map of sugarcane based on SSR and AFLP markers.2010, 36: 177–183 (in Chinese with English abstract)
[23] Liu P, Que Y X, Pan Y B. Highly polymorphic microsatellite DNA markers for sugarcane germplasm evaluation and variety identity testing, 2011, 13: 129–136
[24] Andru S, Pan Y B, Thongthawee S, Burner D M, Kimbeng C A. Genetic analysis of the sugarcane (spp.) cultivar ‘LCP 85-384’: I. Linkage mapping using AFLP, SSR, and TRAP markers., 2011, 123: 77–93
[25] Devarumath R M, Kalwade S B, Kawar P G, Sushir K V. Assessment of genetic diversity in sugarcane germplasm using ISSR and SSR markers., 2012, 14: 334–344
[26] 黄启星, 张雨良, 王俊刚, 伍苏然, 张树珍, 郭安平. 甘蔗EST-SSR标记的开发和多样性分析. 热带农业科学, 2012, 32(12): 33–42Huang Q X, Zhang Y L, Wang J G, Wu S R, Zhang S Z, Guo A P. Data-mining and diversity analysis of EST-SSRs from sugarcane., 2012, 32(12): 33–42 (in Chinese with English abstract)
[27] Singh R K, Jena S N, Khan S, Yadav S, Banarjee N, Raghuvanshi S, Bhardwaj V, Dattamajumder S K, Kapur R, Solomon S, Swapna M, Srivastava S, Tyagi A K. Development, cross- species/genera transferability of novel EST-SSR markers and their utility in revealing population structure and genetic diversity in sugarcane., 2013, 524: 309–329
[28] Shamshad UH, KumarP, SinghRK, VermaK S, BhattR, SharmaM, Kachhwaha S, Kothari SL.Assessment of functional EST-SSR markers (sugarcane) in cross-species transferability, genetic diversity among Poaceae plants, and bulk segregation analysis., 2016, 2016: 7052323
[29] 刘新龙, 李旭娟, 刘洪博, 马丽, 徐超华, 范源洪. 云南甘蔗常用亲本资源遗传多样性的SSR分析. 植物遗传资源学报, 2015, 6: 1214–1222 Liu X L, Li X J, Liu H B, Ma L, Xu C H, Fan Y H. Genetic diversity analysis of Yunnan commonly-used parents by using SSR marker., 2015, 6: 1214–1222 (in Chinese with English abstract)
[30] Liu P, Chandra A, Que Y, Chen P H, Grisham M, White W, Dalley C, Tew T, Pan Y B. Identification of quantitative trait loci controlling sucrose content based on an enriched genetic linkage map of sugarcane (spp. hybrids) cultivar LCP 85-384., 2016, 207: 527–549
[31] Wang J, Roe B, Macmil S, Yu Q, Murray J E, Tang H, Chen C, Najar F, Wiley G, Bowers J, Van Sluys M A, Rokhsar D S, Hudson M E, Moose S P, Paterson A H, Ming R. Micro-collinearity between autopolyploid sugarcane and diploid sorghum genomes., 2010, 11: 261–278
[32] Murray H G, Thompson W F. Rapid isolation of high molecular weight plant DNA., 1980, 8: 4321–4325
[33] 梅嘉洺, 黄小霞, 王咏, 朱美兰, 林辉, 阳宴清, 卢运海. 46份菌草种质资源PEPC基因的PCR-RFLP多样性分析. 热带农业科学, 2015, 35(11): 45–50 Mei J M, Huang X X, Wang Y, Zhu M L, Lin H, Yang Y Q, Lu Y H. Polymorphism analysis of PEPC gene family among 46 Juncao germplasms by PCR-RFLP., 2015, 35(11): 45–50 (in Chinese with English abstract)
[34] Schlötterer C. Evolutionary dynamics of microsatellite DNA.. 2000, 109: 365–371
[35] Gerard L C, Jeanne J, Samantha J B, Jifeng TRoeland E V, Jack A MHerman V E, Ben V. Large-scale identification of polymorphic microsatellites using anapproach., 2008, 9: 374–386
[36] Lawson M J, Zhang L. Distinct patterns of SSR distribution in theand rice genomes., 2006, 7: R14
[37] Zhang Z, Deng Y, Tan JHu S, Yu J, Xue Q. A genome-wide microsatellite polymorphism database for theandrice., 2007, 14: 37–45
[38] Blair M W, Buendia H F, Giraldo M C, Metais I, Peltier D. Characterization of AT-rich microsatellites in common bean (L.)., 2008, 118: 91–103
[39] Iniguez F L, Voort A V, Osborn T C. Development of a set of public SSR markers derived from genomic sequence of a rapid cyclingL. genotype., 2008, 117: 977–985
[40] Yonemaru J I, Ando T, Mizubayashi T, Kasuga S, Matsumoto T, Yano M. Development of genome-wide simple sequence repeat markers using whole-genome shotgun sequences of sorghum ((L.) Moench)., 2009, 16: 187–193
[41] Song Q, Jia G, Zhu Y, Grant D, Nelson R T, Wang E Y, Hyten D L, Cregan P BAbundance of SSR motifs and development of candidate polymorphic SSR markers (BARCSOYSSR1.0) in Soybean., 2010, 50: 1950–1960
[42] 郑燕, 张耿, 吴为人. 禾本科植物微卫星序列的特征分析和比较. 基因组学与应用生物学, 2011, 30: 513–520 Zheng Y, Zhang G, Wu W R. Characterization and comparison of microsatellites in gramineae., 2011, 30: 513–520 (in Chinese with English abstract)
[43] 仪泽会, 卢有飞, 郭晓芹, 惠麦侠, 张鲁刚, 张明科. 大白菜简单序列重复(SSR)和插入/缺失(InDel)标记的开发及通用性分析. 农业生物技术学报, 2012, 12: 1398–1406 Yi Z H, Lu Y F, Guo X Q, Hui M X, Zhang L G, Zhang M K. Development of simple sequence repeat (SSR) and insertion/deletion (InDel) markers in Chinese cabbage (ssp. pekinesis) and analysis of their transferability., 2012, 12: 1398–1406 (in Chinese with English abstract)
[44] 原志敏. 玉米全基因组SSRs分子标记开发与特征分析. 四川农业大学硕士学位论文, 四川雅安, 2013 Yuan Z M. Development and Characterization of SSR Markers Providing Genome-wide Coverage and High Resolution in Maize. MS Thesis of Sichun Agriculture University, Ya’an, China, 2013 (in Chinese with English abstract)
[45] 曹恒春, 王毅, 黄莉莎, 王玉军, 于元杰, 杨龙. 可可全基因组SSR标记的开发及分析. 山东农业大学学报(自然科学版), 2013, 44: 340–344 Cao H C, Wang Y, Huang L S, Wang Y J, Yu Y J, Yang L. Large-scale development of SSR markers in the genome of cacao.(Natural Science Edition), 2013, 44: 340–344 (in Chinese with English abstract)
[46] Wei X, Wang L, Zhang Y, Qi X, Wang X, Ding X, Zhang J, Zhang X. Development of simple sequence repeat (SSR) markers of sesame () from a genome survey., 2014, 19: 5150–5162
[47] 童治军, 焦芳婵, 肖炳光. 普通烟草及其祖先种基因组SSR位点分析. 中国农业科学, 2015, 48: 2108–2117 Tong Z J, Jiao F C, Xiao B G. Analysis of SSR loci ingenome and its two ancestral species genome., 2015, 48: 2108–2117 (in Chinese with English abstract)
[48] Song X, Ge T, Li Y, Hou X. Genome-wide identification of SSR and SNP markers from the non-heading Chinese cabbage for comparative genomic analyses., 2015, 16: 328
[49] Motalebipour E Z, Kafkas S, Khodaeiaminjan M, Çoban N, Gözel H. Genome survey of pistachio (L.) by next generation sequencing: Development of novel SSR markers and genetic diversity inspecies., 2016, 17: 998
[50] Gil J, Um Y, Kim S, Kim O T, Koo S C, Reddy C S, Kim S C, Hong C P, Park S G, Kim H B, Lee D H, Jeong B H, Chung J W, Lee Y. Development of genome-wide SSR markers fromNakai using next generation sequencing.(Basel), 2017, 8: E238
Development and Characterization of SSR Markers from the Whole Genome Sequences of(LA-purple)
WANG Heng-Bo, XIAO Nai-Yan, ZHU Zhuan-Wei, LIU Cui-Cui, Intikhab ALAM, CHEN Ping-Hua, and LU Yun-Hai*
Key Laboratory of Ministry of Agriculture for Sugarcane Biology and Genetic Breeding (Fujian), Key Laboratory of Ministry of Education for Genetics, Breeding and Multiple Utilization of Crops, College of Crop Science, Fujian Agriculture and Forestry University, Fuzhou 350002, Fujian, China
Modern sugarcane cultivars (2= 100–130) are derived from interspecific hybridization and backcross breeding between(2= 80) and(2= 40–128), forming polyploid and aneuploid crops. The main components (80%–90%) of the sugarcane cultivars’ genome are originated from. The development and mining of genomic SSR molecular marker of, will benefit sugarcane genetic diversity analysis, molecular marker assisted selection, and construction of genetic maps. In this study, we explored the SSR loci from 255 398 predicted gene sequences (with a cumulative length of 1 029 222 285 bp) derived from the whole genome sequencing project of aclone LA-purple, by combining Perl program with bioinformatics software. A total of 153 150 SSR loci, with an average of 1.67 genes per SSR locus, were identified, of which 39 556 (25.8%) were dinucleotide repeat motifs and 50 072 (32.7%) were tri-nucleotide repeat motifs. Among the dinucleotide repeat motifs, TA/AT had the highest proportion, accounting for 41.4%, while CG/GC had the lowest proportion, accounting for only 4.6%. Among the trinucleotide repeat motifs, TGT/ACA had the highest proportion, accounting for 15.6%. One hundred SSR loci with 60–90 repeats of TA/AT motifs were selected and analyzed by PCR amplification in 12 representative Saccharum clones, of which 52 were polymorphic among the 12 clones and 27 were polymorphic between the tested two modern sugarcane cultivars. The genome-wide development of these gene-based SSR markers will not only facilitate the DNA fingerprinting analysis of sugarcane cultivars, but also help to construct the genetic maps, analyze the genetic diversity, study the genetic mechanism of important traits in Saccharum species, and provide important support to the molecular breeding in sugarcane.
sugarcane; genome sequence; SSR; marker development; polymorphism
2017-11-20;
2018-03-26;
2018-04-09.
10.3724/SP.J.1006.2018.01400
卢运海, E-mail: yunhai.lu@fafu.edu.cn
E-mail: wanghengbo_0354@126.com
本研究由国家现代农业产业技术体系建设专项(CARS-20-1)和国家甘蔗工程技术研究中心2017年主任课题基金项目(ptjh1500117) 资助。
This study was supported by the China Agriculture Research System (CARS-20-1) and the National Sugarcane Engineering Research Center of Director Project Fund in 2017 (ptjh1500117).
URL: http://kns.cnki.net/kcms/detail/11.1809.S.20180409.1434.034.html

