基于酯酶同工酶和ITS序列对陕南栽培灵芝亲缘关系的研究
贾少杰,解修超,2*,邓百万,2,彭 浩,2
(1.陕西理工大学 生物科学与工程学院,陕西 汉中 723001; 2.陕西省食药用菌工程技术研究中心,陕西 汉中 723001)
灵芝(Ganodermalucidum)又名仙草、木灵芝。隶属于多孔菌科(Polyporaceae)灵芝属(GanodermaKarst)真菌。我国《神农本草经》《本草经集注》《本草纲目》等古籍中皆有灵芝记载。据《神农本草经校注》记载[1],灵芝具有养心安神、止咳平喘、延年益寿的功效。现代研究表明,灵芝含有多糖、三萜、麦角甾醇、生物碱等多种活性成分,在降血糖、降血脂、抗肿瘤、提高免疫力和抗氧化[2-5]等方面有极高的药用价值。
国内外对灵芝的分类及亲缘关系的研究从未间断[6-8],其中同工酶和DNA分子研究方法应用较为广泛。在真菌亲缘关系研究中常用的同工酶有酯酶、漆酶、超氧化物歧化酶、多酚氧化酶、过氧化氢酶等,其中以酯酶同工酶的酶谱较为稳定[9]。酯酶同工酶(Esterase isoenzyme)是指催化作用相同而蛋白质结构不同的一组酶,是细胞基因表达的产物,能够直接表现出物种在基因水平上的差异,因而在微生物和植物的分类鉴定、亲缘关系研究等方面广泛应用。Liu[10]采用酯酶同工酶技术对香菇菌株及其杂交后代进行了亲缘关系研究,明确了亲本与杂种之间的遗传关系,为后续栽培试验提供了理论依据。将酯酶同工酶和现代DNA分子学鉴定技术结合利用,可有效增加菌种鉴别的可靠性和准确性[11]。核糖体DNA间隔序列分析(rDNA internal transcribed spacer,rDNA-ITS)是一种常用于真菌的分子水平上的亲缘关系研究方法,可以反映真菌亲缘关系与分类情况[12],由于真菌ITS区进化速率快,表现出极为广泛的多态性,在真菌的鉴定及亲缘关系研究中发挥着重要作用。因此,rDNA-ITS被广泛应用于真菌的分子学鉴定[13-15]。Bengtsson-Palme等[16]利用ITS序列对20组真菌和植物进行了分类研究。
目前,我国栽培灵芝面临生产种名混乱的严峻问题[17-18]。陕南是陕西灵芝栽培的主要地区,由于对陕南灵芝栽培种亲缘关系研究较少,致使该区灵芝菌种混乱现象尤为突出,严重阻碍了灵芝的工业化生产,同种异名、同名异种、种名不一情况亟待解决。本研究通过菌丝体生物学特征、拮抗试验、酯酶同工酶、ITS序列分析对陕南地区灵芝主要栽培种的生物学名和亲缘关系进行分析研究,旨在为陕南地区栽培灵芝的育种、生产和保护提供理论依据。
1 材料和方法
1.1 试验材料
1.1.1 供试菌种及来源 收集汉中、安康、商洛各地区主栽灵芝菌种10株,菌种名称及来源详见表1。
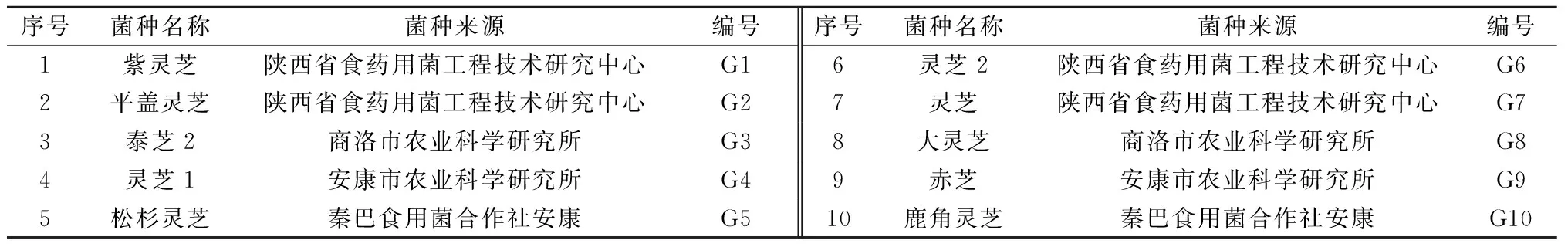
表1 陕南主栽灵芝菌种信息
1.1.2 主要试剂 β-巯基乙醇购自北京鼎国生物技术有限责任公司;三氯甲烷、异丙醇购自天津市富宇精细化工有限公司;琼脂糖购自厦门太阳马生物工程有限公司;乙酸-α-萘酯、乙酸-β-萘酯、固蓝RR盐、过硫酸铵购自上海拜力生物科技有限公司;甘氨酸、阿魏酸购自天津市天力化学试剂有限公司;N,N-亚甲双丙烯酰胺购自天津市福晨化学试剂厂;溴化乙锭购自美国Biotium公司;三羟甲基氨基甲烷、丙烯酰胺、溴酚蓝购自天津市天力化学试剂有限公司;Buffer Digestion、Buffer PF、TE Buffer 购自上海生工生物工程有限公司;试验用水均为蒸馏水。
1.1.3 主要仪器 5404R型高速冷冻离心机购自德国Eppendorf仪器公司;GELDOC型凝胶成像仪购自美国 Bio-Rad仪器公司;DYY-6C型电泳仪购自北京市六一仪器厂;VG3-S25型圆周匀速振荡器购自德国IKA仪器公司;K960型热循环PCR仪购自杭州晶格科学仪器有限公司;SW-CJ-1F型无菌操作台购自苏州安泰空气技术有限公司;MJ-54A型高压蒸汽灭菌锅购自施都凯仪器设备(上海)有限公司。
1.1.4 培养基 PDA培养基:土豆200.00 g、葡萄糖20.00 g、琼脂20.00 g、磷酸二氢钾3.00 g、硫酸镁1.50 g、蛋白胨3.00 g、维生素B10.01 g、水1 000 mL,自然pH值;同工酶液体培养基:洋葱200.00 g、蔗糖10.00 g、阿魏酸0.06 g、水1 000 mL,自然pH值。
1.2 试验方法
1.2.1 菌种活化 将10株灵芝菌种分别接种到灭菌的PDA培养基中,28 ℃恒温静置培养6 d。
1.2.2 菌丝形态及生长速度测定 以5 mm2接种量将活化后菌种接入PDA培养基中,封口膜密封后置于28 ℃恒温培养箱中静置培养,2 d后使用游标卡尺每天固定时间测量菌丝生长速度,观察其形态、色泽、边缘整齐度、密度,每个菌种设置3个重复。
1.2.3 液体培养基中菌丝形态观察 接种后的液体培养基静置24 h后,28 ℃、140 r/min恒温摇床振荡培养7 d,观察菌丝球大小、形状、密度、颜色及培养基颜色。
1.2.4 拮抗试验 以5 mm2接种量将活化6 d后的菌种接入PDA培养基中,每个平板接2块菌种,密封后置于28 ℃恒温培养箱中静置培养,每个菌种3个重复,记录拮抗反应情况。
1.2.5 酯酶同工酶提取及检测 称量1.5 g菌丝体,加3 mL pH值6.8的Tris-HCl混匀,4 ℃、10 000 r/min离心10 min得上清;配制9%的分离胶,蒸馏水封住胶面,50 ℃恒温凝固30 min,配制6%的浓缩胶(pH值为8.9)日光灯下自然聚合,加8 μL样品和2 μL甘油溴酚蓝指示剂、5 μL 10%蔗糖溶液混匀后点样,点样量6 μL;浓缩胶室温80 V电泳,待指示剂进入分离胶后将电泳仪转移至4 ℃冰箱,指示剂距分离胶底部1 cm处时停止电泳,在乙酸-α-萘酯、乙酸-β-萘酯和固蓝RR盐染液中37 ℃染色30 min,7%醋酸溶液固定,凝胶成像仪扫描拍照,计算相对迁移率Rf;采用NTSYS-pc 2.11软件进行聚类分析,绘制聚类图。
1.2.6 DNA的提取及扩增 取活化后的菌丝约1.0 g,加液氮研磨成粉末状;加400 μL Buffer Digestion和4 μL β-巯基乙醇置于65 ℃电热恒温水槽1 h,每10 min振荡混匀一次;加20 μL RNase A(10 mg/mL),室温放置3~5 min;加200 μL Buffer PF,混匀,-20 ℃冰箱中放置5 min;4 ℃、10 000 r/min离心5 min取上清,加等体积异丙醇溶液,10 000 r/min离心5 min;75%乙醇溶液漂洗沉淀,打开离心管倒置20 min,50 μL TE Buffer溶解DNA。以ITS1(TCCGTAGGTGAACCTGCGG)和ITS4(TCCTCCGCTTATTGATATGC)为引物,进行PCR扩增。PCR扩增程序:94 ℃预变性5 min,94 ℃变性1 min,72 ℃延伸1 min,57 ℃退火45 s,共35个循环;72 ℃延伸10 min。
1.2.7 基于ITS序列构建系统发育树 将PCR扩增后的DNA送至生工生物工程(上海)股份有限公司进行全基因测序,结果提交GenBank获得登录号(MH018022—MH018031);利用NCBI中的BLAST与GenBank中的已知序列进行比对,下载同源性较高的菌种序列,用MEGA 6.0软件的NJ(Neighbor-joining)方法构建系统发育树,利用自展法(Bootstrap,1 000次重复)检验各分支的置信度。
2 结果与分析
2.1 供试菌种生长速度及菌落形态
图1和表2表明,陕南主栽灵芝菌丝生长速度有差异,色泽均为白色,部分在后期会产生黄色斑块。其中,泰芝2菌种后期会产生淡黄色液滴。平盖灵芝和大灵芝菌种的菌丝形态为绒毛状且菌丝边缘不整齐,其余菌种菌丝形态均为絮状,菌丝边缘整齐;菌丝密度也因菌种的不同而存在差异,紫灵芝、泰芝2、灵芝1、松杉灵芝、大灵芝、赤芝菌种菌丝体浓密,平盖灵芝、灵芝2、鹿角灵芝菌种菌丝体较浓密,灵芝菌种菌丝体较稀疏。此外,10株主栽菌种在28 ℃、避光条件下,均能在PDA固体培养基上正常生长,但生长速度各异。灵芝1菌种菌丝生长速度最快,达到(10.56±0.042)mm/d,松杉灵芝菌种次之,达到(9.46±0.135)mm/d,泰芝2菌种生长速度最慢,仅为(4.35±0.016)mm/d。10株主栽菌种的平均生长速度为6.93 mm/d,其中灵芝1、松杉灵芝、灵芝2、大灵芝、鹿角灵芝菌种的生长速度均高于平均生长速度,而紫灵芝、平盖灵芝、泰芝2、灵芝、赤芝菌种生长速度均低于平均生长速度。
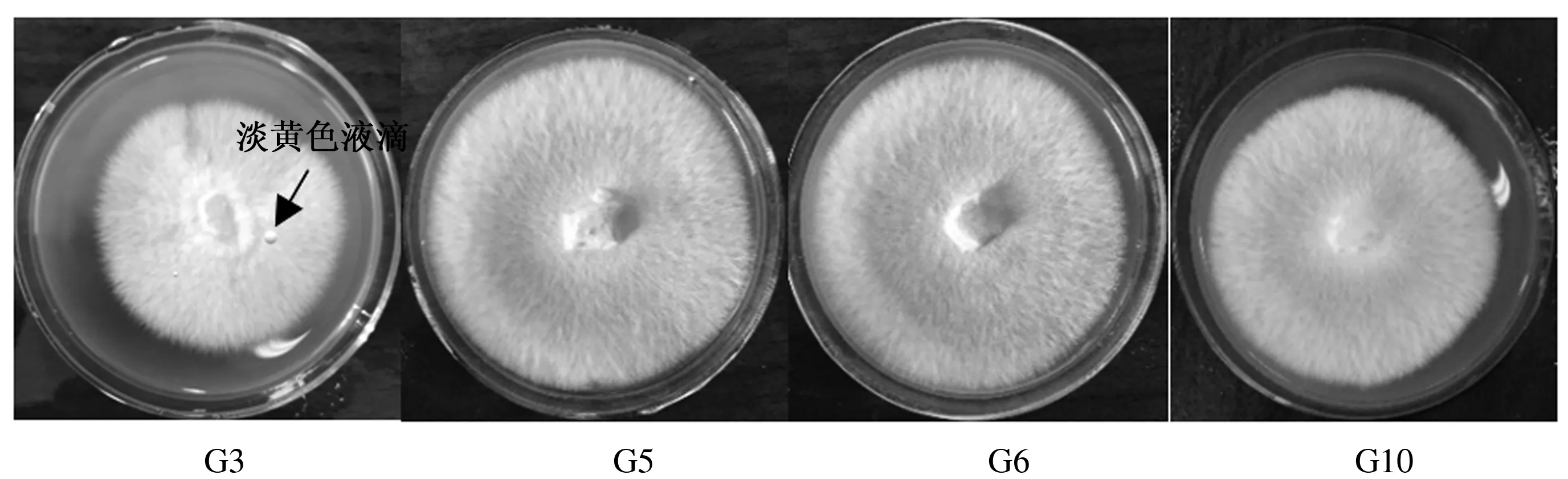
图1 陕南主栽灵芝部分菌种在PDA培养基中的菌丝体形态(培养6 d)
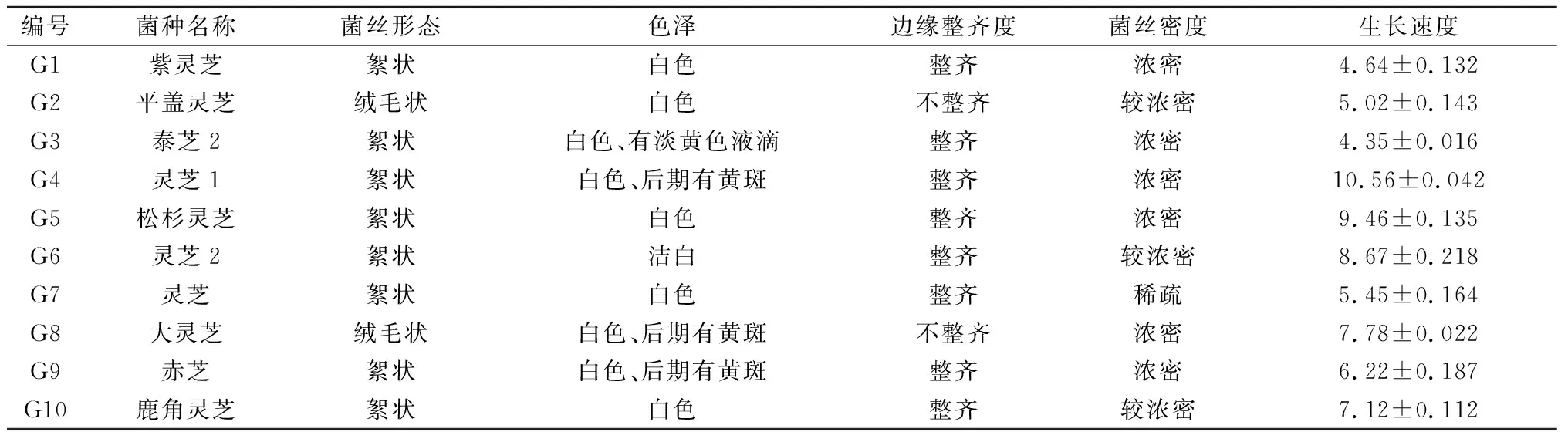
编号菌种名称菌丝形态色泽边缘整齐度菌丝密度生长速度G1紫灵芝絮状白色整齐浓密4.64±0.132G2平盖灵芝绒毛状白色不整齐较浓密5.02±0.143G3泰芝2絮状白色、有淡黄色液滴整齐浓密4.35±0.016G4灵芝1絮状白色、后期有黄斑整齐浓密10.56±0.042G5松杉灵芝絮状白色整齐浓密9.46±0.135G6灵芝2絮状洁白整齐较浓密8.67±0.218G7灵芝絮状白色整齐稀疏5.45±0.164G8大灵芝绒毛状白色、后期有黄斑不整齐浓密7.78±0.022G9赤芝絮状白色、后期有黄斑整齐浓密6.22±0.187G10鹿角灵芝絮状白色整齐较浓密7.12±0.112
2.2 供试菌种的液体形态特征
表3表明,在28 ℃、140 r/min 避光摇床培养的条件下,10株主栽灵芝菌种中平盖灵芝、灵芝1、灵芝2、大灵芝、鹿角灵芝菌种的菌丝球为颗粒状,紫灵芝、泰芝2、灵芝菌种的菌丝球为圆球状,松杉灵芝菌种的菌丝球为梭形,赤芝菌种的菌丝球为絮状;紫灵芝、灵芝1、灵芝、赤芝、鹿角灵芝菌种的菌丝球为白色,平盖灵芝、松杉灵芝、灵芝2、大灵芝菌种的菌丝球为淡黄色,泰芝2菌种的菌丝球为灰色,少数菌丝球呈现黑色;紫灵芝、灵芝1菌种的菌丝球较大,泰芝2、灵芝菌种的菌丝球中等,平盖灵芝、松杉灵芝、灵芝2、大灵芝、赤芝、鹿角灵芝菌种的菌丝球较小;平盖灵芝、灵芝1、松杉灵芝、灵芝2、大灵芝、鹿角灵芝菌种的菌丝球密度高,而紫灵芝、泰芝2、灵芝、赤芝菌种的菌丝球密度次之。

表3 陕南主栽灵芝菌种液体形态特征
2.3 供试菌种拮抗试验结果
拮抗试验结果(表4)表明,陕南地区供试10株灵芝菌种之间拮抗反应程度差异较大。菌种紫灵芝、泰芝2之间无明显拮抗反应,表明菌种的体细胞之间亲和,生理特征基本相似,因此初步判断二者亲缘关系相近;其余菌种之间均发生拮抗反应,但不同菌种之间拮抗反应程度不同。菌种赤芝分别与菌种紫灵芝、平盖灵芝、泰芝2、灵芝1、松杉灵芝、鹿角灵芝之间的拮抗反应极强,拮抗线呈现隔离带型,初步判断菌种之间细胞的生理特性差异大,亲缘关系远;菌种灵芝2分别与紫灵芝、平盖灵芝、灵芝1、灵芝、大灵芝、赤芝之间的拮抗反应较强,拮抗线较明显,且菌丝体在拮抗线附近集结,判定亲缘关系较远;鹿角灵芝分别与紫灵芝、平盖灵芝、灵芝1之间拮抗反应较弱,表明菌种之间亲缘关系较近。

表4 陕南主栽灵芝菌种拮抗试验结果
注:-、+、++、+++分别表示无拮抗现象、拮抗现象较弱、拮抗现象较强、拮抗现象极强。
2.4 供试菌种酯酶同工酶检测结果
2.4.1 酯酶同工酶酶谱 10株灵芝酯酶同工酶酶谱见图2,模式图见图3。结果表明,10株灵芝菌株共测得酶谱条带54条,不同菌株的酶谱条带不同。各菌株的酶谱条带为3~7条,松杉灵芝菌株的酶谱条带最多,为7条,鹿角灵芝菌株的酶谱条带最少,为3条,其余菌株的酶谱条带为4~6条;54条酶谱条带的迁移率为0.317~0.634;在迁移率为0.453附近时,一级酶谱条带18条;菌株松杉灵芝、灵芝2、赤芝酶谱条带集中且相似,亲缘关系较近;菌株紫灵芝、泰芝2酶谱条带迁移率相似,亲缘关系相近。
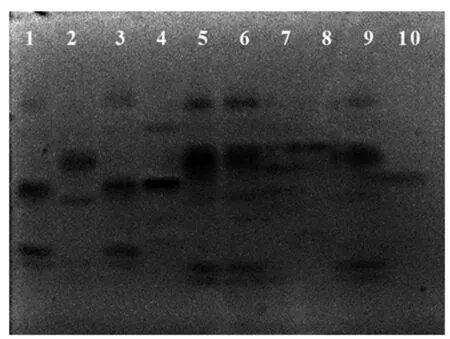
1—10:分别代表菌种G1—G10
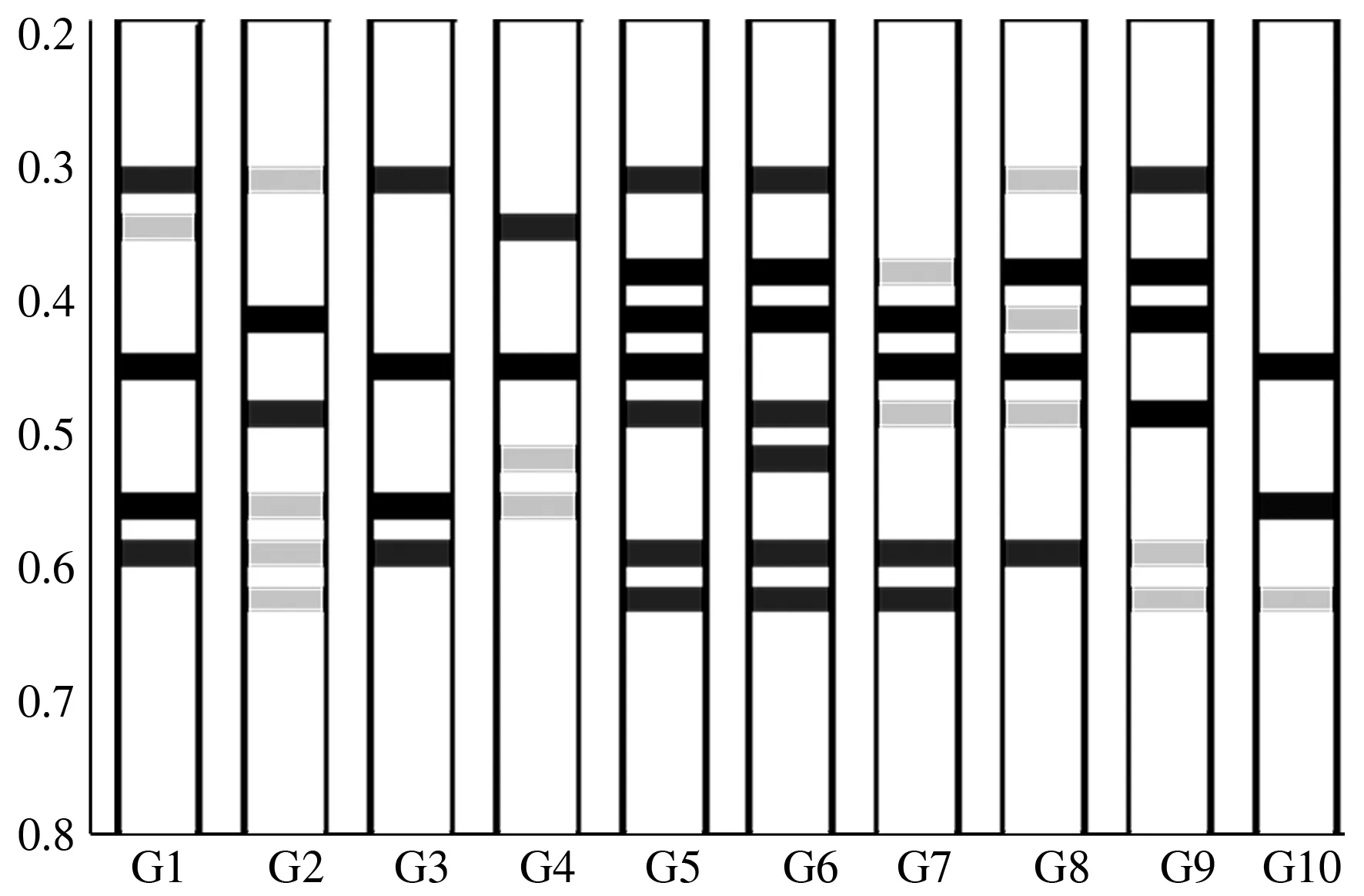
图3 陕南主栽灵芝菌种酯酶同工酶酶谱模式图
2.4.2 酯酶同工酶聚类分析 图4表明,10株灵芝菌种在70%的相似水平上分为4类,紫灵芝、泰芝2、鹿角灵芝聚为一类,平盖灵芝、灵芝1各自单独聚为一类,松杉灵芝、灵芝2、灵芝、大灵芝、赤芝聚为一类;在80%的相似水平上,10株灵芝菌种聚为6类,紫灵芝、泰芝2聚为一类,平盖灵芝、灵芝1、鹿角灵芝各自单独聚为一类,松杉灵芝、灵芝、大灵芝聚为一类,灵芝2、赤芝聚为一类。

图4 陕南主栽灵芝菌种酯酶同工酶聚类分析
2.5 供试菌种ITS序列分析结果
2.5.1 DNA电泳图谱分析 紫外凝胶成像(图5)

1—10:分别代表菌种G1—G10;M: Marker DL 2000
结果表明,10株灵芝菌种的基因组经PCR扩增后,条带整齐明亮,菌株的rDNA-ITS区域的序列片段长度均在600 bp左右,将测得的基因序列提交NCBI比对。
2.5.2 基于ITS序列构建的系统发育树 10株灵芝菌种的系统发育树见图6,陕南地区10株主栽灵芝菌种聚为4类。紫灵芝、平盖灵芝、泰芝2、鹿角灵芝聚为一个单元,其中,平盖灵芝与Ganodermasessile(MG773847)聚为一个分支,亲缘关系较近,紫灵芝、泰芝2、鹿角灵芝聚为一个分支;灵芝1与Ganodermasinese(DQ424990)聚为一个单元;松杉灵芝、灵芝与Ganodermatsugae(DQ425004)聚为一个单元;灵芝2、大灵芝、赤芝聚为一个单元,其中,灵芝2与Ganodermasichuanense(KC662402)聚为一个分支,赤芝与Ganodermaresinaceum(KX371964)聚为一个分支。此外,松杉灵芝、灵芝2、灵芝、大灵芝、赤芝聚为一个大分支,表明菌种之间的亲缘关系较近,紫灵芝、平盖灵芝、泰芝2、灵芝1、鹿角灵芝聚为一个大分支,表明它们之间亲缘关系较近。
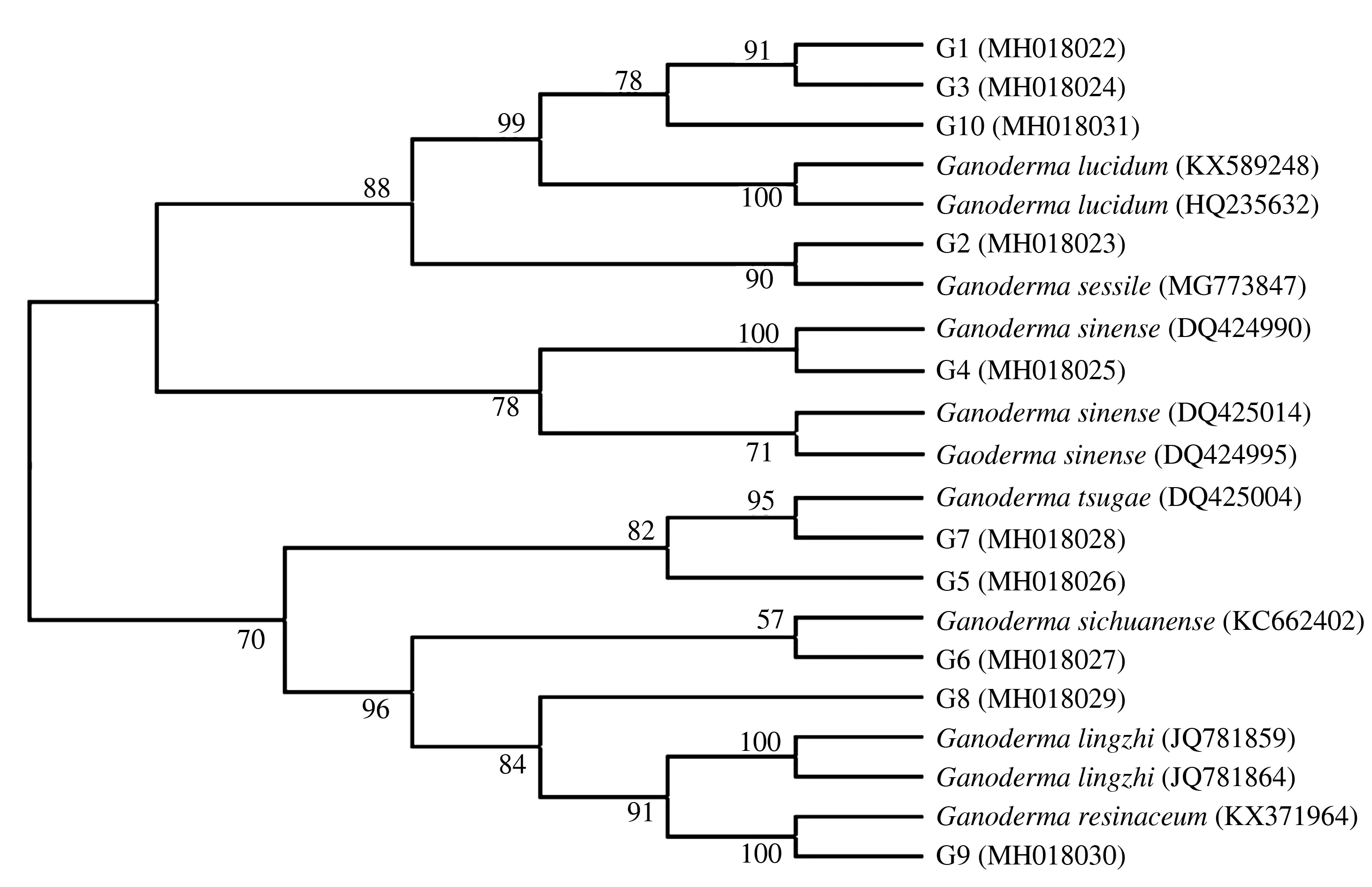
图6 基于ITS序列构建的陕南主栽灵芝菌种系统发育树
3 结论与讨论
我国只对少数种灵芝进行了全面研究,区域栽培种混乱情况极为突出,明确栽培灵芝亲缘关系可有效促进其工业化生产,因此,对栽培灵芝的生物学名及亲缘关系进行研究至关重要。本研究采用固体PDA培养基研究10株菌种的菌落形态和生长速度,灵芝1菌种菌丝生长速度最快,达到(10.56±0.042)mm/d,松杉灵芝菌种次之,达到(9.46±0.135)mm/d,泰芝2菌种生长速度最慢,仅为(4.35±0.016)mm/d,说明陕南地区栽培灵芝的生长速度存在明显差异;采用PDA液体培养基研究菌丝球的颜色、密度、大小等特征,为其液体种的工业生产提供技术参考;拮抗试验表明,菌种赤芝与紫灵芝、泰芝2、鹿角灵芝等菌种间的拮抗反应极强,表明亲缘关系远;基于酯酶同工酶聚类图与ITS序列分析构建的进化树结果基本一致,松杉灵芝、灵芝2、灵芝、大灵芝、赤芝聚为一个大分支,紫灵芝、平盖灵芝、泰芝2、灵芝1、鹿角灵芝聚为一个大分支,表明陕南地区栽培灵芝整体可分为2个大支。
同工酶是真菌细胞基因表达的产物,酯酶同工酶的不同可以直接反映菌种之间的差异,其具有较强的稳定性,已广泛应用于植物、微生物等领域[19-20]。由于灵芝人工栽培种种间基因交流较多,确保研究的稳定性和准确性还需使用rDNA-ITS技术进行鉴定。Dong等[21]采用rDNA-ITS序列对2株疑似灵芝菌种进行了鉴别。Bandh等[22]利用rDNA-ITS分子学技术对采自湖水中的多种真菌进行了鉴定。二者均采用了单一鉴定技术对真菌进行鉴别,而本研究在对陕南地区主栽灵芝进行生长速度测定、液体菌丝形态观察、拮抗反应等生物学特征研究的基础上,结合菌种酯酶同工酶酶谱及rDNA-ITS序列可更加准确和稳定地分析灵芝的亲缘关系,为陕南地区灵芝的育种、生产和保护提供理论依据,同时也为建立栽培灵芝种质资源数据库奠定基础。

