不稳定颈动脉粥样硬化斑块的影响因素分析
冯彩霞, 王孺贤, 乌 兰, 高丽芝, 王增帅
动脉粥样硬化受累动脉多种病变合并存在,可有局部脂质沉积及纤维组织增生、钙质沉着,继发性病变有斑块破裂、斑块内出血、局部血栓形成。粥样硬化斑块分为稳定斑块和不稳定斑块,不稳定斑块与卒中的发生和复发关系密切。本文通过回顾性研究,探讨外周血白细胞、血小板、红细胞及血糖、血脂、胆红素、尿酸与颈动脉粥样硬化斑块不稳定性的关系。
1 对象与方法
1.1 研究对象 选取我院2017年3月1日-2017年12月31日在我院神经科住院的不稳定颈动脉粥样硬化斑块者83例,同期稳定斑块者75例,排除标准:有感染迹象者,空腹血糖≥20.0 mmol/L、尿酸≥500 nmol/L、乳糜血等血脂异常增高者、有严重肝肾功能障碍者、血液系统、肿瘤、免疫系统疾病的患者。该研究的程序符合包头医学院第二附属医院所制定的伦理学标准,并得到该委员会的批准,且取得了受试对象或其亲属的知情同意。
1.2 方 法
1.2.1 一般资料 收录被研究对象一般情况,包括年龄、性别、高血压病史、糖尿病病史、痛风病史等,同时收集被研究对象血常规、纤维蛋白原、生化指标和甲状腺功能3项。生化指标包括总胆红素、直接胆红素、间接胆红素、空腹血糖、甘油三酯(TG)、总胆固醇(TC)、高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C)、载脂蛋白A-Ⅰ(apolioprotein A,apoA-Ⅰ)、载脂蛋白B(apolioprotein B,apoB)、小而密低密度脂蛋白胆固醇(small dense low density lipoprotein,sdLDL)乳酸脱氢酶(lactate dehydrogenase,LDH)、血肌酐、尿酸。甲状腺功能3项包括游离三碘甲状腺素原氨酸(thyoid stimulating hormone,FT3)、游离甲状腺素(free thyroxine,FT4)、促甲状腺素。
1.2.2 颈动脉粥样硬化的判定 预动脉粥样硬化斑块彩超检查采用荷兰飞利浦公司IU22超声诊断仪,探查双侧颈总动脉起始段、中段及分叉部、颈内动脉颅外段,记录颈总动脉及颈内动脉斑块数、斑块形状、大小、表面形态、后面有无声影及声学特征等。 不稳定斑块:内部回声多变,往往呈以低回声为主的混合回声,斑块内的脂质核心部分表现为低回声,斑块内出血表现为无回声,表面不完整的纤维帽表现为斑块表面凹凸不平,部分可见裂隙。有的斑块内可测及少许点状及短棒状血流,提示斑块内有新生血管形成;稳定斑块:斑块内部回声较均匀,无脂质核心的低回声,多数呈均匀的强回声,表面可不规则,但光滑完整。如多发斑块之一为不稳定斑块归为不稳定斑块组。
2 结 果
2.1 两组一般资料比较 两组在年龄、男性、高血压、糖尿病、痛风等比较,均无统计学意义(P>0.05)(见表1)。
2.2 两组血常规、生化资料比较 两组资料中,中性粒细胞数、淋巴细胞数、中性粒细胞与淋巴细胞比值(neutrophil-to-lymphocyte ratio,NLR)、血小板数、血小板分布宽度(platelet distribution width,PDW)、血小板中性粒细胞比值(platelet total-to-neutroplil ratio,PNR)、血糖、HDL-C、LDL-C、apoA-Ⅰ、尿酸等比较,差异有统计学意义(P<0.05)(见表2)。
2.3 颈动脉粥样硬化斑块不稳定性多因素Logistic回归分析 根据上述单因素分析的结果,将中性粒细胞数、淋巴细胞数、血小板数、PDW、PNR、 NLR、血糖、HDL-C、LDL-C、apoA-Ⅰ、尿酸作为自变量,斑块不稳定性作为因变量,进行多因素Logistic回归分析,尿酸(OR=1.010,95%CI1.003~1.016,P=0.004<0.05)、血糖(OR=1.612,95%CI1.067~2.434,P= 0.023<0.05)、PDW(OR=1.321,95%CI1.041~1.676,P= 0.022<0.05)的升高是颈动脉粥样硬化斑块不稳定的独立危险因素。
2.4 绘制ROC曲线 尿酸、血糖、PDW等诊断指标对颈动脉粥样硬化斑块不稳定性的敏感度均较高,但特异性低。将有临床预测价值的指标,作为联合预测指标,通过Logistic回归,形成联合预测因子,联合预测因子=(尿酸+0.278×PDW+0.477×血糖)/0.010,再次构建ROC曲线,并且与单变量观察值的ROC曲线作比较,联合因子的特异性未明显提高,结果(见表3)。
2.5 颈动脉粥样硬化斑块不稳定性的Spearman相关分析 根据单因素分析的结果,将有统计学意义但未列入回归方程中的指标进行Spearman相关分析,P<0.01为相关性显著,NLR(r=0.299,P=0.000<0.01)与颈动脉粥样硬化斑块不稳定性成正相关;PNR(r=-0.280,P=0.002<0.01)与颈动脉粥样硬化斑块不稳定性成负相关;LDH(r=-0.248,P=0.011>0.01)、淋巴细胞数(r=-0.215,P=0.020>0.01)、LDL-L(r=0.198,P=0.034>0.01)、HDL-L(r=-0.193,P=0.039>0.01)、sdLDL(r=0.264,P=0.070>0.01)与颈动脉粥样硬化斑块不稳定性无相关性。
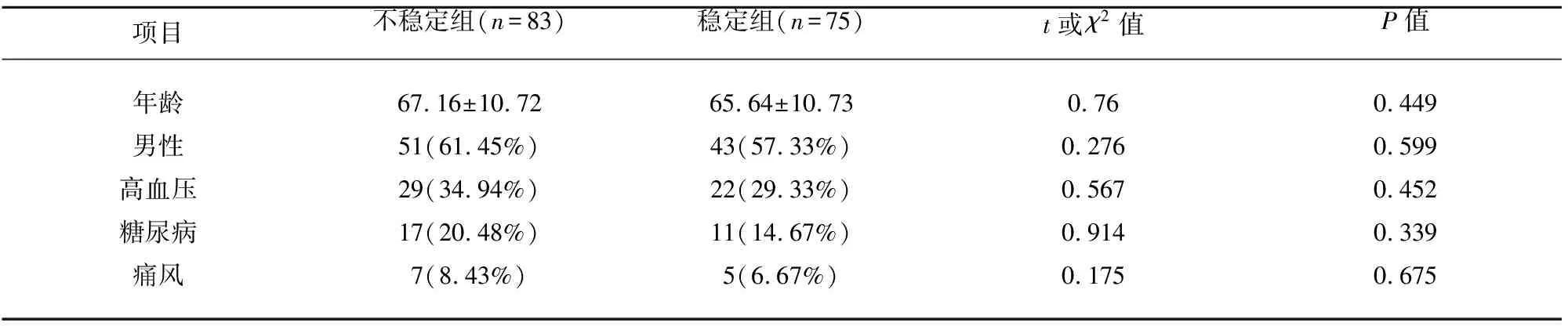
表1 两组一般资料比较
P<0.05具有统计学意义
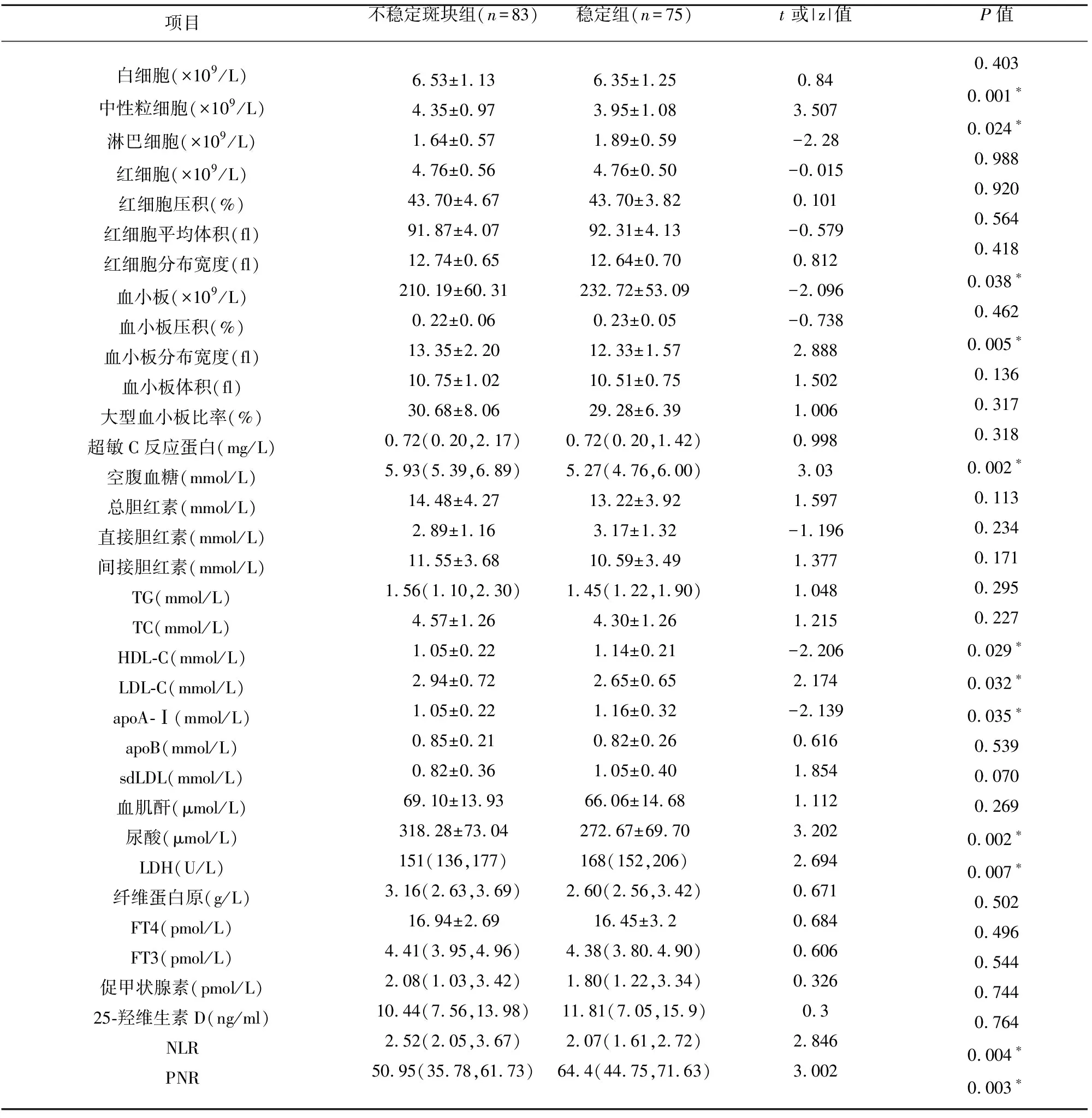
表2 两组血常规、生化等资料比较
*P<0.05具有统计学意义

表3 ROC曲线
*P<0.05具有统计学意义
3 讨 论
PDW是反应血小板激活和释放的指标。任何在血管内皮细胞的过度反应都是导致动脉粥样硬化发展的重要因素,血小板增大说明血小板的活性增强,相比于正常大小的血小板,其与胶原聚合更迅速,产生更多的血栓素A2[1]。本研究PDW是颈动脉粥样硬化斑块不稳定性的独立危险因素。
慢性炎症是动脉粥样硬化发生发展的主要原因,中性粒细胞作为炎症反应的因子,通过募集巨噬细胞并与抗原提呈细胞相互作用,加重炎症反应[2],同时,中性粒细胞分泌炎症介质参与急性组织损伤,活化的中性粒细胞粘附于内皮细胞表面造成内皮功能紊乱,长期炎症导致血管平滑肌增殖、微小血管形成以及随后的动脉硬化[3]。血小板和淋巴细胞是血栓和免疫炎症过程中的主要细胞成分, 激活的血小板可释放多种可溶性介质,参与调控淋巴细胞的激活、增殖以及细胞因子的分泌,进而对动脉粥样硬化的发生、发展发挥重要影响[4]。患者血浆中淋巴细胞总数降低,导致机体的抗炎能力减弱,使低度炎症持久存在[5],故有学者提出淋巴细胞减少与动脉硬化进展相关[6]。血小板数目减少笔者认为与体内血小板消耗增多,及口服抗血小板药物有关。本研究颈动脉粥样硬化斑块不稳定组血小板数及淋巴细胞数均减少。
高水平的血清尿酸促进低密度脂蛋白及胆固醇等脂类的氧化、沉积,使得动脉内膜增厚及氧自由基生成增加,破坏动脉内皮细胞,加速动脉粥样硬化进程[7]。同时尿酸激活血小板凝血系统,进一步促使血栓形成[8]。美国国家心肺和血液研究所进行的一项纳入4866名参与者的大型研究[9],提示血清UA水平越高,动脉粥样硬化越严重。本研究亦得出血尿酸水平升高是颈动脉粥样硬化斑块不稳定性的独立危险因素。
中国成人血脂异常防治指南(2016年修订版)已明确指出,LDL-C或TC升高为特点的血脂异常是动脉粥样硬化性心血管疾病首要的危险因素,降低LDL-C水平,显著减少动脉粥样硬化性心血管疾病的发病、死亡危险,其他类型的血脂异常、TG增高或HDL-C降低与动脉粥样硬化性心血管疾病的发病危险的升高存在关联。本研究颈动脉粥样硬化斑块不稳定组HDL-C出现降低, LDL-C出现升高。
众所周知,糖代谢紊乱是动脉粥样硬化的危险因素之一。高血糖作用血管内皮细胞及血管平滑肌细胞,促进动脉粥样硬化的发生、发展。本研究亦发现高血糖是颈动脉粥样硬化斑块不稳定的独立危险因素。
LDH几乎存在于人体所有组织中,江志奎[10 ]等研究发现动脉粥样硬化兔模型在喂食高胆固醇饲料4 w或12 w时,血清LDH升高与动脉粥样硬化的进程相关。但该研究颈动脉粥样硬化斑块不稳定组LDH明显下降,考虑与该组患者口服他汀类药物较规范导致LDH下降有关,或者有其他笔者未能解释的原因。
通过以上研究,PDW、血糖、尿酸是颈动脉粥样硬化斑块不稳定的独立危险因素。这些指标虽然敏感性高、特异性较低,但获取简单便捷、费用低、可重复性强,值得临床重视和推广。

