惠州沙田水库浮游植物群落特征及演替研究
潘鸿, 杨扬, 唐宇宏
惠州沙田水库浮游植物群落特征及演替研究
潘鸿1, 2, 杨扬2*, 唐宇宏3
1. 遵义医学院公共卫生学院, 遵义 563000 2. 暨南大学水生生物研究中心, 广州 510632 3. 遵义医学院管理学院, 遵义 563000
2009年7月(丰水期)和12月(枯水期)分别对沙田水库4个样点进行浮游植物采集。检测出浮游植物58种(含变种), 隶属7门8纲18目31科46属。丰、枯水期均出现的优势种分别为史氏棒胶藻()、铜绿微囊藻()、微小多甲藻()、小球藻(); 仅在丰水期形成的优势种分别为简单棕鞭藻()、梅尼小环藻()、针形纤维藻()和柯氏并联藻(); 而枯水期形成的优势种分别为分歧锥囊藻()、水溪绿球藻()。丰、枯水期丰度分别为(8.36±1.37)×105cell·L-1和(3.60±1.81)×105cell·L-1; 生物量分别为1.34±0.55 mm3·L-1和0.43±0.43 mm3·L-1; Shannon-Weaver多样性指数变化范围在1.25—2.75之间, 丰、枯水期水质分别为中营养和富营养水平。与2000年结果比较, 浮游植物群落的物种组成由绿藻型更替为绿硅藻型, 丰度组成由蓝-绿藻型更替为绿-蓝-甲藻型; 清洁水体的优势种消失/减少, 耐污种类优势种增加, 其中绿藻优势种存在向小型、单细胞种类更替的趋势。
浮游植物; 群落结构; 演替; 沙田水库
1 前言
浮游植物是水生生态系统中重要的生产者, 在水生生态系统的物质循环和能量流动方面, 以及维持水生生态系统稳定性和完整性方面均起着重要作用[1-2]。而物理、化学、生物等环境因素的改变可以导致浮游植物群落发生演替[1,3-5], 进而影响水生生态系统的物质循环和能量流动, 并改变水生生态系统的稳定性和完整性。
沙田水库为广东省惠州市惠阳区境内的供水水库。在2000年, 王朝晖等[6]研究结果显示其Shannon-Weaver指数()均值为2.58(属中营养水平), 其中枯水期为1.78(属中至富营养水平); 龙思思等[7]调查结果显示总氮浓度在0.16—0.35 mg·L-1之间, 总磷浓度>0.03 mg·L-1, 已接近或达到富营养化的水平。随着城市化、工业化进程加快, 农林业生产全面发展, 大量未经处理的工业废水、农林业和生活污水的直接排放可能加剧其富营养化程度, 进而改变浮游植物群落结构, 导致其发生演替。另外, 全球气候变暖的大背景下, 浮游植物生长加快、物质积累增加以及暖水性物质向两极扩张等[8]均有可能导致沙田水库浮游植物群落发生演替。而浮游植物群落的演替结果又有可能对水库水质管理策略造成一定的影响。为此, 本研究于2009年丰水期(7月)和枯水期(12月)对沙田水库的浮游植物进行采集, 分析其群落结构特征, 并与2000年的研究结果[7,9]比较, 探讨其演替特征或趋势, 以期为沙田水库浮游植物群落的演替研究、水库水质管理策略研究等方面积累相关资料。
2 材料与方法
2.1 水库区域概况
沙田水库始建于1959年, 1962年建成并投入使用, 水库长约2.28 km, 最宽处约1.78 km; 集水面积26.8 km2, 总库容约2.17×107m3; 受亚热带海洋性气候的影响, 全年平均气温约22 ℃, 库区多年平均降雨量为1 767.4 mm, 降水集中在夏秋两季[7,10-11]。
2.2 样点布设及采样时间
在沙田水库大坝(S1)、库心(S2)、河流入库交汇处(S3)和河流中(S4)各设置1个采样点, 共4个采样点(图1)。于2009丰水期(7月)及枯水期(12月)分别对水库的浮游植物进行采样。
2.3 样品采集及处理
定性样品用25号浮游生物网采集于水面下0.5 m处, 并用固定液(甲醛: 丙三醇: 水为1:1:8)现场保存; 定量样品采用改良北原氏采水器采集在相同位置取1 L水样, 加入10 mL鲁戈氏液固定, 室内静置沉淀48 h后采用虹吸法浓缩并定容至30 mL[12]。
定性样品沉淀24 h后, 分别依次取底层沉积物和摇匀后的中间层水样制作临时封片, 在显微镜(Olympus CX31)下观察浮游植物形态特征并结合文献[13—15]描述对浮游植物进行定性鉴定。
定量样品摇匀后取0.1 mL在20 mm×20 mm的计数框内对浮游植物细胞数计数: 先在高倍镜(×40)下采用目镜行格法[12]计数, 再在低倍镜(×10)下对未计数的大型种类进行全片计数; 同一样品镜检3-5次(新检出种类纳入定性统计)。计数结果取均值参照文献[12]的公式计算浮游植物丰度。浮游植物生物量以生物体积计(Biovolume), 即丰度与细胞体积常数乘积; 其中, 细胞体积常数依据显微镜下测量的每种藻类30个细胞(不足30个细胞时全部测量)数据均值参照不同形态体积公式[12,16]计算。
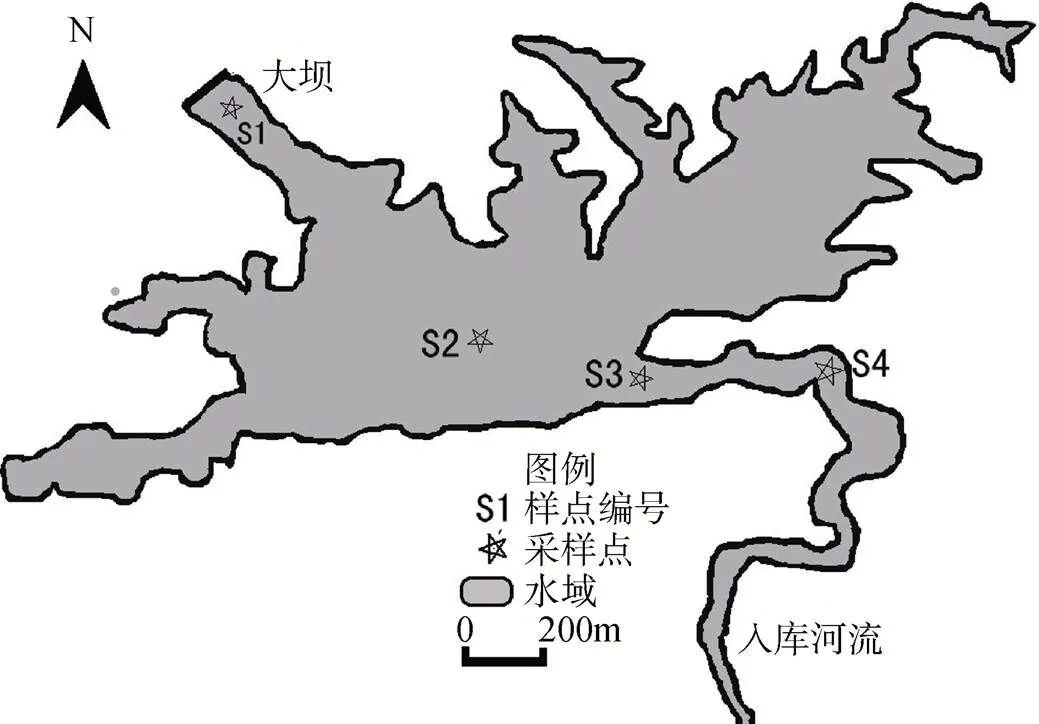
图1 沙田水库浮游植物采样点分布图
2.4 优势种及多样性指数
浮游植物优势种依据Mcnaughton优势度指数(Y)判定[17], 富营养化水平采用Shannon-Weaver指数()[18]判定, 其计算公式分别如下:
Y=F×P (1)
-å(N/)Ln(N/) (2)
式中:F和P分别为物种出现的频率(出现样点数/总采样点数)及其相对丰度(物种平均丰度/总的平均丰度);N和分别为属的丰度和总丰度。优势种的判定标准为Y>0.02[17]; 富营养化评价标准为: 0—1为超/重富营养, 1—2为富营养, 2—3为中营养, >3为贫/弱营养[18]。
3 结果
3.1 种类组成及优势种
室内初步检出浮游植物共58种(含变种), 分属7门8纲18目31科46属。其中, 绿藻、硅藻、蓝藻和甲藻分别为25、16、6和5种, 占总种数的43.10%, 27.59%、10.34%和8.62%; 其余各门均不足5种(表1)。
浮游植物优势种共10种, 其中史氏棒胶藻((R. et F. Choda) Komarek), 铜绿微囊藻(Kützing), 微小多甲藻((Pen.) Lemm.)和小球藻(Beijerinck)在丰、枯水期均能形成优势; 仅在丰水期形成的优势种包括简单棕鞭藻(Pascher.), 梅尼小环藻(Kützing), 针形纤维藻((A. Braun) Korschikoff)和柯氏并联藻((Tann.-Fullm.) G. M. Smith.); 仅在枯水期形成的优势种包括分歧锥囊藻(Imhof)和水溪绿球藻((Schrank) Meneghini)。
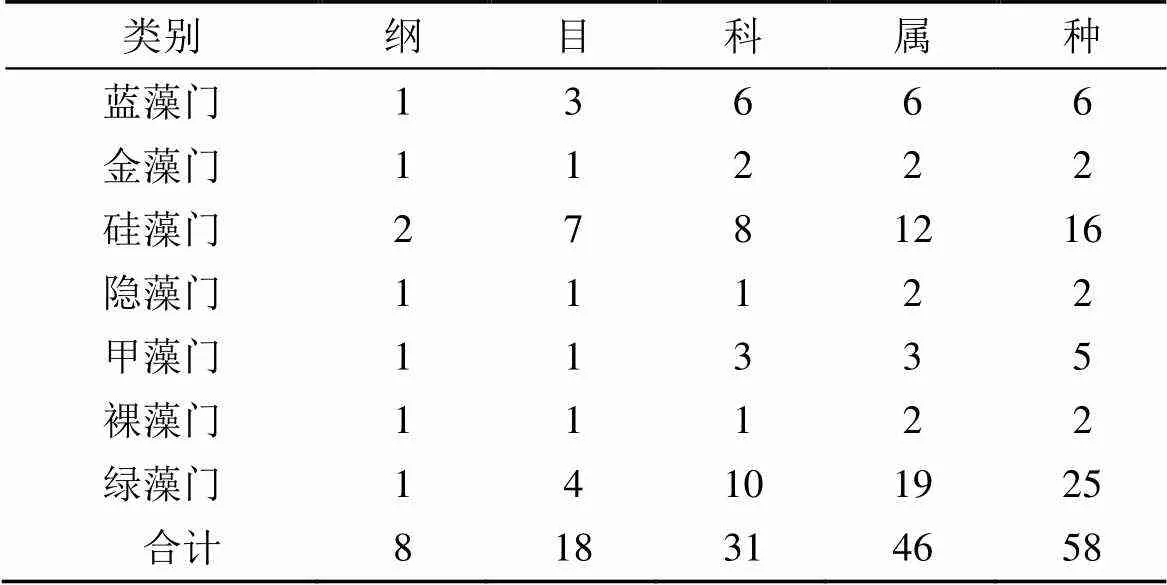
表1 沙田水库浮游植物组成
3.2 丰度及生物量
沙田水库丰水期和枯水期的浮游植物丰度分别为(8.36±1.37)×105cell·L-1和(3.60±1.81)×105cell·L-1; 丰水期以绿藻居多、其余依次为甲藻、蓝藻、金藻和其他(图2), 其均值分别占39.86%, 23.71%, 14.69%, 10.98%和10.79%; 枯水期则以蓝藻居多, 其余依次为甲藻、绿藻、金藻和其他(图2), 其均值分别占39.41%, 32.93%, 13.09%, 12.77%和1.80%。
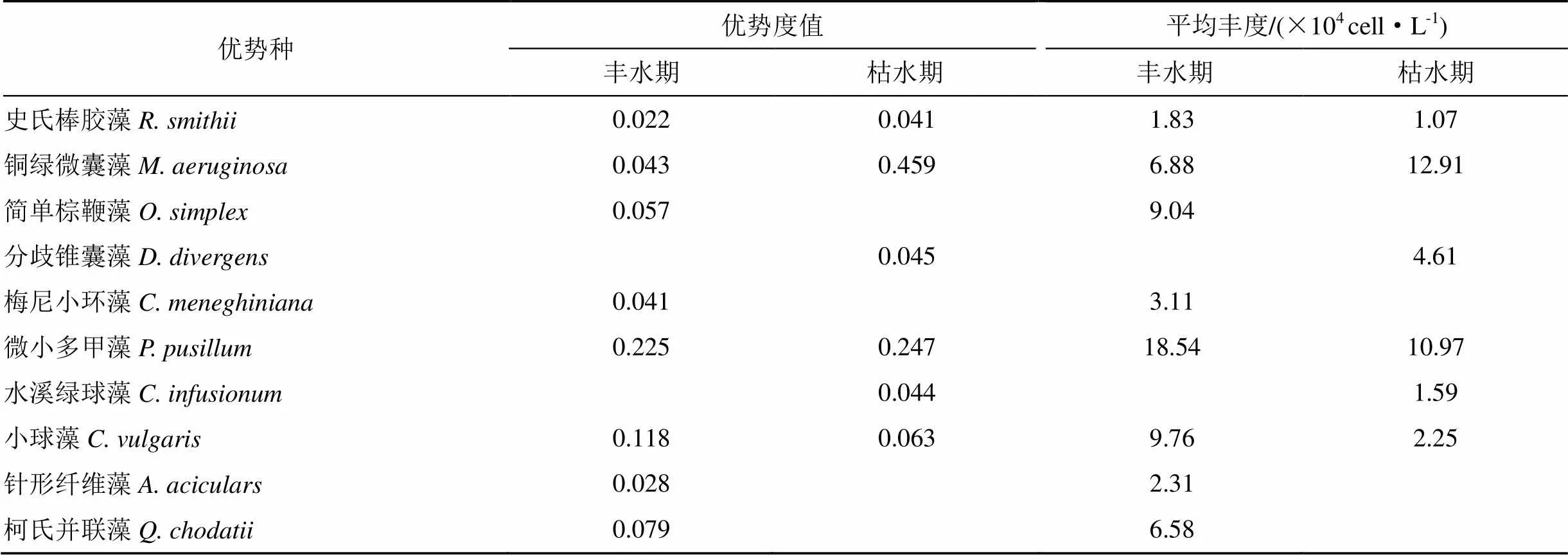
表2 沙田水库浮游植物优势种
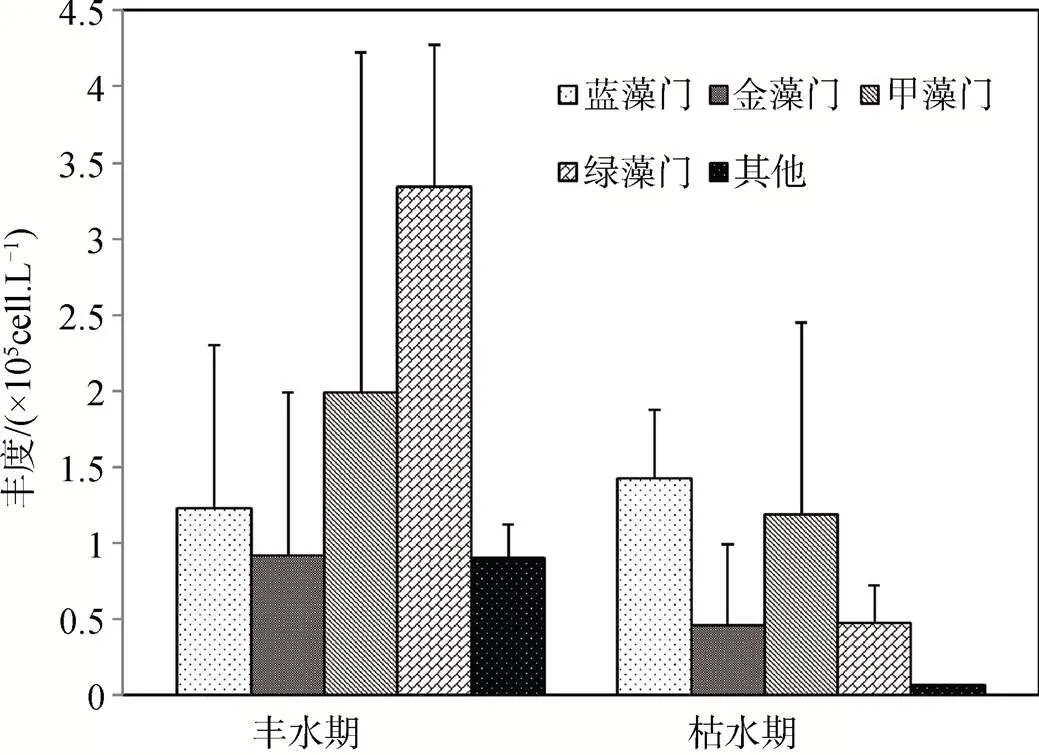
图2 沙田水库浮游植物丰度(×105 cell·L-1)组成
丰水期和枯水期的浮游植物生物量分别为1.34±0.55 mm3·L-1和0.43±0.43 mm3·L-1; 丰水期以甲藻居多、其次为绿藻(图3), 分别占52.19%和30.33%; 枯水期则以甲藻居多(图3), 占83.65%。
3.3 Shannon-Weaver指数及富营养化评价
入库河流丰、枯水期的Shannon-Weaver指数分别为2.75和1.25(以S3和S4采样点各属的浮游植物丰度均值计算); 水库丰、枯水期的Shannon-Weaver指数分别为2.08和1.56(以S1和S2采样点各属的浮游植物丰度均值计算)。在丰水期, 入库河流及水库的Shannon-Weaver指数均在2.00—3.00之间, 表明入库河流及水库均为中营养水平; 而枯水期的Shannon-Weaver指数均在1.00—2.00之间, 表明入库河流及水库均为富营养水平。

图3 沙田水库浮游植物生物量(mm3/L)组成
4 讨论
沙田水库2009年检出的浮游植物共58种(含变种), 比2000年检出的物种数(不足50种[7,9])相比, 物种数有所增加(主要为硅藻)而门类有所降低(未检出黄藻门种类)(表3)。尽管调查者的分类能力、样品保存方法和检测技术等不同可能造成稀有物种被检出的可能性存在较大差异而引起浮游植物物种丰富度的改变[5], 但对于优势种而言, 此类影响几乎可以忽略。2000年出现的某些优势种, 如蓝藻门的粘球藻(spp.)和黄藻门的葡萄藻(Kütz)在2009年的样品中均未检出(表4), 似乎表明浮游植物物种组成的变化极可能是因为沙田水库环境中的物理、化学或生物因子[5]改变所致。
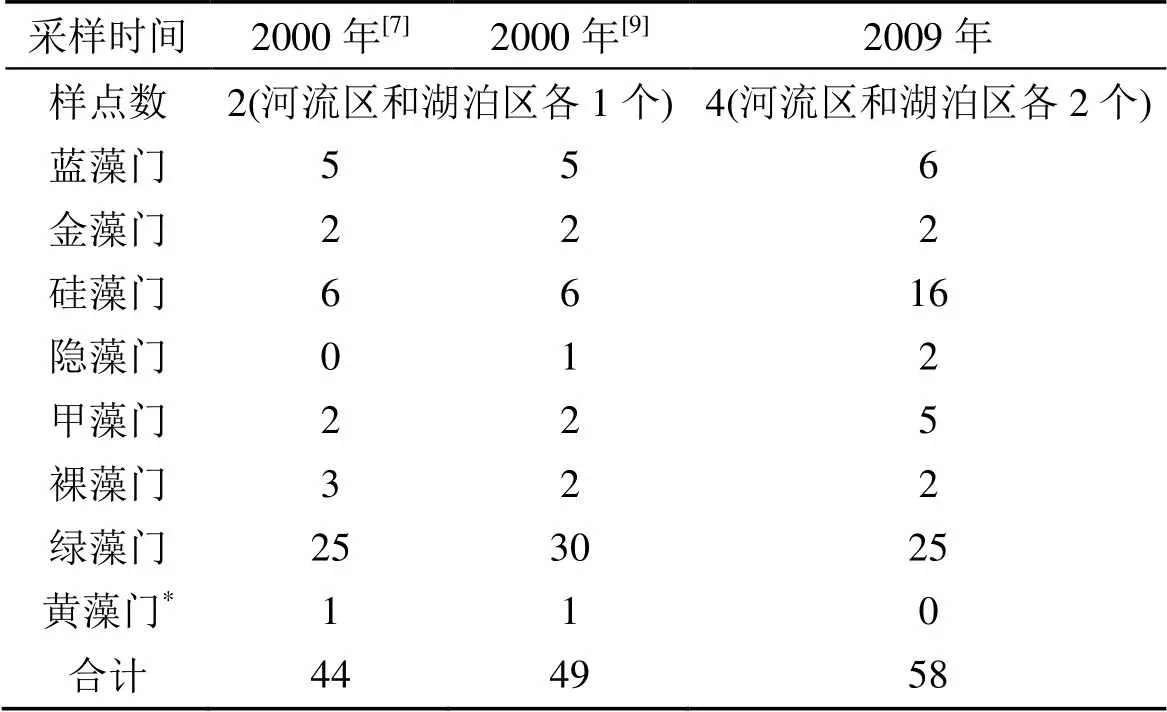
表3 2000年和2009年沙田水库浮游植物种类组成比较
*: 龙思思等, 胡韧等均将从粒藻/布朗葡萄藻(Kütz)作为绿藻报道, 而胡鸿钧等[6]将其修订的为黄藻门的种类。

表4 2000年和2009年沙田水库浮游植物优势种比较
*: “▲”和“☆”分别表示丰水期和枯水期
优势种通常是对环境条件最为适应的物种, 能够在一定程度上反映环境现状[1,3]。沙田水库2000年和2009年的浮游植物分别具有为9和10个优势种属(表4), 其中仅棒胶藻属()、微囊藻属()和小环藻属()等3个种属相同, 而多数优势种属发生了更替。尽管有研究表明, 全球变暖会导致喜暖水的物种分布范围向两级扩展, 而喜冷水的物种则分布范围缩小[19]; 而且1℃的变化可导致物种的生态区范围增加160 km[20]; 同时, 温度的升高有利于浮游生长加快[21], 可以促使得浮游植物优势种发生更替[22]。但是2000年至2009年期间, 全球温度升高仅约0.05 ℃[23], 远低于沙田水库丰、枯水期之间的温度变化幅度; 而2009年有4种藻类作为优势种同时出现在丰、枯水期的浮游植物群落中, 因此认为, 全球气候变暖并非导致沙田水库浮游植物优势种更替的主要因素。黄藻门中喜清洁水体的葡萄藻()[7]在水库中消失, 而金藻门中适应富营养化程度较高环境的简单棕鞭藻()和分歧锥囊藻()在水库中形成优势, 似乎表明沙田水库浮游植物群落的演替是由于水体富营养化程度增加所致(Shannon-Weaver指数评价的富营养水平高于2000年[6-7])。另外, 绿藻门的优势种由较为大型的多细胞种类向小型的单细胞种类更替, 似乎也佐证了水体富营养化程度的增加是导致沙田水库浮游植物群落演替的主要原因, 因为小型单细胞种类比大型多细胞种类具有更大的体积/表面积比, 更有利于在营养盐利用的竞争中占据优势[1]。
沙田水库在2000年丰、枯水期浮游植物丰度组成差异极为明显: 2000年丰水期以蓝藻和绿藻为主, 枯水期以蓝藻占绝对优势; 而2009年丰水期以绿藻和甲藻为主, 枯水期以蓝藻和甲藻占优势(图2)。适应富营养程度较高环境中生长的甲藻门种类的丰度增加, 且在丰、枯水期均能形成优势种, 也从另一个侧面说明沙田水库浮游植物群落演替与水体的富营养化程度加剧有关。沙田水库2000年丰、枯水期的浮游植物丰度分别为7.84×105cell·L-1和1.31×106cell·L-1[6](与龙思思等[7], 胡韧等[9]研究结果图中的数值相似), 与 2009年相比, 丰水期差异较小(2009年均值为8.36×105cell·L-1), 而枯水期差异相对较大(2009年均值为3.60×105cell·L-1), 推测可能是因为高温条件下(丰水期)的全球气候变暖产生的升温幅度相对较低, 从而使得摄食者对浮游植物的下行控制(top-down control)效应[24]增强程度弱于较低温度下(枯水期)的升温影响所致, 这尚待进一步的研究证实。
综上所述, 2000年和2009年沙田水库浮游植物群落无论在物种丰富度、优势种及其构成、丰度及其构成等方面均存在明显的差异, 表明近10年时间内沙田水库的浮游植物群落产生了演替: 种类组成由绿藻型更替为绿-硅藻型; 丰度组成由蓝-绿藻型更替为蓝-绿-甲藻型; 清洁水体的优势种消失/减少, 而耐污种类的优势种增加, 其中绿藻优势种存在向小型、单细胞种类更替的趋势。
[1] REYNOLDS C S. The Ecology of Phytoplankton[M]. Cambridge: Cambridge University Press, 2006: 1–435.
[2] 潘鸿, 杨扬, 陶然, 等. 水质改善的浮游植物群落演替机制模拟研究[J]. 环境科学学报, 2013, 33(12): 3309–3316.
[3] ODUM E P, BARRETT G W.生态学基础(第五版)[M]. 北京: 高等教育出版社, 2009: 254–335.
[4] 刘建康, 黄祥飞, 林婉莲, 等. 东湖生态学研究[M]. 北京: 科学出版社, 1995: 63–226.
[5] KALFF J. 湖沼学[M]. 北京: 高等教育出版社, 2011: 367–418.
[6] 王朝晖, 韩博平, 胡韧, 等. 广东省典型水库浮游植物群落特征与富营养化研究[J]. 生态学杂志, 2005, 24(4): 402–405.
[7] 龙思思, 林秋奇, 胡韧, 等. 粤东三个中型水库富营养化特征分析[J]. 生态科学, 2002, 21(2): 126–130.
[8] 孙军, 薛冰. 全球气候变化下的海洋浮游植物多样性[J]. 生物多样性, 2016, 24(7): 739–747.
[9] 胡韧, 林秋奇, 王朝晖, 等. 广东省典型水库浮游植物组成与分布特征[J]. 生态学报, 2002, 22(11): 1939– 1944.
[10] 陈修康, 张华俊, 顾继光, 等. 惠州市3座供水水库沉积物重金属污染特征[J]. 应用生态学报, 2012, 23(5): 1254– 1262.
[11] 惠州市惠阳区沙田镇人民政府. 沙田水库[EB/OL]. [2015-08-11]. http: //shatian.huiyang.gov.cn/stgk/zrhj/4630117.shtml
[12] 章宗涉, 黄祥飞. 淡水浮游生物研究方法[M]. 北京: 科学出版社, 1995: 333–344.
[13] 胡鸿钧, 魏印心. 中国淡水藻类: 系统、分类及生态 [M]. 北京: 科学出版社, 2006: 1–915.
[14] JOHN D M, WHIRRON B A, BROOK A J. The Freshwater Algal Flora of the British Isles[M]. Cambridge: Cambridge University Press, 2002: 1-612.
[15] WEHR J D, SHEATH R G. Freshwater Algae of North America: Ecology and Classification[M]. New York: Acacemic Press, 2003: 1-773.
[16] OLENINA I, HAJDU S, EDLER L, et al.Biovolumes and size-classes of phytoplankton in the baltic sea[J]. Helcom Balt Sea Environ Proc, 2006, 106: 1-21.
[17] 郭坤, 杨德国, 彭婷, 等. 湖北省长湖浮游植物优势种生态位分析[J]. 湖泊科学, 2016, 28(4): 825-834.
[18] 潘鸿, 唐宇宏. 草型浅水湖泊富营养化评价的浮游植物指标比较[J]. 安徽农学通报, 2016, 22(03-04): 67-69.
[19] HAYS G C, RICHARDSON A J, ROBINSON C. Climate change and marine plankton[J]. Trends Ecol Evol, 2005, 20(6), 337–344.
[20] THUILER W. Climate change and the ecologist[J]. Nature, 2007, 448(7153), 550–552.
[21] WINDER M, SOMMER U. Phytoplankton response to a changing Climate[J]. Hydrobiologia, 2012, 698, 5–16.
[22] 张欢, 张佳磊, 刘德富, 等. 三峡水库水温对浮游植物群落演替和多样性的影响[J]. 环境工程技术学报, 2017, 7(2): 134–139.
[23] IPCC Working GroupⅠContribution to AR5. Climate Change 2013: The Physical Science Basis (Summary for Policymakers) [R/OL]. [2013-10-02]. http: //www.climatechange2013.org/images/report/WG1AR5_SPM_FINAL.pdf.
[24] SOMMER U, LEWANDOWSKA A. Climate change and the phytoplankton spring bloom: warming and overwintering zooplankton have similar effects on phytoplankton[J]. Global Change Biol, 2011, 17(1): 154– 162.
Characteristics and succession of phytoplankton community in Shatian Reservoir, Huizhou
PAN Hong1,2, YANG Yang2*, TANG Yuhong3
1. School of Public Health, Zunyi Medical College, Zunyi 563000, China 2. Institute of Hydrobiology, Jinan University, Guangzhou 510632, China 3. School of Management, Zunyi Medical College, Zunyi 563000, China
The samples of phytoplankton from 4 sites of Shatian Reservoir, Huizhou were collected in wet (July) and dry (December) periods of 2009. A total of 58 species and subspecies of phytoplankton were identified, belonging to 7 Phyla, 8 Classes, 18 Orders, 31 Families and 46 Genera. The,,andwere appeared in wet and dry periods as the dominant species. The,,andwere appeared in wet period as the dominant species. Theandwere appeared in dry period as the dominant species. The abundances in the wet and dry periods were (8.36±1.37)×105cell·L-1and(3.60±1.81)×105cell·L-1, respectively. The biovolume in the wet and dry periods was 1.34±0.55 mm3·L-1and 0.43±0.43 mm3·L-1, respectively. The range of Shannon-Weaver index was from 1.25 to 2.75. The water quality was moderate eutrophic and eutrophic level in wet and dry periods of Shatian Reservoir, respectively. Compared with the data of 2000, the species composition of Chlorophyta type was replaced by Chloro-Bacilariophyta type, and the abundance composition of Cyano-Chlorophyta type was replaced by Chloro-Cyano-Dinophyta type. The dominant species of clean water were disappeared or decreased, while the pollution tolerant species as dominant species. The dominant species of Chlorophyta had replaced tendency by smaller and unicellular species.
phytoplankton; community structure; succession; Shatian reservoir
10.14108/j.cnki.1008-8873.2018.04.019
Q145
A
1008-8873(2018)04-154-06
2017-08-24;
2017-10-01
广东省联合基金(U1501235)资助
潘鸿(1975—), 男, 贵州遵义人, 博士, 副教授, 主要从事藻类学、生态学、环境卫生学研究, E-mail: ph-tian999@163.com
杨扬, 女, 博士, 教授, 主要从事环境工程, 环境生态修复研究, Email: yangyang@scies.org
潘鸿, 杨扬, 唐宇宏, 等. 惠州沙田水库浮游植物群落特征及演替研究[J]. 生态科学, 2018, 37(4): 154-159.
PAN Hong, YANG Yang, TANG Yuhong, et al. Characteristics and succession of phytoplankton community in Shatian Reservoir, Huizhou[J]. Ecological Science, 2018, 37(4): 154-159.

