黄连体内黄连素的组织器官定位和根尖屏障结构特征研究
胡露洁 王晓娥 杨小林 杨朝东 张霞
摘 要: 黃连(Coptis chinensis)是毛茛科著名药材,该文研究了黄连体内黄连素在组织器官中的分布规律和根尖屏障结构特征。在白光和荧光显微镜下,组织器官中黄连素在蓝色激发光下自发黄色荧光,黄连素-苯胺兰对染研究细胞壁凯氏带和木质化,苏丹7B染色栓质层,间苯三酚-盐酸染色木质化。结果表明:黄连不定根初生结构为维管柱、内皮层、皮层、外皮层和表皮组成;次生结构以次生木质部为主、次生韧皮部和木栓层组成。黄连根茎初生结构由角质层,皮层和维管柱组成;次生结构由木栓层、皮层和维管柱组成,以皮层和维管柱为主。叶柄结构为髓、含维管束的厚壁组织层、皮层和角质层。黄连不定根的屏障结构初生结构时期由栓质化和木质化的内皮层、外皮层;次生结构时期为木栓层组成;根状茎的为角质层和木栓层。黄连素主要沉积分布在不定根和茎的木质部,叶柄的厚壁组织层,木质部和厚壁组织是鉴别黄连品质的重要部位。黄连根尖外皮层及早发育,同时初生木质部有黄连素沉积结合,可能造成水和矿质吸收和运输的阻碍,也是黄连适应阴生环境的重要原因。
关键词: 黄连, 黄连素, 解剖结构, 组织化学
中图分类号: Q944.5
文献标识码: A
文章编号: 1000-3142(2018)02-0260-09
Location of berberine and development of apoplastic barriers on Coptis chinensis anatomcal structure
HU Lujie, WANG Xiaoe, YANG Xiaolin, YANG Chaodong, ZHANG Xia*
( Engineering Research Center of Ecology and Agriculture Use of Wetland, Ministry of Education, Yangtze University, Jingzhou 434025, Hubei, China )
Abstract: Goldthread (Coptis chinensis) is a famous medicinal plant in Ranunculaceae. We studied berberine locate in tissue and organ features, and apoplastic barriers developed in adventitious roots and rhizomes, and anatomic structures of adventitious roots, rhizmoes and petioles in different development stages. All samples were collected from Lichuan farmland, Hubei Province. We carried out the cell wall histochemistry under light and epifluorescence microscope, and the berberine in organ and tissue fluoresced yellow under blue exciting light that was refered as berberine hemisulfate-aniline stain for lignin which combine with lignin and fluoresce stronger yellow, berberine hemisulfate-aniline stain for Casparian bands fluoresced vivid yellow, and lignin fluoresced stronger yellow. Sudan red 7B stain for suberin showed reddish. Phloroglucinol-HCl stain for lignin showed cherry reddish. Primary structure of goldthread adventitious roots compose of vascular cylinder, endodermis, cortex, exodermis and epidermis; secondary structure compose of secondary xylem, secondary phloem and phellem. Primary structure of rhizomes compose of cuticle, cortex and vascular cylinder; secondary structure compose of phellem, cortex and vascular cylinder. Petioles compose of pith, sclerenchyma rings with vascular bundles, cortex and cuticle. The apoplastic barriers in adventitious roots compose of endodermis and exodermis; and endodermis, exodermis and phellem present in same development stages; and phellem in secondary structure. The apoplastic barriers in rhizmoes compose of cuticle in young stage, and phellem in age stage. Berberine deposite on primary xylem and secondary xylem of adventitious roots and rhizmoes, and on sclerenchyma rings of petioles. Xylem and sclerenchyma rings are important for medicinal quality of goldthread. Exodermis develop early and berberine anchor in primary xylem to root tips, which may prevent water and mineral to absorbing and transporting in goldthread adventitious root. The endodermis and exodermis and phellem of apoplastic barriers totally restrict water and mineral that transport in adventitious roots, among which only very few surface of root tips can absorb water and mineral; and berberine deposit and block up the xylem that result in slowing down of water and mineral transport, which explains why goldthread growth is very slow and need 5-6 years to harvest. These structure characteristics maybe the reasons for goldthread adapting to shade environment.
Key words: Coptis chinensis, berberine, anatomical structure, histochemistry
黄连(Coptis chinensis)为毛茛科著名多年生药用植物,在我国主要分布于西南和中南地区的山地丘陵(赵楠等,2015),在现代医药具有很高的价值(王宪楷等,1964;肖培根,1984;张莉和张小平,2006;Kamath et al,2009)。黄连喜阴湿生长环境,忌高温、干旱和强光,生长速度缓慢,对栽培环境条件要求苛刻。黄连的不定根、根茎和叶的解剖结构研究(杨建民和唐红光,1994;袁王俊等,2007),和结合组织化学方法研究黄连素在体内的积累和分布(Cromwell, 1933;Greathouse & Watkins,1938;王宪楷等,1959;鲁高莲和胡正海,1994)。王宪楷等(1959)采用生物碱的显色反应来观察黄连根茎中黄连素的分布以及不同年龄的根茎黄连素的含量;鲁高莲和胡正海(1994)应用碘化汞钾处理黄连根茎,使黄连素形成晶体便于光学显微镜下观察,研究黄连根茎中黄连素的分布和积累规律,这些黄连素积累和分布的研究方法和结果存在不同意见。
随着现代荧光显微镜的广泛使用和现代植物解剖学的研究新进展(Brundrett et al,1988;杨朝东和张霞,2013;Yang et al,2011,2014),黄连素作为荧光染色剂,在植物组织中极易与木质化细胞壁结合,受激发后发出黄色荧光;黄连素与苯胺兰对染,凯氏带呈现生动黄色(Brundrett et al,1988;杨朝东和张霞,2013;Yang et al,2011,2014)。黄连素在DNA琼脂糖凝胶电泳中可作为荧光增强剂替代具致癌的EB使用(Gong et al,1999;杨全玉等,2008),减少环境污染。此外,硫酸氢黄连素溶液用作检验植物屏障结构通透性的示踪物质或者离子示踪物,与KSCN溶液结合成不溶于水的晶体并发出黄色荧光(Meyer et al,2009;杨朝东和张霞,2013;Yang et al,2014)。
植物根中屏障结构由内、外皮层初生壁的凯氏带,次生壁栓质化和木质化组成,调节植物与环境的水和矿质离子交换的重要结构(杨朝东等,2013)。近年来研究湿地植物的屏障结构对湿地环境的适应性引起了人们的关注(Soukup et al,2007;Yang et al,2014),而对阴生植物如黄连却缺乏研究(杨建民和唐红光,1994;袁王俊等,2007)。现有可靠的细胞壁组织化学研究方法,例如硫酸氢黄连素-苯氨兰对染,凯氏带在蓝色荧光下呈生动黄色,木质化胞壁呈呆滞黄色(Brundrett et al, 1988),胞壁木栓质在蓝色激发光下呈现棕色(Schreiber & Franke,2011;张霞等,2013;Yang et al,2014);苏丹红7B染色胞壁木栓质为红色(Brundrett et al,1991);盐酸-间苯三酚染色胞壁木质素为樱桃红色,初生壁凯氏带经浓硫酸消化后呈波浪形(Jensen,1962)。因此,作者试图利用黄连素在荧光显微镜的蓝色激发光下发黄色荧光的光学性质,从黄连素在黄连体内沉积部位以及根系时空发育等方面,探讨是否因为其自身结构与生理或者黄连素的沉积结合等原因而导致其生长缓慢和栽培环境要求高,对今后改善黄连栽培措施提供科学依据。
1 材料与方法
本实验材料于2014年11月采集湖北利川市箭竹溪野生和栽培植株,用自来水洗净,保留完整的植株根系,干燥或酒精侵泡保存待用。在实验室取完整不定根长75 mm左右,切取幼和老根茎,具4~5个节,以及叶柄中部小段置于蒸馏水中,试验重复5次。在可调节放大倍数的解剖镜下,用双面刀片切片距根尖10、20、30、40、50 mm和三年生根基部;茎第一节间和第四节间,叶柄中部分别切片。
黄连素荧光定位结构部位研究实验原理:黄连素染色的切片,如果植物组织木质化细胞壁牢固结合了黄连素,在荧光显微镜的蓝色激发光下,黄连素释放黄色荧光。将黄连不同组织器官切片,不染色,滴加蒸馏水、盖片在蓝色激发光下观察,根据荧光强度确定黄连素在黄连不同组织结构的沉积和分布状况(Brundrett et al,1988)。
不定根尖屏障结构组织化学研究,根尖切片,75%浓硫酸处理10 min左右,观察初生壁凯氏带呈波浪形。盐酸-间苯三酚染色切片的木质化胞壁为樱桃红色(Jensen,1962)。采用0.1% (w/v) 硫酸氫黄连素和0.5% (w/v) 苯氨兰对染切片观察初生壁凯氏带和次生壁木质化,在荧光显微镜下凯氏带呈现生动黄色, 木质化细胞壁呈现呆滞黄色(Brundrett et al,1988)。用0.1% (w/v)苏丹红7B溶液染色切片确定细胞壁栓质化呈现红色(Brundrett et al,1991),并拍照记录实验结果。
2 结果与分析
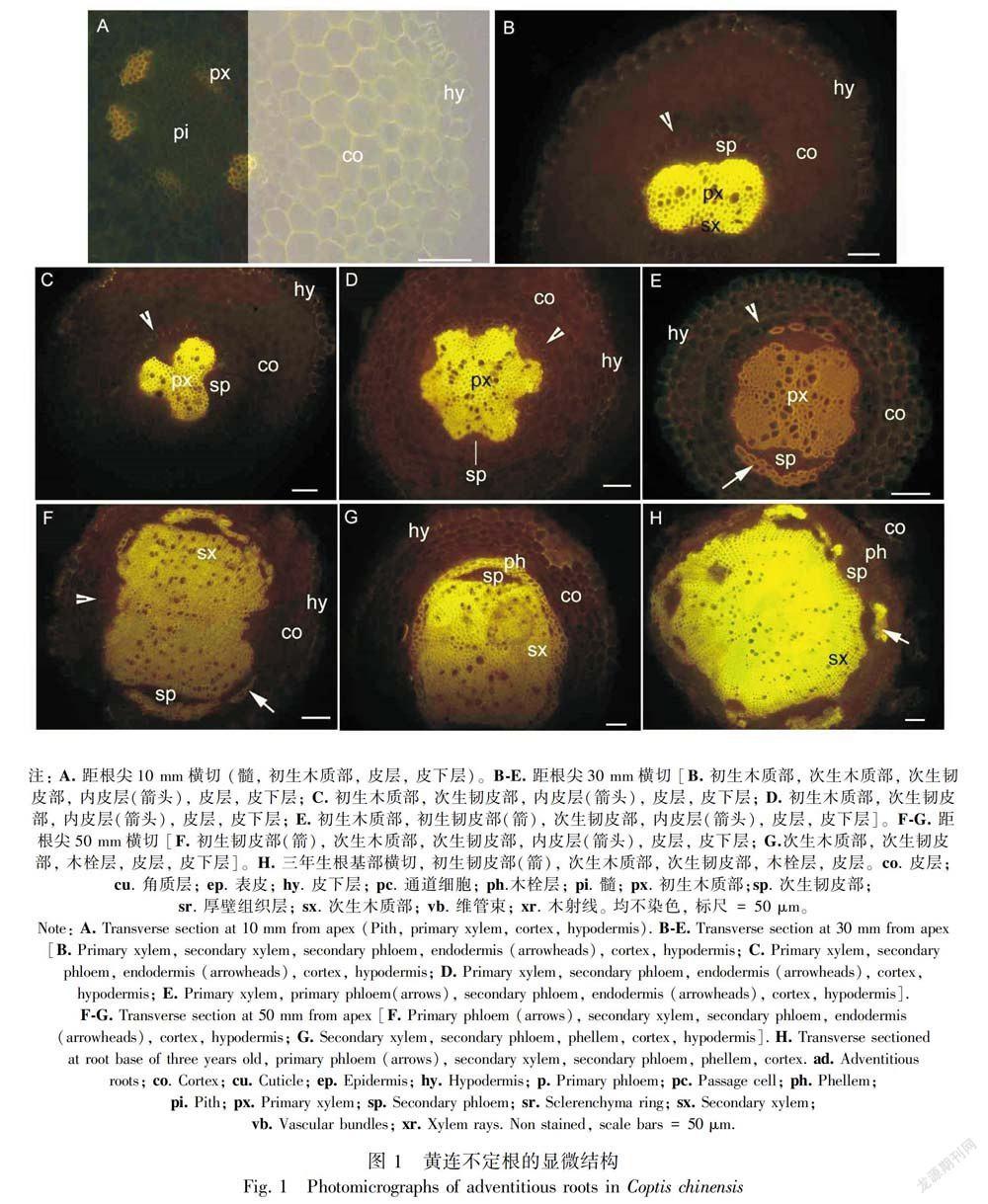
2.1 黄连不定根中黄连素沉积分布的结构特征
黄连不定根切片不经任何染色剂染色,在荧光显微镜蓝色激发光下,木质部发出强烈黄色荧光,不定根解剖结构由外而内依次可分辨为皮下层、皮层、木质部和髓,初生木质部为二、三、四、五和六元型(图1:A,B,C,D,E)。距不定根尖10 mm,初生木质部开始发出较强黄色荧光,其余结构具微弱荧光(图1:A)。距黄连根尖30 mm,木质部具次生结构并发出强烈黄色荧光(图1:B,C,D,E),初生韧皮部细胞壁也具强烈黄色荧光(图1:E);内皮层和皮下层具凯氏带细胞壁发出明显黄色荧光,皮下层具凯氏带(图1:B,C,D,E),其余结构也有弱的黄色荧光,不定根皮层在此发育阶段保持完整状态。
距不定根尖50 mm,次生木质部发出强烈黄色荧光,木栓层开始出现并发出强烈黄色荧光,甚至第二年不定根皮层还保持完整(图1:F, G),皮层等结构的细胞壁具弱的黄色荧光。三年生不定根基部,主要结构为次生木质部并具强烈黄色荧光,初生韧皮部也具强烈黄色荧光,木栓层具相对较强黄色荧光;次生韧皮部细胞壁具相对较暗荧光,推测无黄连素沉积,部分皮层细胞开始破坏(图1:H)。
黄连不定根在发育过程中,黄连素主要沉积分布在初生木质部、次生木质部、初生韧皮部和木栓层,其次是皮层薄壁组织有少量黄连素存在,次生韧皮部荧光最暗几乎无黄连素沉积。
2.2 黄连根茎和叶柄中黄连素积累分布的结构特征
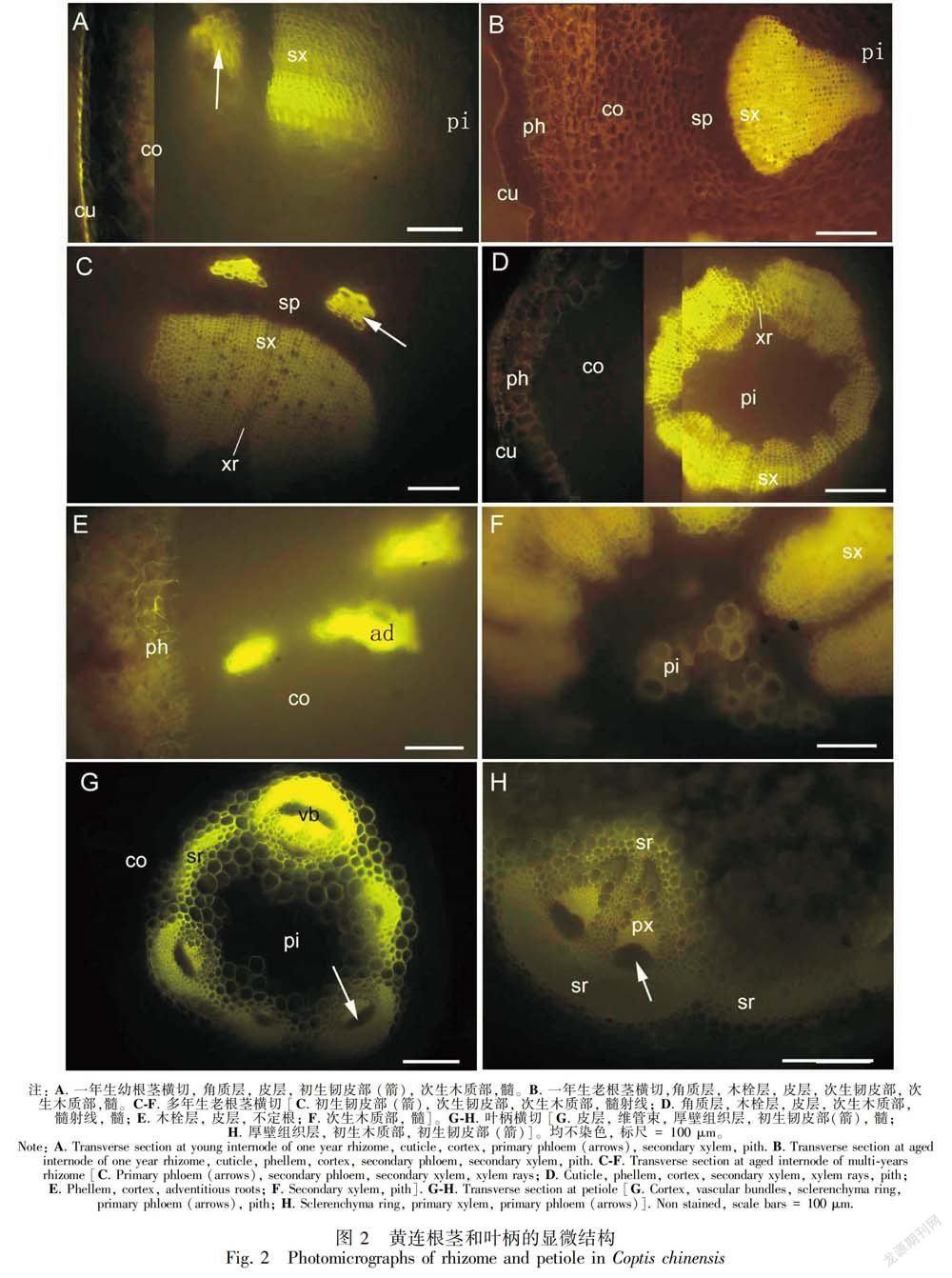
黄连根茎切片不经任何染色剂染色,在荧光显微镜蓝色激发光下,一年生黄连根茎自外向内依次可识别为角质层、木栓层、皮层、初生韧皮部、次生韧皮部、次生木质部和髓构成。黄连素主要沉积分布于木质部而且荧光最强,其次是初生韧皮部,再次是角质层和木栓层,皮层和髓荧光极弱;次生韧皮部最暗,可能无黄连素积累(图2:A,B)。一年生老根茎中,表皮下具木栓层,皮层细胞壁荧光较强(图2:B)。
多年生黄连老根茎解剖结构由外向内依次由角质层、木栓层、皮层(皮层具不定根穿过)、初生韧皮部、次生韧皮部、环状次生木质部和髓组成,后期木栓层细胞层数增加和角质层脱落。初生韧皮部,次生木质部和不定根荧光最强, 其次是髓,角质层和木栓层,再次是皮层等薄壁组织的细胞壁荧光最弱,次生韧皮部和形成层几乎无荧光(图2:C,D,E,F)。黄连根茎中,黄连素主要积累在木质部、不定根和初生韧皮部,其次在角质层、木栓层和髓中,皮层薄壁组织中最少,可能次生韧皮部和形成层无黄连素。
黄连叶柄主要结构组成为角质层、皮层、含5个左右维管束的厚壁组织层,内部为髓(图2:G,H),图中未显示角质层。含维管束的厚壁组织层具强烈荧光(韧皮部除外),皮层和髓的荧光弱,表明叶柄中黄连素主要积累在含维管束的厚壁组织层,其次是皮层和髓。
黄连根茎解剖结构由角质层、木栓层、皮层及其具不定根穿过、初生韧皮部、次生韧皮部、初生木质部、次生木质部具木射线和髓组成,根茎完全老化后角质层脱落。黄连素主要沉积分布在根茎的木质部,皮层不定根和初生韧皮部,角质层和木栓层次之,皮层和髓细胞最弱。黄连叶柄主要结构为含维管束的厚壁组织层,其内为髓,其外为皮层和角质层;黄连素主要分布在含维管束的厚壁组织层,薄壁组织少有黄连素。
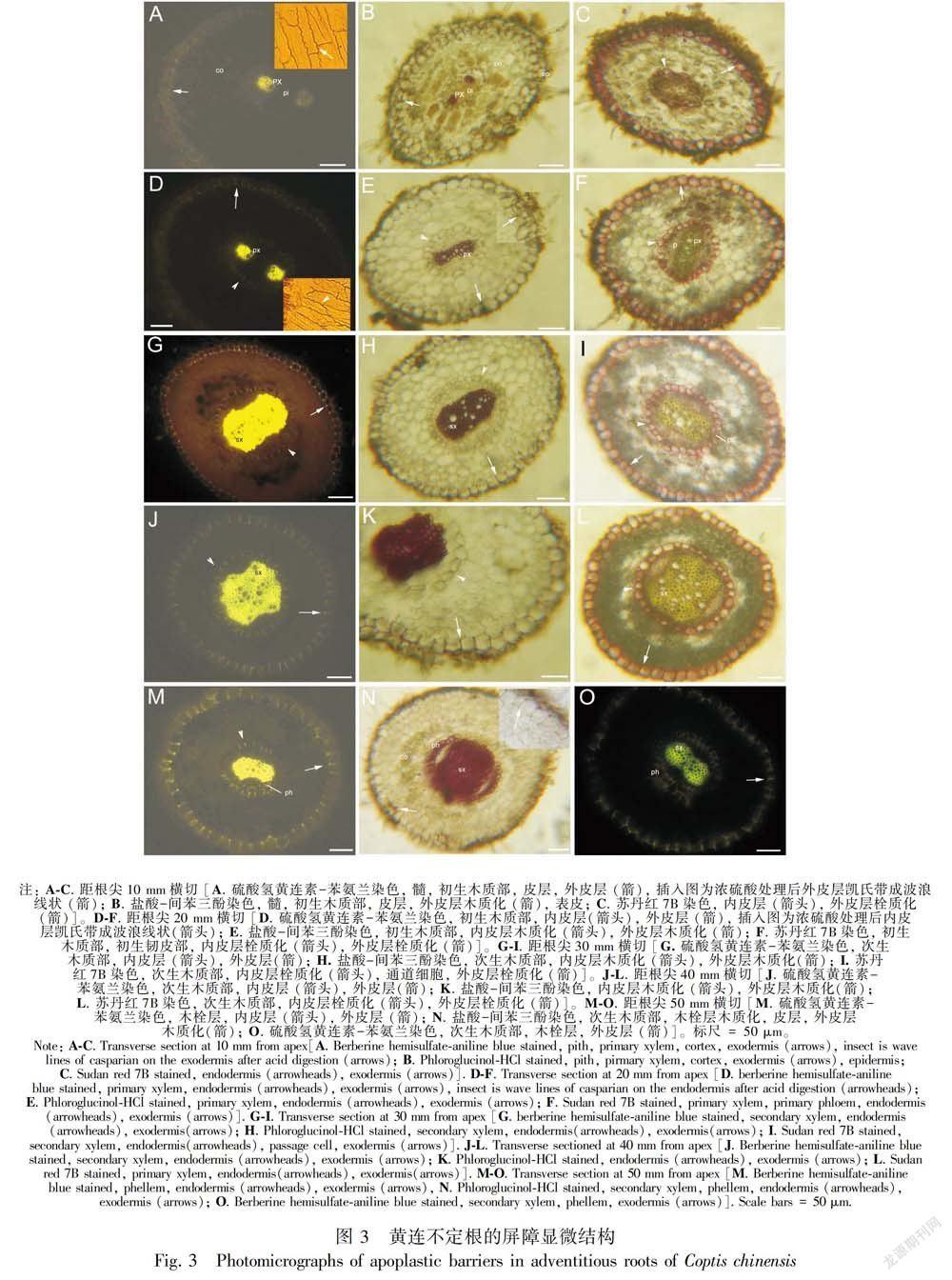
2.3 黄连不定根屏障结构发育过程
距不定根尖10 mm,解剖结构由内而外依次为髓,初生木质部,内皮层,皮层,外皮层和表皮;外皮层具凯氏带,轻微木质化和强烈栓质化,内皮层仅少数细胞栓质化(图3:A,B,C)。 距根尖20 mm,外皮层轻微木质化和强烈栓质化;內皮层具凯氏带,轻微木质化和强烈栓质化,初生木质部具后生木质部,部分表皮细胞脱落(图3:D,E,F)。距根尖30 mm,木质部具次生结构,内皮层仍轻微木质化和强烈栓质化,并具通道细胞;外皮层仍轻微木质化和强烈栓质化;表皮细胞几乎脱落(图3:G,H,I)。距根尖40 mm,次生木质部接近圆形,内皮层仍轻微木质化和强烈栓质化;外皮层木质化略增强和强烈栓质化(图3:J,K,L)。距根尖50 mm,内皮层以内木栓层开始形成并强烈木质化和栓质化;内皮层仍部分存在,皮层和外皮层保持完好;栓质化木栓层在荧光下呈现棕色(Yang et al,2014;Schreiber & Franke,2011;张霞等,2013)(图3:M,N,O)。此后,皮层脱落,木栓层成为保护组织(图1:G,H)。不定根皮层细胞内含物浓厚(图3:B,F,I,L);在普通光学显微镜下木质部明显具黄色的黄连素(图3:I,L)。
结合黄连素在不定根中沉积分布的结构特征和屏障结构组织化学研究,不定根初生结构为髓、初生木质部、初生韧皮部、内皮层、皮层、外皮层和表皮组成,皮层可保留1~2 a不脱落;次生结构为次生木质部、次生韧皮部和木栓层。黄连不定根屏障结构发育早,距根尖10 mm外皮层具凯氏带,轻微木质化和强烈栓质化,此后略增强木质化;而内皮层距根尖20 mm具凯氏带,强烈栓质化,但始终轻微木质化。不定根皮层脱落前,木质化和栓质化的木栓层已经形成,皮层脱落以后,完全由木栓层保护。黄连不定根屏障结构在初生阶段为轻微木质化和强烈栓质化的内皮层和外皮层;次生阶段为木质化和栓质化的木栓层。
3 讨论
3.1 黄连的解剖结构
根据黄连体内黄连素牢固结合木质部后在荧光显微镜蓝色激发光下发出黄色荧光的特点,结合组织化学染色研究不定根解剖和屏障结构。不定根初生结构为维管柱、内皮层、皮层、外皮层和表皮组成,皮层可保留1~2 a不脱落;维管柱由髓、初生木质部和初生韧皮部组成,初生木质部为二、三、四、五和六元型。不定根次生结构为以次生木质部为主、次生韧皮部和木栓层组成。黄连根茎初生结构由角质层,皮层和维管柱组成,维管柱由髓,初生木质部和初生韧皮部组成。根茎次生结构由角质层、木栓层、皮层和维管柱组成,维管柱由髓、次生韧皮部和次生木质部组成,皮层具不定根穿过,多年生根茎的角质层脱落;以皮层和维管柱为主。叶柄结构为含维管束的厚壁组织层、髓、皮层和角质层。与前人研究比较(杨建民和唐红光,1994;袁王俊等,2007),黄连不定根和根茎结构没有明显差别,本研究还缺乏对叶片的研究,可能叶内部构造为等面叶,没有组织分化是其适应阴生环境的原因之一(袁王俊等,2007)。
本研究中,黄连距根尖10 mm的初生木质部即有黄连素沉积,可能黄连素结合并堵塞初生木质部,导致水和矿质离子输导不畅,或者黄连素解离与矿质离子化合或者拮抗,阻碍水和矿质离子的运输,此后老根和根茎中黄连素大量沉积,加剧阻碍水和矿质离子的运输,表现出植物生长过程中缺水和矿质离子,引起植物营养不良而生长缓慢。而次生韧皮部和形成层部位没有黄连素沉积,推测叶片合成的有机物向下输导没有障碍。
3.2 黄连不定根屏障结构分析
黄连不定根初生结构的屏障结构由轻微木质化和强烈栓质化的内皮层和外皮层组成;当维管柱具次生结构时,皮层未脱落之前,此时屏障结构由木栓层,内皮层和外皮层组成;皮层脱落以后,由木栓层组成。黄连不定根屏障结构发育早,距根尖10 mm外皮层具凯氏带,轻微木质化和强烈栓质化,而已研究的湿地植物如双穗雀稗(Paspalum distichum)等,通常在距根尖10 mm以后,内皮层先出现凯氏带而且栓质化和木质化,外皮层将近在距根尖20 mm以后出现凯氏带等组织化学变化(Yang et al,2014,2011;Soukup et al,2007),而且内皮层常强烈木质化,黄连不定根内皮层始终轻微木质化。
3.3 黄连体内黄连素的沉积和分布结构
在本研究中,从植物不定根、根茎和叶柄中黃连素释放的荧光强度和面积看,黄连素主要沉积分布在不定根和根茎的木质部,叶柄中含维管束的厚壁组织层。不定根中,除次生韧皮部和形成层几乎没有荧光,其余薄壁组织等有少量黄连素分布;根茎中,除次生韧皮部和形成层阴暗无黄连素沉积,其它组织都有少量黄连素分布;叶柄韧皮部阴暗无黄连素沉积,髓和皮层均有少量黄连素沉积。
本研究结果与王宪楷等(1959)采用显色沉淀反应方法研究黄连根茎中黄连素沉积的结果相似,主要分布在木质化细胞壁和髓射线。黄连素主要分布在十大功劳属植物的木质部(Greathouse & Watkins,1938),而在小蘖属植物中主要分布于木栓层,其次是木质部(Cromwell,1933),韧皮部缺乏。而用碘化汞钾处理黄连根茎(王宪楷等,1959),黄连素形成晶体的研究结果与本研究的结果有很大差别,认为根茎中黄连素主要分布于皮层,髓和髓射线薄壁组织,木质化细胞壁内有少量分布。
在硫酸氢黄连素溶液作为荧光染色剂把植物材料的木质化细胞壁染色最重,表明黄连素离子易与木质部的木质素牢固结合(Brundrett et al,1988;杨朝东和张霞,2013;Yang et al,2014,2011),而且硫酸氢黄连素溶液作为离子示踪物质与KSCN溶液结合成不溶于水的晶体(杨朝东和张霞,2013;Yang et al,2014;Meyer et al,2009),与碘化汞钾处理黄连根茎中形成的黄连素晶体有类似化学反应,所以认为,碘化汞钾化合的是黄连根茎薄壁组织中离子形态的黄连素或者黄连素的中间体,而木质部的黄连素容易与木质素结合,没有形成晶体,故认为木质部少有黄连素(鲁高莲和胡正海,1994)。本研究在普通光学显微镜下也容易观察到不定根木质部明显具黄色的黄连素。
因此,推测黄连素在根和茎的皮层等薄壁组织中合成,尚处于离子态,然后转移到木质部与木质素结合而储藏。离子态黄连素能转移的特点,可参考在小蘖属植物根系中合成黄连素后转移到地上部分(Cromwell,1933)。综合上述分析,这些实验从不同侧面推测黄连素在黄连体内可能存在游离的离子态和与木质素牢固结合的化合态,这样合理解释了不同研究结果中黄连素沉积和分布结构产生的差异。
本研究认为黄连素主要沉积在黄连的木质部,而其它薄壁组织是黄连素合成的场所,木质部与薄壁组织的合理比例是今后判断黄连品质重要依据,也是黄连栽培生产中必须重视的问题。黄连不定根外皮层屏障结构的及早发育,限制了根尖吸收水和离子的表面积。初生木质部有黄连素沉积并堵塞导管,可能阻碍水和离子向上输导,植物体缺少可利用的水和离子,而导致生长速度缓慢。已有报道叶片内部构造没有组织分化(袁王俊等,2007)。黄连这些结构特点是造成生长缓慢,不耐高温和强光,适应阴生环境的重要原因。
致谢 感谢湖北利川市农业局和利川市箭竹溪黄连科技开发有限公司的支持。
参考文献:
BRUNDRETT MC, ENSTONE DE, PETERSON CA, 1988. A berberine-aniline blue fluorescent staining procedure for suberin, lignin and callose in plant tissue [J]. Protoplasma, 146(2):133-142.
BRUNDRETT MC, KENDRICK B, PETERSON CA, 1991. Efficient lipid staining in plant material with Sudan red 7B or Fluorol yellow 088 in polyethylene glycol-glycerol [J]. Biotechnol Histochem, 66(3): 111-116.
CROMWELL BT, 1933. Experiments on the origin and function of berberine in Berberis darwinii [J]. Biochem J, 27(3): 860-872.
GONG GQ, ZONG ZX, SONG YM, 1999. Spectrofluorometric determination of DNA and RNA with berberine [J]. Spectrochim acta, Part A, 55(9): 1903-1907.
GREATHOUSE GA, WATKINS GM, 1938. Berberine as a factor in the resistance of Mahonia trifoliolata and M. swaseyi to phymatotrichum root rot [J]. Am J Bot, 25(10): 743-748.
JENSEN WA, 1962. Botanical histochemistry-principles and practice [M]. San Francisco, CA: New Phytologist WH Freeman.
KAMATH S, SKEELS M, PAI A, 2009. Significant difference in alkaloid content of Coptis chinensis (Huanglian), from its related American species [J]. Chin Med, 4(17): 1-4.
LU GL, HU ZH, 1994. Histochemistry of berberine of Coptis chinensis Franch. rhizome [J]. Acta Bot Boreal-Occident Sin, 14(3):164-168. [鲁高莲, 胡正海, 1994. 黄连根茎中小蘖碱积累的组织化学研究 [J]. 西北植物学报, 14(3):164-168.]
MEYER CJ, SEAGO JL, PETERSON CA, 2009. Environmental effects on the maturation of the endodermis and multiseriate exodermis of Iris germanica roots [J]. Ann Bot, 103(5): 687-702.
SCHREIBER L, FRANKE RB, 2011.Endodermis and Exodermis in Roots [J]. John Wiley & Sons Ltd, Chichester. http://www.els.net [doi:10.1002/9780470015902.a0002086. pub2.
SOUKUP A, ARMSTRONG W, SCHREIBER L, et al, 2007. Apoplastic barriers to radial oxygen loss and solute penetration: a chemical and functional comparison of the exodermis of two wetland species, Phragmites australis and Glyceria maxima [J]. New Phytol, 173(2): 264-278.
WANG XK, LI MR, TU ML, 1959. Study the morphology of Coptis chinensis produced in Sichuan and its tissue distribution for berberine [J]. J Sichuan Med Coll, (1): 1-15. [王憲楷, 李美蓉, 涂茂利, 1959. 川产黄连的形态组织及组织中小蘖碱分布的研究 [J]. 四川医学院学报, (1): 1-15.]
WANG XK, YANG PQ, CHEN XM, 1964. ber alkaloideaus Coptis chinensis Franch. var. Shihchuensis Wang.(V) [J]. Acta Pharm Sin, 11(6):389-392. [王宪楷, 杨培全, 陈新民, 1964. 黄连研究第五报, 石柱黄连根茎中生物碱的研究 [J]. 药学学报, 11(6):389-392.]
XIAO PG, 1984. Research pharmacognosy of traditional chinese medicine material named Coptis chinensis [J]. Chin Trad Herb Drugs, 15(3): 30-34. [肖培根, 1984. 中药材黄连生药学的研究 [J]. 中草药, 15(3): 30-34.]
YANG CD, ZHANG X, LIU GF, et al, 2013. Progress on the structure and phisiological function of apoplastic barriers in root [J]. Bull Bot Res, 33(1): 114-119. [杨朝东, 张霞, 刘国锋, 等, 2013. 植物根中质外体屏障结构和生理功能研究进展 [J]. 植物研究, 33(1): 114-119.]
YANG CD, ZHANG X, LI JK, et al, 2014. Anatomy and histochemistry of roots and shoots in wild Rice (Zizania latifolia Griseb.) [J]. J Bot, 1: 1-9.
YANG CD, ZHANG X, ZHOU CY, et al, 2011. Root and stem anatomy and histochemistry of four grasses from the Jianghan Floodplain along the Yangtze River, China [J]. Flora, 206:653-661.
YANG CD, ZHANG X, 2013.The permeability and supplement structures in stems for Paspalum distichum [J]. Bull Bot Res, 33(5): 564-568. [杨朝东, 张霞, 2013. 双穗雀稗(Paspalum distichum) 通透性生理和茎解剖结构补充研究 [J]. 植物研究, 33(5): 564-568.]
YANG JM, TANG HG, 1994. An anatomical study on the root and the root stock of Coptis chinensis Franch [J]. J Wuhan Bot Res, 14 (3): 164-168. [杨建民, 唐红光, 1994. 黄连(Coptis chinensis Franch)根和根状茎的解剖 [J]. 武汉植物学研究, 14 (3): 164-168.]
YANG QY, LI YS, GAO XF, et al, 2008. Staining effect of fluorochrome berberine hydrochloride on nucleic acid in gels [J]. J Instr Analy, 27(9): 968-972. [杨全玉, 李永生, 高秀峰, 等, 2008. 盐酸黄连素作为脱氧核糖核酸荧光染料染色效果的研究 [J]. 分析测试学报, 27(9): 968-972.]
YUAN WJ, ZHANG WR, SHANG FD, 2007. Study on the anatomical structure of vegetative organs of Coptis chinensis and its pertinence to sciophyte conditions [J]. J Henan Univ (Nat Sci Ed), 37(2): 184-186. [袁王俊, 張维瑞, 尚富德, 2007. 黄连营养器官解剖结构与其阴生环境相关性研究 [J]. 河南大学学报(自然科学版), 37(2):184-186.]
ZHANG L, ZHANG XP, 2006. The present research situation of plants of Coptis Salisb in China [J]. J Anhui Norm Univ (Nat Sci Ed), 29(4): 368-371. [张莉, 张小平, 2006. 国产黄连属植物的研究现状 [J]. 安徽师范大学学报(自然科学版), 29(4): 368-371.]
ZHANG X, YANG CD, NING GG, 2013. The comparison development of apoplastic barriers in Cynodon dactylon and Paspalum distichum roots [J]. Hubei Agric Sci, 52(20): 4991-4994. [张霞, 杨朝东, 宁国贵, 2013. 狗牙根和双穗雀稗根中质外体屏障结构发育过程的比较研究 [J]. 湖北农业科学, 52(20): 4991-4994.]
ZHAO N, LI LY, BAI ZC, 2015. Research status and prospect of traditional chinese medicine material named Coptis chinensis [J]. J Chongqing Univ Technol (Nat Sci Ed), 29(1): 53-58. [赵楠, 李隆云, 白志川, 2015. 中药材黄连的研究现状与展望 [J]. 重庆理工大学学报(自然科学), 29(1): 53-58.]

