墨兰‘绿墨素’×大花蕙兰‘世界和平’F1代多倍体诱导初报
宋莲 杨俊旭 刘丹 李枝林 王玉英

摘 要: 该研究以墨兰‘绿墨素(Cymbidium sinense ‘Lv mosu)和大花蕙兰‘世界和平(Cymbidium hybridum ‘Shijieheping)杂交兰F1代原球茎为材料,采用浸泡法研究不同浓度秋水仙素和不同处理时间诱导植株加倍的效果。结果表明:0.03%秋水仙素处理72 h,诱导变异率为36%,死亡率为36%,诱导效果最佳;多倍体植株与二倍体植株相比,表现为植株根部木质化加剧,植株矮壮,叶色深绿,叶片变厚、变宽,叶面粗糙,少部分有双叶脉、叶尖开裂、叶片扭曲,生长缓慢等;且多倍体植株气孔大,气孔密度减小;经流式细胞仪分析,二倍体墨兰 × 大花蕙兰F1代植株的荧光通道值为88,多倍体植株荧光通道值是176,多倍体植株为四倍体。该研究结果为培育兰花新品种奠定了基础。
关键词: 墨兰‘绿墨素 × 大花蕙兰‘世界和平F1代, 原球茎, 秋水仙素, 多倍体诱导
中图分类号: Q949.9, Q321
文献标识码: A
文章编号: 1000-3142(2018)02-0188-07
Polyploid induction in Cymbidium sinenthese ‘Lv mosu× Cymbidium hybridum‘Shijieheping F1 generation
SONG Lian, Yang Junxu, LIU Dan, LI Zhilin, WANG Yuying*
( Institute of Landscape Plants, Yunnan Agricultural University, Kunming 650201, China )
Abstract: Technique of mutation breeding in protocorm of Cymbidium sinense ‘Lv mosu× C.hybridum ‘Shijieheping F1 generation of hybrids was studied by means of tissue culture and chemical mutagenesis. The results showed that 0.03% colchicine treatment for 72 h, induced mutation rate was 36%, the mortality rate of 36%, the induced effect was the best; the polyploidy plant had more lignified roots than the diploid plants, the plants were dwarfed, the veins, leaves were dark green, the leaves were thickened and broadened, rough and double leaf twist, slow growth and so on, while the stomata and guard cells were larger and the stomatal density was decreased. DNA ploidy was analyzed by flow cytometry and the values of fluorescence channel were 88 in diploid plants and 176 in polyploid plants, the polyploid plants were tetraploid.
Key words: Cymbidium sinense ‘Lv mosu× Cymbidium hybridum‘Shijieheping F1 generation, protocorm, colchicine, polyploidy induction
墨兰(Cymbidium sinense)因其多在春节前后开放,又名入岁兰、报岁兰、丰岁兰或拜岁兰,是我国传统兰花之一,有“花中四君子”之一的美称,在国兰中花枝最高、株型最大。由于其花瓣香气浓郁,色彩清脆如玉,叶片独特飘逸,象征着幽芳高洁的情操,所以倍受广大花卉爱好者青睐,是传统迎春年花佳品之一。大花蕙兰( C. hybridum)又名虎头兰、蝉兰、东亚兰、新美娘和喜姆比兰,由于与蕙兰(C. faberi)较相似且花朵硕大(钱张,2007),有重要的经济价值和观赏价值而命名为大花蕙兰,现已成为五大盆栽兰花(大花蕙兰、 蝴蝶兰、 石斛兰、 卡特兰、 中国兰)之一,是重要的切花兰花种类之一(张宇欢等,2016),也是四大年宵盆花(蝴蝶兰、大花蕙兰、红掌和凤梨)之一(冯秋霞和王庆平,2007),享有“兰花皇后”的美誉。在兰属花卉观赏方面,人们对其优良性状的要求不断提高,只有通过多途径新种质创制技术,研究培育出新品种花卉,才能满足市场需求。利用传统杂交育种技术,获得墨兰×大花蕙兰 F1代植株,以期选育出具有国兰的香和洋兰的艳的兰花新品系(张宇欢等,2016);同时通过化学方法进行多倍体诱导,拟获得具有花大、抗性強等特点的株系,丰富新种质类型,为兰花新品种选育奠定基础。
近年来,通过多倍体育种技术,相继获得了多种花卉新品种。多倍体植物具有较高抗性、叶片肥厚、花色艳丽、花期长、花瓣多等特点,具备新奇变异特性,观赏价值普遍提高,在花卉育种中,是不可或缺的种质资源。目前通过人工加倍技术获得多倍体已在甜菊、百合、 党参枸杞、 丹参、 川白芷、牵牛属、金鱼草属和鸡冠花等植物上获得成功(詹忠根和徐程,2011;张晓曼等,2004)。关于兰属多倍体诱导有春兰(林芬和邓国础,1997)、沉香虎头兰(李涵等,2005)、墨兰×大花蕙兰的 F1代(张志胜等,2005)、素心黄(邓樱等,2008)等染色体加倍的报道。但尚未见有秋水仙素对墨兰‘绿墨素和大花蕙兰‘世界和平F1代多倍体诱导研究报道。本研究在已建立的墨兰‘绿墨素和大花蕙兰‘世界和平F1代再生体系基础上,以其无菌原球茎为材料,采用组织培养结合秋水仙素诱导的方法,旨在为培育兰花新品种奠定基础。
1 材料与方法
1.1 材料
墨兰×大花蕙兰F1代组培原球茎由云南农业大学花卉研究所提供。
1.2 方法
1.2.1 多倍体诱导 在无菌条件下,选择转接培养20 d增殖的原球茎,将其切成面积约为1 cm2块状,浸泡在于浓度为0、0.03%、0.05%、0.10%的秋水仙素溶液中,分别处理24 h、48 h和72 h后用无菌水冲洗3~4次,用滤纸吸干水转接到1/2MS+6-BA 1.5 mg·L-1+NAA 0.3 mg·L-1+80 g·L-1香蕉泥培养基上。40 d观察苗体的死亡情况,90 d 观察苗体的变异情况,并统计出与二倍体植株外观形态差异植株数量。培养条件:光照强度为1 000~1 800 lx,光照时间为12~14 h·d-1;温度为22~26 ℃;pH为5.8。
1.2.2 多倍体分化培养 将植株外观形态变异植株,接入1/2MS+6-BA 1.5 mg·L-1+NAA 0.3 mg·L-1+80 g·L-1香蕉泥增殖培养基中进行3~5次继代分化培养。培养条件:光照强度为1 000~1 800 lx,光照时间为12~14 h·d-1,温度为22~26 ℃,pH为5.8。
1.2.3 多倍体鉴定
1.2.3.1 形态学观察 以已知二倍体形态为参照,观察记录变异植株株高、叶片颜色、叶形等相关数据。所选测量植株均有4片完全展开的叶片,取植株基部数起第3片叶为测量对象。用电子数显卡尺对植株的叶长、叶宽和株高进行测量。二倍体和变异植株各检测20株。
1.2.3.2 气孔鉴定 植物保卫细胞的长度是鉴定染色体倍性的一个指标(范光年,1990)。取二倍体植株和变异植株相同部位的叶片,平均分成上、中、下三部分,撕取叶片中部下表皮,按常规制片方法进行制片,于BM-2000显微镜下观察,将Canon数码相机安装在显微镜上拍照,用Photo-shopCS3测量气孔的大小和保卫细胞的大小, 并用椭圆面积近似公式(S=长径×短径)求气孔的面积(李雪娇等,2010),各测量30个气孔。
1.2.3.3 流式细胞术检测倍性 以二倍体墨兰×大花蕙兰F1代为对照,对多倍体植株的倍性进行测定。每个样品重复2 次,按试剂盒(Partec CyStain UV Precise P)说明书流程操作。分别取待测二倍体植株和多倍体植株新鲜植物叶片0.5 cm2,置于培养皿中取400 μL的细胞核裂解液(CyStain UV Precise P, Partec GmbH)加于植物叶片之上用刀片将叶片切碎:横向充分切碎后,纵向充分切碎裂解提取1 min将液体用30 μm滤网过滤至样品管中加入1 600 μL染液(CyStain UV Precise P),避光60 s后,样品进入流式细胞仪(Partec CyFlow Space)的蓝色荧光通道进行分析。
1.3 数据统计
采用Excel 2010进行数据记录整理,SPSS 2.0进行方差分析,使用LSD进行多重比较。
2 结果与分析
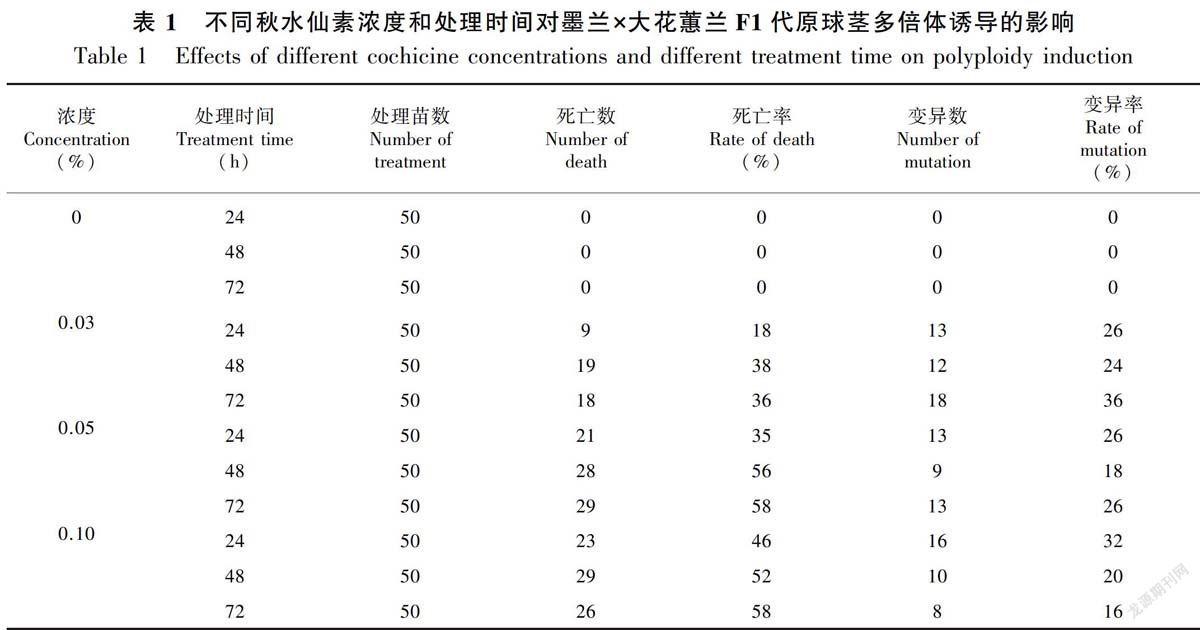
2.1 不同浓度和不同处理时间条件下秋水仙素诱导效果
表1结果显示,不同的秋水仙素浓度和处理时间对墨兰×大花蕙兰F1代原球茎多倍体诱导的影响差异较大。与对照组(即秋水仙素为浓度0)相对比,在同一处理时间条件,秋水仙素浓度越高,原球茎死亡率越高,秋水仙素浓度为0.05%处理72 h和0.10%处理48 h的条件下,死亡率最高,达58%;原球茎变异率在处理24 h,随着秋水仙素浓度的增加,变异率出现上升趋势。综合上述,0.03%秋水仙素处理72 h,墨兰‘绿墨素和大花蕙兰‘世界和平杂交兰F1代原球茎变异率为36%,死亡率为36%,诱导效果最佳。
2.2 多倍体鉴定
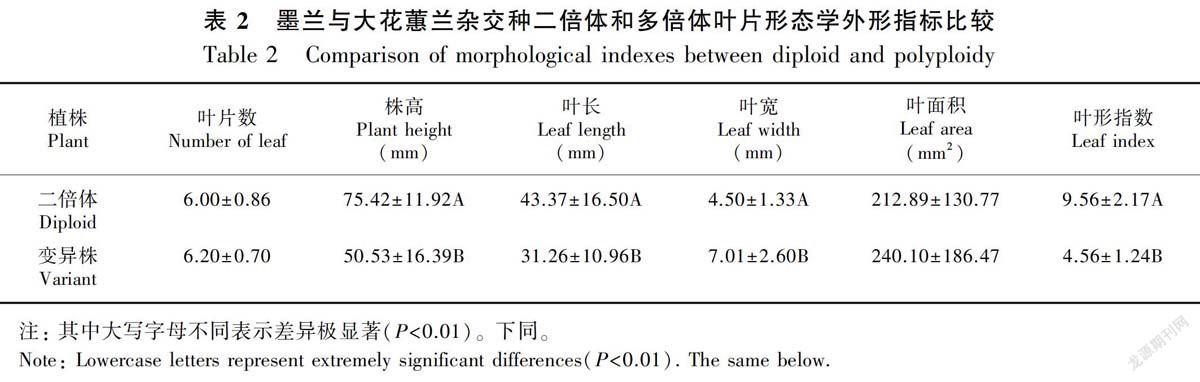
2.2.1 形态学观察结果 从外观形态来看,多倍体植株(A1)和原植株有明显的差别。主要表现为多倍体植株根部木质化,植株矮壮,叶色深绿,叶片变厚、变宽,叶面粗糙,少部分有双叶脉(B1)、叶尖开裂(B2)和叶片扭曲(B3)等(图1)。
由表2可知,多倍体植株的株高、叶长和叶形指数分别比原植株减少33.00%、27.92%、52.30%,而叶宽和叶面积分别比原植株增加55.78%、12.78%(P<0.01)。这说明墨兰与大花蕙兰杂交种多倍体体植株与二倍体植株在株高、叶长、叶宽和叶型指数上差异极显著,叶片形态学外形指标用来初步筛选变异植株是可行的。
2.2.2 气孔、保卫细胞鉴定 图2结果显示,多倍体植株(B1、B2)叶片的气孔比二倍体植株(A1、A2)大,且单位面积内的气孔数减少。气孔和保卫细胞的统计结果见表3。从表3可以看出,墨兰与大花蕙兰杂交种变异植株的气孔长径、气孔短径、气孔面积、保卫细胞长和保卫细胞宽分别比二倍体植株增加24.11%、15.86%、43.59%、20.25%、34.37%(P<0.01)。表明所测数据均达差异极显著水平,气孔大小和保卫细胞大小可以作为鉴定变异植株的参数。
2.2.3 倍性鉴定 细胞核DNA含量的比较,一般以G0-G1期细胞核DNA含量2C相对值的高低来表示。C峰二倍体墨兰 × 大花蕙兰植株(图3:A2)、D峰是多倍体植株(图3:B1)。其中二倍体墨兰 × 大花蕙兰植株的荧光通道值为88,多倍体植株荧光通道值是176。已知墨兰 × 大花蕙兰F1代植株为二倍体(2n=40)(图3:A1),结合图与荧光通道值即可看出墨兰 × 大花蕙兰多倍体植株为4x。因此,经流式细胞仪分析,墨兰 × 大花蕙兰多倍体植株为四倍体。
3 讨论
诱导材料在很大程度上决定着植物的诱变效果,所以选择合适的诱导材料至关重要。由于秋水仙素只能作用于有丝分裂时期的细胞,故选取的诱导材料必须是幼嫩、分裂旺盛的組织或器官。目前用于多倍体诱导的植物体材料主要有原球茎、丛生芽、茎尖、愈伤组织、种子和幼叶等。在兰科植物中,类原球茎(protocorm like-body, PLB)被认为起源于单细胞,相当于双子叶植物体胚。《植物生物学词典》(1994年)中将之定义为植株基部由一团尚未分化的薄壁细胞组成的上端有顶端生长点和叶原基,下端有很多不定根、初具球茎形态的球状体,是兰科植物的一种再生方式。目前大量研究表明通过诱导PLBs可以获得更高的植株诱导率和繁殖系数(李茂娟等,2012;曾桢迦等,2014;朱根发等,2004;Jatd et al, 2006;Le et al,2004)。此外,由于兰科植物形态特征及繁殖方式的限制,对兰花进行多倍体育种通常采用化学诱变结合组织培养方式,即在组织培养阶段对原球茎或不定芽进行处理,来达到染色体加倍的目的(李智等, 2010)。本实验以墨兰‘绿墨素 × 大花蕙兰‘世界和平杂交兰的原球茎为诱导材料,成功诱导出四倍体植株,说明原球茎为墨兰‘绿墨素 × 大花蕙兰‘世界和平杂交兰多倍体诱导的有效材料。
秋水仙素主要是对分裂期的细胞产生作用,会对纺锤丝的效果产生抑制,所以可以得到染色体加倍细胞(李涵等,2005)。在兰花多倍体育种中,秋水仙素处理浓度通常在0.001%~5%之间,具体地视兰花的种类及处理方法而定(李智等, 2010)。尹翠翠等(2010)在探讨了杂交兰四倍体之后发现,通过0.10%浓度的秋水仙素处理2 d后能够获得最佳变异效果,其变异率为36%。王玉英等(2014)对野生黄蝉兰多倍体诱导研究表明以0.06%秋水仙素处理72 h的诱导效果最佳,最佳变异率高达62.5%。Kim et al(1997)用0.01%和0.05%秋水仙素处理寒兰根状茎,处理l周根状茎的存活率分别为82.3%和57.2%,在再生植株中,0.01%处理2周、0.05%和 0.1%处理1周的多倍体(2n:66~80 )诱导率分别为4.5%、5.2%和6.7%。杂交兰茎尖的染色体加倍,生长速度就会降低,对培养基营养进行调节,并改变生长调节剂浓度,对植株激素进行调控,逐渐降低 NAA 的浓度至 0.10 mg·L-1,使其正常生长,获得了株型粗壮,叶片粗糙宽厚的杂交兰四倍体无菌苗(杨丽娟等,2008)。本试验采用0.03%~0.1%的秋水仙素对杂交兰原球茎的诱导均有效,0.03%处理72 h的条件下墨兰与大花蕙兰杂交种的变异率最高,获得杂交种四倍体材料,研究结论与前人一致。
参考文献:
DENG Y, ZHOU Y, CHEN JM, 2008. Methods of polyploid induction of Cymbidium with colchicine [J]. Subtrop Plant Sci,37(2):38-40. [邓樱,周晔,陈继敏, 2008. 秋水仙素诱导兰属“素心黄”多倍体的方法研究 [J]. 亚热带植物科学,37(2):38-40.]
FAN GN, 1990. Is the guard cell of plants related to chromosome ploidy? [J]. Plant J,(1):22-23. [范光年,1990. 植物的保卫细胞与染色体倍性有关吗? [J]. 植物杂志, (1):22-23.]
FENG QX, WANG QP, 2007. Comprehensive evaluation for market value of Cymbidium hybridus [J]. J Shanghai Jiaotong Univ (Agric Sci Ed), 25(6):595-599. [冯秋霞, 王庆平, 2007. 大花蕙兰商品价值的综合评价 [J]. 上海交通大学学报(农业科学版), 25(6):595-599.]
JATD S, CHAN MT, CHAI ML, et al, 2006. Priming abiotic factors for optimal hybrid Cymbidium(Orchidaceae)PLB and callus induction,plantlet formation,and their subsequent cytogenetic stability analysis [J]. Sci Hortic,109(4):368-378.
KIM M, WON JY, SONG C, et al, 1997. Polyploi induction of Cymbid-ium kanran by treatment of cul chicine in vitro [J]. J Hortic Sci, 39 (1) :73-76.
LIN F, DENG GC, 1997. Study on induction of mutation of Cymbidium goeringii [J]. J Hunan Agric Univ, 3( 4) : 39-43. [林芬, 鄧国础,1997. 春兰人工诱变的研究 [J]. 湖南农业大学学报,3( 4) : 39-43.]
LI H, LONG CL, ZHENG SX, et al, 2005. Polyploid induction of Cymbidium iridioides and its biological characteristics [J]. Acta Hortic Sin, 32( 5) : 853-853. [李涵,龙春林,郑思乡,等,2005. 沉香虎头兰多倍体诱导及其鉴定 [J]. 园艺学报,32( 5) : 853-853.]
LI XJ, LI ZL, HUANG LP, 2010. Induction and identification of polyploids in wild Cymbidium lowianum [J]. Chin Agric Sci Bull,(13):261-266. [李雪娇, 李枝林, 黄丽萍,2010. 野生碧玉兰多倍体诱导及鉴定 [J]. 中国农学通报, (13): 261-266.]
LI MJ, TAN BT, DENG SH, et al, 2012. Aseptic sowing and tissue culture of Cymbidium hybridum [J]. Hunan For Sci Technol,39(3):26-29. [李茂娟,谭柏韬,邓少华,等,2012. 大花蕙兰无菌播种与组培快繁技术研究 [J]. 湖南林业科技,39(3):26-29.]
LE VTH, TAKAMURA T, TANAKA M, 2004. Callus formation and plant regeneration from callus through somatic embryo structures in Cymbidium orchid [J]. Plant Sci,166(6):1443-1449.
LI Z, YANG GS, YIN JM, 2010. Research advances on orchid polyploid breeding [J]. Chin J Trop Agric, (12):34-38. [李智, 杨光穗, 尹俊梅, 2010. 兰花多倍体育种研究进展 [J]. 热带农业科学, (12):34-38.]
QIAN ZH, 2007. Research on rapid propagation technology of tissue culture of Cymbidium hybridus [J]. Mod Agric Sci Technol, 17:16. [钱张, 2007. 大花蕙兰组培快繁技术研究 [J]. 现代农业科技, 17:16.]
WANG YY, LI GH, LI ZM, et al, 2014. Preliminary study on polyploid induction in Cymbidium iridiodes D. Don [J]. Jiangsu Agric Sci, 42 (4) :132-134. [王玉英, 李光宏, 李志敏, 等, 2014. 野生黄蝉兰多倍体诱导初报 [J]. 江苏农业科学, 42 (4) :132-134.]
YIN CC, ZHANG Y, ZHANG JH, et al, 2010. Tetraploid induction by colchicine and identification in Cymbidium interspecific hybrids [J]. J Nucl Agric Sci, 24(3):518-521. [尹翠翠,张 燕, 张景华,等, 2010. 秋水仙素诱导杂交兰四倍体及倍性鉴定 [J]. 核农学报 , 24(3):518-521.]
YANG LJ, GAO SP, ZOU ZL, 2008. Primary studies on polyploid induction of Cymbidium hybrid in vitro [J] . Chin Seed Indus, (12):60-61. [杨丽娟, 高素萍, 邹宗兰, 2008. 秋水仙素离体诱导大花蕙兰多倍体试验 [J] 中国种业 , (12) :60-61.]
ZHANG YH, LI XY, WANG YY , et al, 2016. Effect of different LED light qualities on the growth and the physiological indices of F1 of Cymbidium sinense × Cymbidium hybridum [J]. Chin J Trop Agric, 36(9):1-6. [張宇欢, 李夏媛, 王玉英, 等, 2016. LED不同光质对墨兰×大花蕙兰F1代组培苗生长及生理指标的影响 [J]. 热带农业科学, 36(9):1-6.]
ZHAN ZG, XU C, 2011. Study on colchiploid of dendrobium of ficinale induced by colchicines [J]. J Zhejiang Univ(Sci Ed), 38(3):321-325. [ 詹忠根, 徐程, 2011. 秋水仙素诱导铁皮石斛多倍体研究 [J] . 浙江大学学报(理学版),38(3) :321-325].
ZHANG ZS, XIE L, XIAO AX, et al, 2005. Effects of colchicine treatment on growth, differentiation and mutagenseis of protocorm-like-body(PLB)of orchid [J]. Acta Agric Nucl Sin, 19(1) : 19-23. [张志胜,谢 利,萧爱兴, 等, 2005. 秋水仙素处理兰花原球茎对其生长和诱变效应的影响 [J]. 核农学报,19(1) : 19-23.]
ZENG ZJ, LI F, JIA H, et al, 2014. Optimization of conditions for rapid propagation of Cymbidium hybridum protocorm [J]. J Yibin Univ,(12):118-120. [ 曾桢迦, 李芳, 贾黄,等, 2014. 大花蕙兰原球茎快速繁殖条件的优化 [J]. 宜宾学院学报, (12):118-120.]
ZHU GF, CHEN ML, LUO ZW, et al, 2004. Induction and propagation of hybrid protocorm like-body of crosses between Cymbidium sinense and Cymbidium hybridum [J]. Acta Hortic Sin, 31(5):688-690. [朱根发, 陈明莉, 罗智伟, 等, 2004. 墨兰与大花蕙兰种间杂种原球茎的诱导及增殖研究 [J]. 园艺学报,31(5):688-690.]
ZHANG XM, ZHOU HJ, ZHANG QX, et al, 2004. The study on flora polyploid breeding [J]. Heibei J For Orch Res, 19(3):288-293. [张晓曼,周怀军,张启翔, 等, 2004. 花卉多倍体育种研究 [J] 河北林果研究 , 19(3):288-293.]

