4种楝科树种幼苗对土壤镉污染的生长生理响应与镉富集特征
石 坚 ,徐 睿 ,张 健 ,陈良华 *,冯民富
(1.四川农业大学生态林业研究所,成都 611130;2.林业生态工程四川省重点实验室,成都 611130;3.中国大熊猫保护研究中心都江堰基地管理处,成都 611830)
工业革命以来,世界各地受到的环境污染问题越发凸显。特别是矿物冶炼及加工等工业排放,磷肥和污泥等农业面源污染,向环境中排放了大量的镉(Cd),土壤Cd污染已成为世界广泛存在的环境问题。Cd是植物非必需营养元素,大量研究表明,植物在Cd胁迫环境中常会表现出根系生长受阻,养分吸收失衡,光合速率下降,氮代谢失调及其他一系列生理代谢紊乱,从而影响植物生长发育[1-3]。此外,Cd一旦通过土壤-植物-食品系统进入人类食物链并最终进入人体,会对肾脏、骨骼系统、呼吸系统等产生毒害[4],严重时会对人体细胞产生非特异性诱变[5]。目前,我国处于工农业和城市化的快速发展时期,以Cd为代表的重金属污染问题日益严重,Cd污染土壤的修复和治理迫在眉睫,同时也是现在及以后很长一段时间内所研究的环境和生态的热点问题。
植物修复指利用植物的一些特殊生理功能(如吸收、降解、稳定和挥发等)以降低或移除土壤中的重金属污染物的技术[6],它与许多传统修复技术不同,是一种修复效果良好、对环境友好且成本低廉的修复技术。植物物种的筛选是植物修复技术的关键,目前人们已经筛选出超过700种重金属“超富集”(Hyperaccumulator)植物[7],这些植物大多属于十字花科(Brassicaceae)。Cd的超富集植物被定义为:地上部分Cd含量达到100 mg/kg以上,转运系数大于1,但并不会对其正常生长发育产生负面影响的植物[8]。目前国内外发现包括东南景天(Sedum alfredii)、天蓝遏蓝菜(Thlaspi caerulescens)、油菜(Brassica napus)、宝山堇菜(Viola baoshanensis)和龙葵(Solanum nigrum)等Cd超富集植物超过30种[9-11]。超富集植物累积重金属的特性使人们对该类植物的重金属积累与解毒机理非常感兴趣,相关的研究十分深入。例如,超富集植物对重金属离子的外排泵作用,胞内的区隔化作用,对重金属离子的络合作用等[12-13]。植物修复效率取决于植物中的重金属含量和植物的生物量生产[14],但目前所发现的超富集植物大多是草本植物,因生物量小、根系不发达和生长周期较短,这些超富集植物的重金属积累总量小,修复效率低,大多应用于污染极为严重的场地修复,无法应用到人地关系紧张的低Cd污染区。虽然木本植物积累的重金属浓度低,但具有生物量大、根系发达及经济价值高等优点,能修复较深土层的重金属污染土壤,能积累较大总量的重金属,因而具有良好的修复前景,如杨树[15]和白桦[16]等。但是,对具有修复前景的木本植物筛选工作起步较晚,尤其关于乡土树种对Cd的生长生理响应与Cd富集特征研究较少,不利于局部地区植物修复工作的开展。
楝科(Meliaceae)植物是我国的珍贵乡土木本植物,主产长江以南各省区,可入药和观赏,属常绿或落叶乔木或灌木,小枝常有皮孔。现在人们发现楝科植物具有良好的生物防治和药用价值:苦楝的果实提取物及其有效成分对害虫防治有积极作用[17];楝科植物提取物对萝卜蚜有触杀活性,所以可作为新型的植物源杀虫剂[18];红椿、毛麻楝和非洲桃花心木的挥发物成分中都富含萜烯类物质,对害虫具有引诱作用[19]。因此,本研究采用分布较广的楝科的红椿(Toona ciliata)、香椿(T.sinensis)、川楝(Melia toosendan)和苦楝(M.azedarach)作为研究对象,从活性氧、抗氧化酶、生物量、重金属积累与分配等方面研究这4个树种对土壤Cd的生长生理响应与Cd富集特征,以期筛选出拥有较高的抗土壤Cd污染能力和抽提效率的树种,为Cd污染土壤的植物修复提供依据。
1 材料和方法
1.1 盆栽处理
于2013年5月初选择健康的红椿、香椿、川楝和苦楝幼苗,剪去部分主根以促进侧根的生长,将剩余苗木根系浸泡于ABT生根粉溶液中(质量分数为50 mg/kg),浸泡6 h。将浸泡后的苗木预栽培在含有混合培养基质(m(冲积土)∶m(细沙)=3∶1)的苗床中。待苗木新芽长出约5 cm后,移栽长势一致的幼苗用于实验处理。实验设置对照0.12 mg/kg(CK)、2.5 mg/kg(T1)和 5 mg/kg(T2)(以土壤干质量计)含Cd量等3个梯度[20],该污染梯度根据中国GB15618—1995《土壤环境质量标准》设定,即土壤含Cd量≥1 mg/kg属于污染土壤,同时也参照一些Cd矿周边的农田土壤背景值。将Cd(NO3)2溶液施入土壤,充分混匀平衡1个月后用于盆栽实验。每盆移栽1株幼苗,装10 kg冲积土,花盆口径为30 cm,高25 cm。土壤背景值如表1所示。于2013年6月初开始实验处理,每一处理9次重复。
1.2 实验指标测定
实验处理结束时,每个处理随机选择3株苗木的第4片叶(由上到下)用于过氧化氢(H2O2)、丙二醛(MDA)、超氧化物歧化酶(SOD)和过氧化物酶(POD)的测定,以此衡量植物对土壤Cd污染的抗氧化能力。利用H2O2与钛离子形成有色的[TiO(H2O2)]2+配合离子(特异吸收峰在410 nm)的原理对H2O2含量进行测定,利用双组分分光光度法测定MDA含量,四氮唑蓝(NBT)光化还原法测定SOD活性,愈创木酚法测定过氧化物酶(POD)活性[21],各指标的测定均重复3次。
实验处理期为3个月,处理结束后进行收获,将各个处理的苗木分为叶、茎、粗根(直径≥1 mm)和细根(直径<1 mm)4部分。叶和茎先用自来水冲洗后再用去离子水润洗干净,而细根和粗根在冲洗后用20 mmol/L Na-EDTA浸泡20 min进行润洗,将所有清洁后的各植物器官放入烘箱中,于105℃杀青30 min之后调整到70℃烘干至恒重。总生物量为各部分器官干重的总和。

表1 供试土壤基本理化性质Table1 Basic physical and chemical properties of testing soil
在各器官生物量测定结束后,将各部分器官分别磨碎过筛(100目),细粉用于Cd含量测定。植物样品的Cd含量测定是用HNO3-HClO4-HF三酸消解后,采用原子吸收分光光度计法(岛津AA-7000火焰原子吸收光谱仪)测定。Cd积累量为各器官Cd含量与干物质积累量的乘积。
1.3 数据处理和统计分析
采用了富集系数(BC)、转运系数(TF)和耐性指数(TI)衡量植物对Cd的富集能力、迁移能力以及耐受能力:

采用SPSS 16.0统计软件对各物种3个处理的数据进行单因素方差分析(one-way ANOVA),处理间的差异显著性采用多重比较Tukey检验(P<0.05)。
2 结果与分析
2.1 土壤Cd污染对各树种抗氧化特征的影响
由表2可知,T1和T2处理均没有显著影响香椿的H2O2含量(P>0.05),但均显著增加了红椿和苦楝的H2O2含量(P<0.05)。在 T1和T2条件下,红椿的H2O2含量分别是CK的2.00、2.61倍,苦楝的H2O2含量是CK的1.16、1.08倍;仅T2处理显著增加了川楝叶片的H2O2含量(P<0.05)。与CK相比,两个污染处理均没有显著影响香椿和川楝的MDA含量(P>0.05),但均增加了红椿和苦楝的MDA含量(P<0.05),与CK相比,T1和T2条件下红椿的MDA含量分别增加60%、66%,苦楝的MDA含量均增加16%。两个污染处理均没有显著影响香椿的SOD活性(P>0.05);但是,T1和T2处理均显著抑制了红椿的SOD活性(P<0.05),降幅分别为21%、18%;仅T2处理显著抑制了川楝和苦楝的SOD活性(P<0.05),T2条件下川楝和苦楝的SOD活性分别是CK的32%、58%。T1和T2处理均显著降低了红椿的POD活性(P<0.05),均没有显著影响川楝和苦楝的POD活性(P>0.05);香椿的POD活性表现出低促高抑的现象(P<0.05)。
2.2 土壤Cd污染对各树种幼苗生物量的影响
由图1可知,T2处理显著降低了红椿的叶片、细根及川楝的粗根、细根干重(P<0.05),降幅分别为37%、37%、13%、26%;香椿和苦楝各器官干重在两个Cd梯度下均没有显著降低(P>0.05)。与CK相比,T2条件下,红椿的总生物量显著下降(P<0.05,降幅为32%),其他树种的总生物量并没有显著变化(P>0.05)。在土壤Cd污染条件下,川楝的总生物量均高于其他树种。
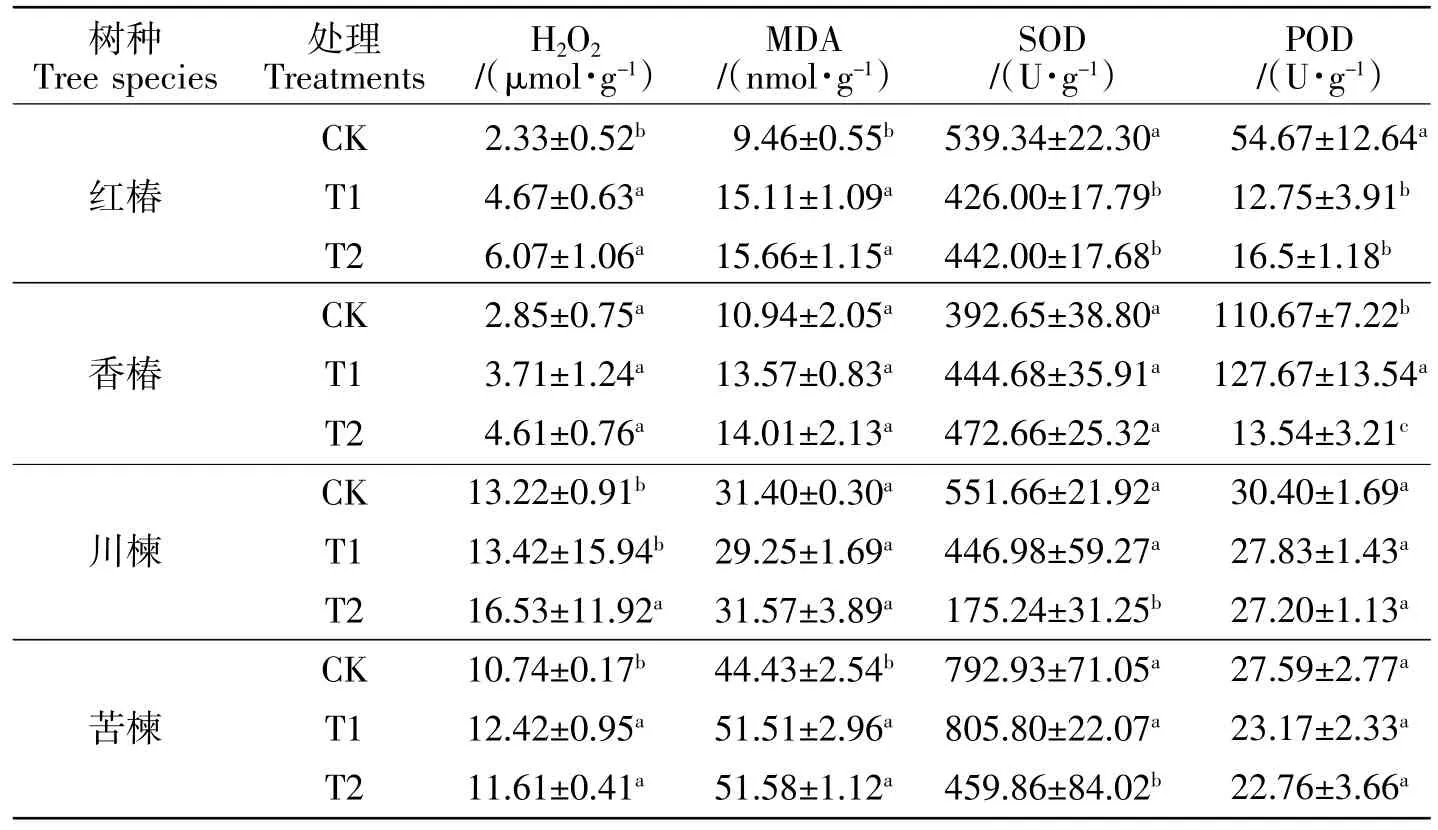
表2 供试土壤基本理化性质Table2 Basic physical and chemical properties of testing soil
2.3 不同土壤Cd污染条件下植株内Cd的积累特征
由图2可知,与CK相比,土壤Cd污染处理显著增加了4个树种所有器官中的Cd浓度(P<0.05,红椿的叶片和粗根除外)。对于红椿的细根,香椿的叶片、茎和细根,川楝的叶片,以及苦楝的细根而言,这些器官中的Cd浓度随着污染程度的增加进一步显著增加(P<0.05)。川楝细根的Cd浓度在T1条件下达最大值,是CK条件下的20.62倍。与其他器官相比,这4种树种细根的Cd浓度均最高,川楝细根中Cd浓度高于香椿、红椿和苦楝细根中的Cd浓度。
由表3可知,与CK相比,两个污染处理均没有显著影响红椿叶片和细根的Cd积累量(P>0.05)。T2处理显著增加了红椿茎的Cd积累量(P<0.05),增幅达79%,显著降低了粗根的Cd积累量(P<0.05),降幅为30%。与CK相比,T1和T2条件下香椿、川楝和苦楝各器官的Cd积累量均有一定程度上升。川楝的叶片、粗根、细根及苦楝的细根的Cd积累量随着污染程度的加剧而显著提高(P<0.05),T1条件下川楝的叶片、粗根、细根及苦楝的细根的Cd积累量分别是 CK 的 2.91、3.79、13.08、9.19 倍,T2 条件下则分别是CK的3.73、4.40、18.11、13.14倍。不管是T1还是T2条件下,4种植物细根的Cd积累量均最大,香椿细根的Cd积累量高于其他树种的细根。与CK相比,土壤Cd污染条件下,香椿、川楝和苦楝的Cd积累总量均显著上升(P<0.05),但红椿的这一指标并没有显著变化(P>0.05)。随着污染程度的增加,苦楝的Cd积累总量进一步明显增加(P<0.05)。
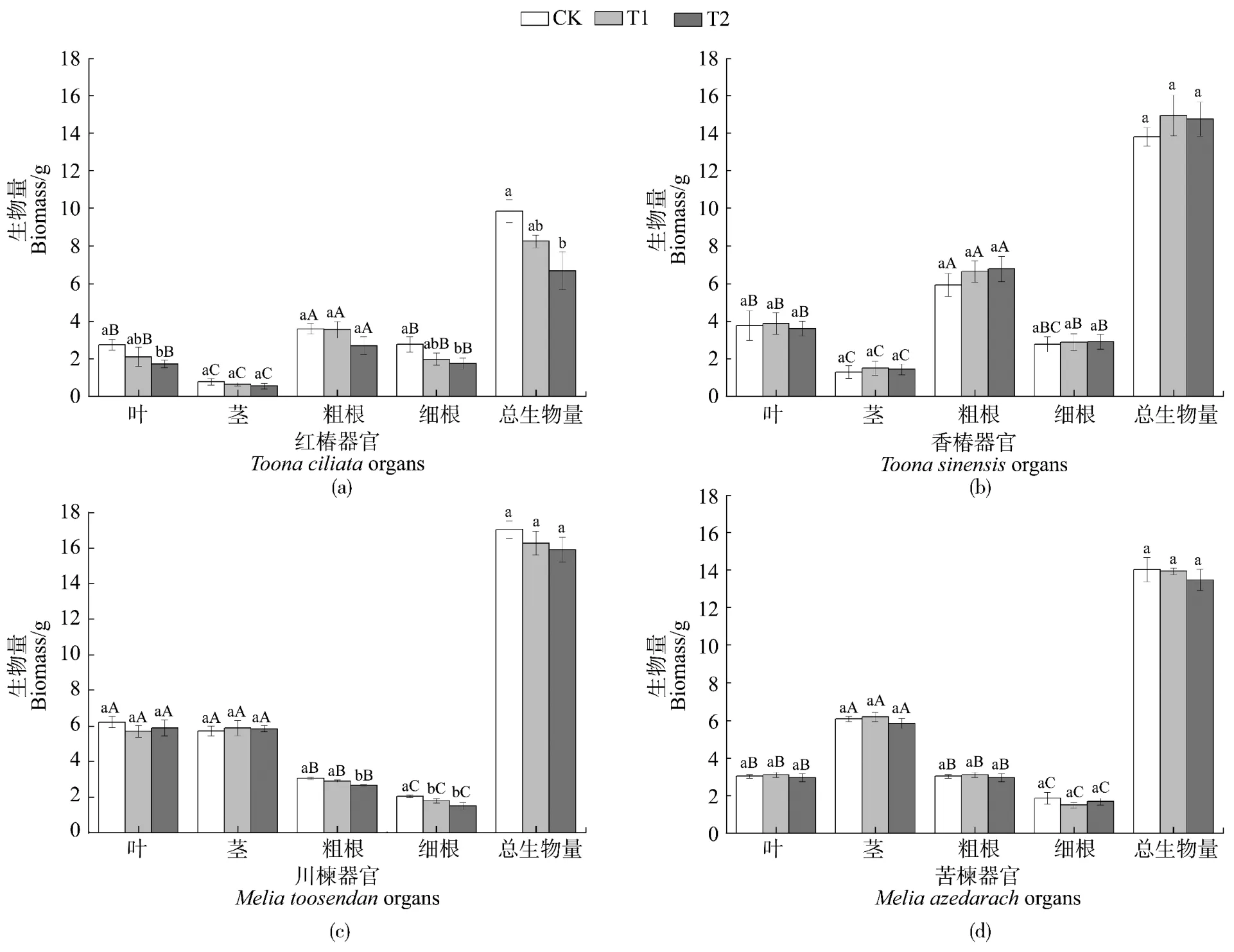
图1 土壤Cd污染对红椿(a)、香椿(b)、川楝(c)和苦楝(d)各器官生物量与总生物量的影响Figure1 The effect of Cd pollution in soil on biomass accumulation of different organs and total biomass in T.ciliata(a), T.sinensis(b), M.toosendan(c)and M.azedarach(d)
2.4 不同土壤Cd污染条件下各树种Cd的富集与分配系数的变化
由图3可知,与CK相比,两种土壤Cd处理均明显降低了所有树种的富集系数(P<0.05);川楝和苦楝的富集系数随着污染程度的增加进一步下降。与CK相比,T1和T2处理均使川楝和苦楝的转运系数明显降低(P<0.05),川楝在T1和T2处理下转运系数分别降低72%、62%,T1和T2时苦楝的转运系数分别降低63%、65%;T2处理明显降低红椿的转运系数(P<0.05),降幅达32%。与CK相比,T1和T2处理均没有明显影响香椿、川楝和苦楝的耐性指数(P>0.05),但T2处理明显降低了红椿的耐性指数(P<0.05),降幅为 32%。
3 讨论
3.1 土壤Cd污染条件下4种楝科树种的抗氧化特征
植物在遭受重金属胁迫后,通常会产生大量的活性氧自由基,产生氧化胁迫,导致脂质过氧化,使细胞膜不稳定;膜脂过氧化的最终产物是MDA,其含量高低通常可反映植物受氧化胁迫的程度。植物为了抵御氧化胁迫,抗氧化酶(如SOD和POD)系统会作出响应[22-23]。本研究中,红椿和苦楝的H2O2含量显著增加(P<0.05),MDA 含量也随之升高(P<0.05,尤其是T2处理),说明红椿和苦楝受到了土壤Cd引起的氧化胁迫伤害,膜脂过氧化程度增加,氧化胁迫将导致细胞膜、蛋白质和核酸等生命大分子的交联聚合,产生细胞毒性,苏明洁等也观察到类似的现象[24]。香椿和川楝(T2条件下的川楝除外)叶片的H2O2和MDA含量没有明显变化(P>0.05),表明它们并没有受到活性氧的显著毒害作用。与此同时,T1条件下,只有香椿的POD活性显著增加(P<0.05);T2条件下,除了香椿,其余树种的SOD活性都有一定程度下降(P<0.05),这说明红椿、川楝和苦楝叶片的SOD和POD的酶活性受到抑制,不能及时清除过多的活性氧,相近水平的Cd污染环境下云南樟[25]、秋华柳[26]和杨树[27]等木本植物的抗氧化酶活性也受到了一定的抑制。然而,香椿的抗氧化酶活性较为稳定,能更好地减轻土壤Cd污染造成的活性氧伤害。由此可见,在本研究的土壤Cd污染水平下,香椿具有比其他3种树种更强的抗氧化酶系统,表现出更强的抗氧化胁迫能力。

图2 土壤Cd污染对红椿(a)、香椿(b)、川楝(c)和苦楝(d)各器官Cd浓度的影响Figure2 The effect of Cd pollution in soil on Cd concentration in different organs in T.ciliata(a), T.sinensis(b), M.toosendan(c)and M.azedarach(d)
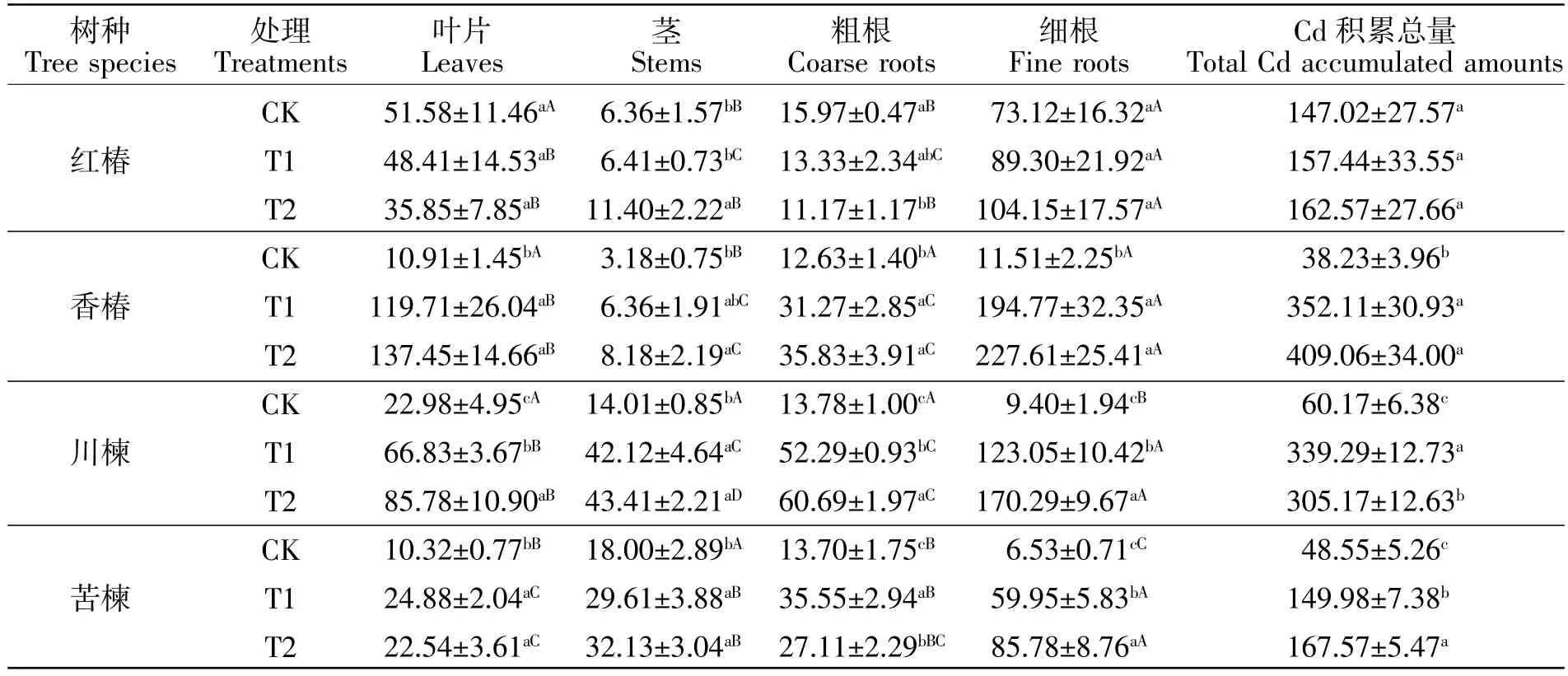
表3 土壤Cd污染对4种楝科树种各器官Cd积累量和Cd积累总量的影响Table3 The effect of Cd pollution in soil on Cd accumulation in different organs and total cadmium accumulation in four Meliaceae plants μg

图3 土壤Cd污染条件下4种楝科树种富集、转移、耐受指标的差异Figure3 Differences in Cd enrichment,transfer and tolerance between four Meliaceae plants when exposed to Cd pollution in soil
3.2 土壤Cd污染条件下4种楝科树种的Cd富集特征
本研究中,土壤Cd污染条件下,4个树种在获得最大Cd积累总量的条件下,Cd积累总量表现为香椿>川楝>苦楝>红椿。伴随污染程度的加剧,各树种Cd积累的规律并不相同。土壤Cd污染条件下,香椿和苦楝各器官的Cd浓度、Cd积累量(T1处理时香椿的茎除外)及积累总量均显著增加(P<0.05)。虽然红椿茎和细根中Cd浓度也显著增加(P<0.05),但这两个器官的生物量不同程度的下降,导致红椿Cd积累总量虽有所增加,但未达显著水平(P>0.05),这说明红椿富集Cd的能力较差。值得注意的是,随着污染程度的提高,川楝的Cd积累总量先增加后下降(P<0.05),主要是因为T2条件下川楝细根的Cd浓度下降所导致。这说明T2浓度的土壤Cd污染可能显著影响了川楝细根的活力及功能,影响了其根系对矿质离子及重金属Cd离子的交换吸附和在根系内部的扩散[28]。Cd胁迫引起了川楝生理代谢的紊乱,也必将影响它的Cd修复能力,这与郑黎明等[29]的研究结果类似。此外,BC是衡量植物重金属富集能力的指标[30],从污染条件下这一参数的变化可见,香椿和川楝具有比红椿和苦楝更高的重金属富集能力。综合来看,香椿表现出了较强的富集能力,并具有最高的重金属积累量。
3.3 土壤Cd污染条件下4种楝科树种的Cd分配特征
就Cd在植物体内的分配而言,大量研究表明,植物将更高浓度的有毒物质积累在根系将减轻植物受到的伤害,有利于保护植物的生长发育[31]。土壤Cd污染条件下,与其他器官相比,4个树种的根系均积累了最大浓度和含量的Cd,表明4个树种优先将Cd积累在根系中,减少Cd向地上部分转运,这是其适应重金属污染环境的基本策略[20,32]。TF是衡量重金属由地下部分向地上部分转运的直接指标[33]。土壤Cd污染条件下香椿和红椿的TF高于川楝和苦楝,说明川楝和苦楝限制有毒Cd离子向地上部分转运的能力更强,有利于减轻Cd离子的毒害作用和对植物生长造成的负面影响。Cd胁迫环境下,香椿的TF高于红椿,这也导致香椿叶片的Cd浓度大于红椿,但香椿的生物量积累没有受到显著影响(P>0.05),也没有受到活性氧的明显伤害(P>0.05),而红椿的总生物量在T2时显著下降(P<0.05),表明香椿更能适应Cd污染土壤,红椿对土壤Cd污染更为敏感。王岑涅等[34]也发现红椿在土壤Cd胁迫环境下,红椿幼苗的生长和生物量积累受到抑制。TI的变化也说明香椿比红椿具有更强的耐受Cd污染的能力。川楝和苦楝在土壤Cd污染条件下TF显著下降(P<0.05),TI没有明显变化(P>0.05),表明这两个物种能够基本适应这一程度的土壤Cd污染,但富集Cd的能力比香椿差,修复Cd污染土壤的能力较弱。
4 结论
从形态生长、生理生化及Cd富集能力等方面综合来看,土壤Cd污染并没有对香椿造成显著的负面影响,而其他树种均受到不同程度的伤害,同时香椿幼苗具有良好的Cd富集能力。因此,在本文的土壤Cd污染水平下,与其他3种树种相比,香椿幼苗具有更强的Cd污染土壤的修复潜力。

