Graphdiyne for Electrochemical Energy Storage Devices
SHEN Xiangyan , HE Jianjiang , WANG Ning , HUANG Changshui ,*
1 Qingdao Institute of Bioenergy and Bioprocess Technology, Chinese Academy of Sciences, Qingdao 266101, Shandong Province,P. R. China.
2 University of Chinese Academy of Sciences, Beijing 100190, P. R. China.
Abstract: Electrochemical energy storage devices are becoming increasingly important in modern society for efficient energy storage. The use of these devices is mainly dependent on the electrode materials. As a newly discovered carbon allotrope,graphdiyne (GDY) is a two-dimensional full-carbon material. Its wide interlayer distance (0.365 nm), large specific surface area,special three-dimensional porous structure (18-C hexagon pores),and high conductivity make it a potential electrode material in energy storage devices. In this paper, based on the facile synthesis method and the unique porous structure of GDY, the applications of GDY in energy storage devices have been discussed in detail from the aspects of both theoretical predictions and recent experimental developments. The Li/Na migration and storage in mono-layered and bulk GDY indicate that GDY-based batteries have excellent theoretical Li/Na storage capacity. The maximal Li storage capacity in mono-layered GDY is LiC3 (744 mAh·g−1). The experimental Li storage capacity of GDY is similar to theoretical predictions. The experimental Li storage capacity of a thick GDY film is close to that of mono-layered GDY’ (744 mAh·g−1). A thin GDY film with double-side storage model has two-times the Li storage capacity (1480 mAh·g−1) of mono-layered GDY. Powder GDY has lower Li storage capacity than GDY film. The maximal Na storage capacity in GDY corresponds to NaC5.14 (316 mAh·g−1), and mono-layered GDY possesses higher theoretical Na storage capacity (NaC2.57). The experimental Na storage capacity (261 mAh·g−1) is similar to its theoretical value.Besides, GDY as electrode material, applied in metal-sulfur batteries, presents excellent electrochemical performance (in Li-S battery: 0.1C, 949.2 mAh·g−1; in Mg-S battery: 50 mA·g−1, 458.9 mAh·g−1). This ingenious design presents a new way for the preparation of carbon-loaded sulfur. GDY electrode material is also successfully used in supercapacitors, including the traditional supercapacitor, Li-ion capacitors, and Na-ion capacitors. The traditional supercapacitor with GDY as the electrode material shows good double layer capacitance and pseudo-capacitance. Both Li-ion capacitor (100.3 W·kg−1,110.7 Wh·kg−1) and Na-ion capacitor (300 W·kg−1, 182.3 Wh·kg−1) possess high power and energy densities. Moreover,the effects of synthesis of GDY nanostructure, heat treatment of GDY, and atom-doping in GDY on the performance of electrochemical energy storage will be introduced and discussed. The results indicate that GDY has great potential for application in different energy storage devices as an efficient electrode material.
Key Words: Graphdiyne; Electrochemical energy storage devices; Li storage; Na storage; Metal-sulphur battery;Supercapacitor
1 引言
随着人口的不断增长和化石燃料的过度消耗,可持续发展的储能技术成为未来能源存储、转移和使用的迫切发展需求1。电化学能源存储对于消费性电子产品、电动车、以及电网等电力能源的存储正变的越来越重要。在不同的能源存储系统中,电化学能源存储器件如电化学电容器、锂/钠离子电池、锂-硫电池、金属-空气电池等,展现出了巨大的应用潜力,引起了科学家们广泛的研究兴趣2–4。这些能量存储器件的主要性能评价标准包括:质量和体积能量密度、功率密度、循环稳定性、价格等。在这些能源存储器件中,电化学电容器虽然具有高的功率密度、稳定的循环性能,但是能量密度有限5–7;与其相对应,锂/钠离子电池等可充放电电池虽然具有高的能量密度,但充放电速率和循环寿命较低8,9。探究原因,除了本身的结构之外,电化学能源存储器件其性能更多地依赖于所使用的电极材料。因此,不断寻求合适、高效的电极材料对于提升储能器件的性能尤其重要。与此同时,这类电极材料的选择还需要考虑环保、经济、可再生等方面的因素10。
在材料绿色环保、可再生开发使用的前提背景下,碳材料在人们日常生活中占据非常重要的位置。碳材料由于其大的比表面积、可调的孔隙尺寸、高的导电性和机械性能、优异的环保性能等优点,使其在能源存器件中一直是人们普遍关注的对象11。尤其是高比表面积的碳材料是电化学电容器最好的商业化可用电极材料;多孔碳材料是一种非常有前景的支撑硫正极在锂-硫电池中的导电载体;石墨是最普遍的商业化的锂离子电池负极材料。此外,纳米碳材料如富勒烯、碳纳米管、石墨烯等被发现在碳基电极负极材料中具有更好的电化学性能。碳材料的研究正不断促进高效电化学能源存储器件电极材料研究的快速发展。作为一种碳新型同素异形体,石墨炔是由苯环和碳炔构成的全碳材料,具有与石墨烯等二维材料类似的平面结构。但与石墨烯不同,石墨炔中的碳不仅含有sp2杂化型碳(苯环上的),还含有sp杂化碳(炔键的)。2010年中国科学院化学研究所李玉良院士课题组首次合成石墨炔后12,其在能源、电子、信息技术、催化、光电等领域展现出的优异性能快速引起了科研工作者广泛的关注13–18。尤其是石墨炔独特的层状多孔结构和良好的导电性等性质也使其在电化学能源存储器件显示出了优异的性能19。本文重点从理论和实验方面介绍石墨炔在电化学能源存储器件中的应用。

黄长水,中国科学院青岛生物能源与过程研究所研究员,中国科学院“百人计划”。研究方向是基于二维平面碳的光、电功能性分子材料制备,及其在能源存储和转化方向的应用和相关器件设计。
2 石墨炔的合成和结构
石墨炔在 1968年由著名理论物学家Baughman提出其结构,许多研究者为合成石墨炔的单体和低聚物结构付出了巨大的努力20–23。直至2010年,中国科学院化学研究所李玉良院士团队采用六炔基苯通过偶联反应在铜片表面成功制备了石墨炔的大面积薄膜12。石墨炔薄膜由多层石墨炔组成,在铜片上是均匀连续的。薄膜显示出半导体的性质,经测试其电导率为2.516 × 10–4S·m−1。石墨炔薄膜的半导体性质与硅相近,可作为硅的重要替代品,应用于电子、半导体和材料领域。
石墨炔的结构和合成原料如图1a所示,六炔基苯在铜离子催化条件下偶联反应可以得到石墨炔12。石墨炔具有单层二维平面结构,由sp杂化的炔键和sp2杂化的苯环构成。为保持结构的稳定性类似于石墨烯,其无限延伸的二维平面呈一定的褶皱状。单层二维平面结构的石墨炔通过范德华力和 π–π相互作用,堆叠形成层状结构。石墨炔具有规则三维孔隙结构,苯环和炔键形成的三角形孔隙在层状石墨炔中形成孔道。石墨炔的 sp和sp2杂化碳结构使其具有很高的π共轭性、规则有序分布的孔隙结构和电子结构可调的特性。石墨炔二维平面结构和三维有序多孔性质,使其有利于储存分子和离子,以及电子的快速迁移。从扫描电镜图中可以看到(图 1b),铜片上的石墨炔薄膜是均匀连续的。提高电镜放大倍数可以观察到,石墨炔薄膜表面光滑平整(图 1c)。石墨炔膜在铜片上呈卷曲、分离状态,说明其具有一定的柔性(图1d)。从横截面图(图1e)中得出石墨炔薄膜的厚度大约为1 μm。

图1 石墨炔的合成和扫描电镜图12Fig. 1 The synthesis and scanning electron microscope(SEM) images of GDY 12.
3 石墨炔在储能器件中的应用
3.1 可充电电池
3.1.1 锂离子电池
如今可充放电式锂离子电池在便携和通讯电子设备中应用非常广泛。随着如电动车、混合动力电动车、可移动电源等新应用的快速发展,对锂离子电池的要求也在不断提高,迫切需要探索高性能的锂离子电池24,25。由于石墨具有成本低、化学稳定性高等优点,因此是目前商业电池中使用最普遍的负极材料26–28。然而,石墨的理论比容量仅为372 mAh·g−1,同时由于其层间较小在多次充放电后会破坏层状结构,因此它不能满足对电池高容量、倍率性能和长循环性能日益增长的要求29,30。因此,迫切需要探索新型的电极材料来获得电池容量和倍率性能的提高。由苯环和炔键构成的石墨炔具有和石墨烯相似的二维平面结构。但石墨烯由sp2碳组成,而石墨炔由sp2和sp杂化碳组成。石墨炔的层间距是0.365 nm,大于石墨的层间距0.335 nm,更适合锂离子的嵌入而不破坏层状结构。同时,石墨炔苯环之间含有两个炔键,苯环与炔键围成了一个大的三角形孔,有利于离子在其层间的扩散。自 2010年石墨炔在实验室被成功合成以来,研究者们在计算和实验方面对石墨炔在电池中的应用进行了大量的研究31–37。
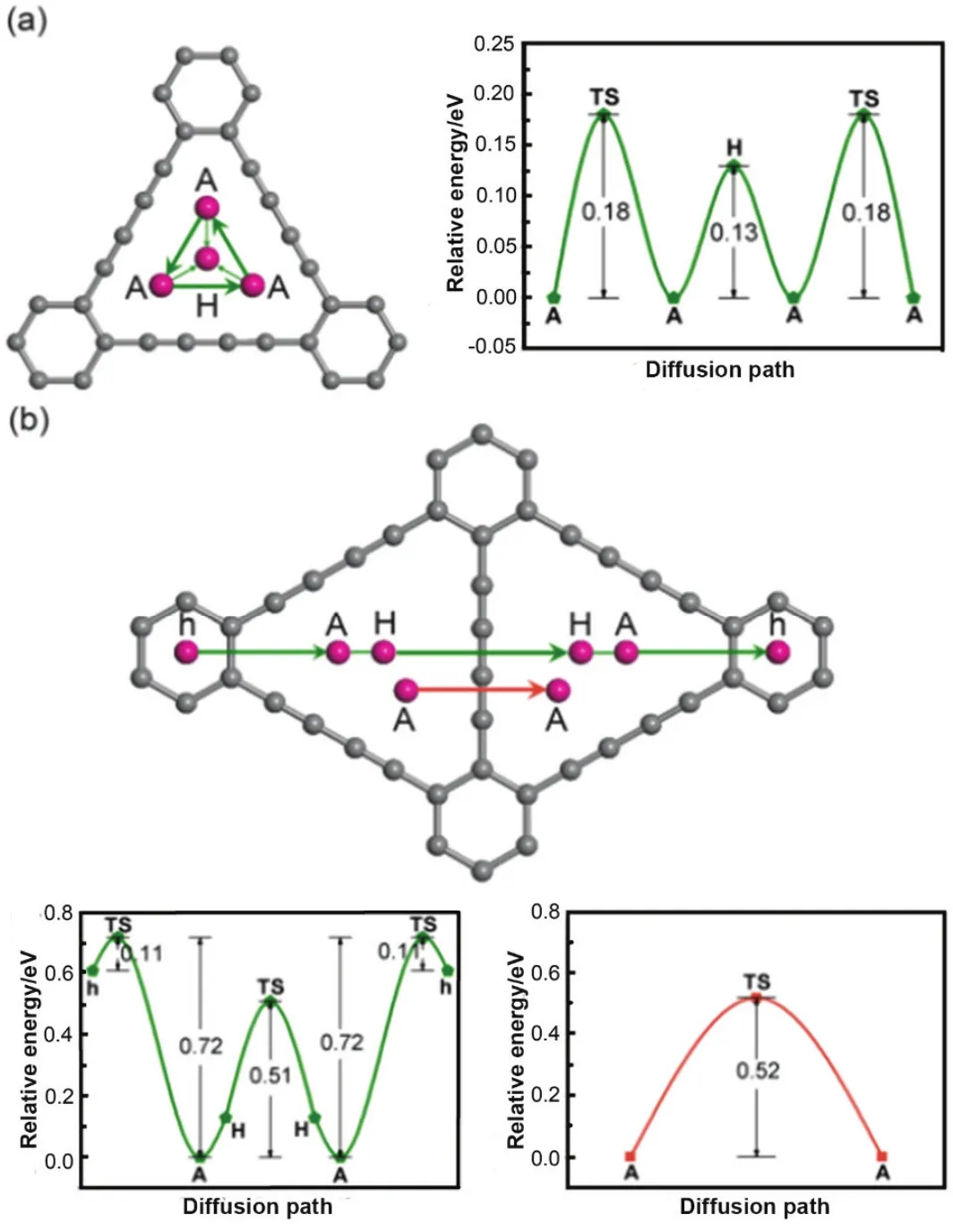
图2 锂原子在石墨炔三角形孔内和层间的扩散路径及其对应的能量变化曲线31Fig. 2 Diffusion pathways of Li within one triangular-like pore or across a GDY layer and the corresponding energy profiles as a function of adsorption sites 31.
Zhang等31首先报道了通过第一性原理计算石墨炔作为锂离子电池的负极材料具有高容量和倍率性能。如图 2所示,通过考虑锂的迁移率对于提高锂离子电池充放电倍率性能的影响,他们研究了锂在石墨炔上临近的吸附点迁移的扩散势垒。首先,在三角形孔隙中锂迁移到相邻的A点时,对应的能量势垒为0.18 eV (图2a)。在A点和H点无过渡态。由于A点具有更高的能量稳定性,在一个三角形孔隙内,锂原子趋向于通过H点迁移到A点(0.13 eV)。一个锂原子沿着A向H扩散的能量势垒为0.11 eV,相反方向则为0.72 eV (图2b)。因此,锂原子更倾向于沿A向h扩散。在两个相邻的三角形孔隙中,锂在两个A点的扩散有两种途径:(1) 通过H点间接扩散,(2) 直接扩散。间接扩散的能量势垒为0.51 eV,和锂在石墨烯中的扩散势垒相近(0.47–0.48 eV)。实验条件下,这个扩散势垒可以很容易被克服。然而,从能量方面考虑,间接的扩散过程是不利的,可推测在大量锂覆盖下,锂在石墨炔面内迁移主要是以直接扩散为主,形成之字形轨迹。锂从一个石墨炔层垂直向另一层扩散时,扩散势垒为0.07 eV。在整个三角形模式里面对应的三个锂原子位于一个石墨炔面内时,三个锂原子同时向面外扩散时,扩散势垒为0.35 eV。因此,sp和sp2杂化碳形成的大孔隙有利于锂在面内和面外的扩散。通过计算可以得到单层石墨炔的最大储锂容量为 LiC3,即744 mAh·g−1,即三个锂原子交替分布在三角形孔的两侧。这一理论存储容量是石墨的两倍。高的迁移率和储锂量表明石墨炔非常适合应用于锂离子电池负极材料。
同时,Jang等35通过第一性原理计算探索了多层 α-石墨炔为锂离子电池负极材料的性能。结果表明,锂嵌入到α-石墨炔的复合为C6Li7.31时,计算的工作电压适合做电池的负极材料。实际使用的质量比容量、体积比容量分别为 2700 mAh·g−1、2000 mAh·cm–3,远大于石墨对应的 372 mAh·g−1、820 mAh·cm–3,石墨一炔对应的质量比容量、体积比容量分别为 1117 mAh·g−1、1589 mAh·cm–3,γ-石墨炔对应的质量比容量是 744 mAh·g−1。因此,多层的石墨炔可作为非常有潜力的高容量的锂离子电池负极材料使用。
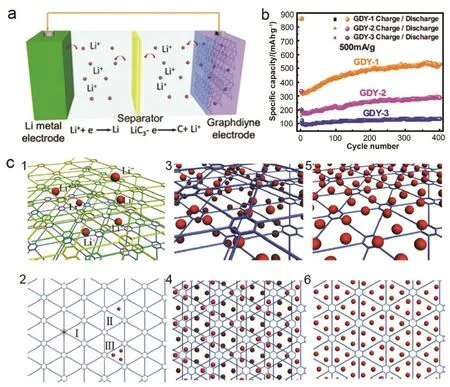
图3 锂在石墨炔中的嵌入机理分析36Fig. 3 Mechanism of Li intercalated GDY 36.
在实验中,Huang等36通过改变单体的浓度和绝对含量制备了三种不同厚度的石墨炔膜,并将它们作为负极分别组装成扣式半电池,进行相关电化学性能测试。三种石墨炔薄膜GDY-1、GDY-2和 GDY-3的面密度分别为 0.24、0.48和0.72 mg·cm–2。电池通过锂离子在石墨炔薄膜中的嵌入脱出进行充放电(图 3a)。前 200圈的充放电循环基于 GDY-1薄膜的电池容量可以达到 495 mAh·g−1(GDY-2 对 应 的 容 量 可 以 达 到 260 mAh·g−1;GDY-3 对应的容量约 101–127 mAh·g−1),随后保持稳定容量在520 mAh·g−1(GDY-2稳定在285 mAh·g−1;GDY-3 稳定在 136 mAh·g−1),接近单层石墨炔的理论比容量(744 mAh·g−1,图 3b)。GDY-1在大电流密度 2 A·g−1下,可逆循环 1000圈以上时,其容量仍旧可以稳定维持在 420 mAh·g−1,表明石墨炔可以作为一个很好的储锂材料,并且可以在大电流下稳定快速的充放电。
锂在多层石墨炔中的存储分为两种途径:层与层间的嵌入/脱出(图 3 c1)和表面吸/脱附过程(图 3 c2)。锂在石墨炔的层与层间的嵌入/脱出对应可形成LiC6。锂原子的吸/脱附在石墨炔表面存在三种形式:锂在苯环的中心,对应可形成LiC18(图3 c2-I);一个锂在碳原子围成的三角形孔的中心,对应可形成LiC9(图3 c2-II);三个锂在碳原子围成的三角形孔的中心上面,吸附到两侧,对应可形成LiC6(图3 c3,4);三个锂在碳原子围成的三角形孔的中心上面,吸附到一侧,对应可形成LiC3(图3 c5,6)。最主要的吸附形式是三个锂在碳原子围成的三角形孔的中心上面。通过计算可以得到单层石墨炔的理论面密度为 0.46 mg·cm–238。面积容量定义为:Cs = C/S,C 为比容量(mAh·g−1)、S 为比表面积(cm2·g−1),以便于实验和理论数据相对比。基于此,锂原子在石墨炔中三种可能的占据位点(图 3 c2)对应的面积容量为:I,0.58 × 10−5mAh·cm–2;II,1.71 × 10–5mAh·cm–2;III,3.42 × 10−5mAh·cm–2。氮气吸脱附测得,GDY-1 比表面积为 1329 m2·g−1,对应的面积容量为 3.91 × 10–5mAh·cm–2(520 mAh·g−1);GDY-2的比表面积为 654 m2·g−1,对应的面积比容量为 4.36 × 10–5mAh·cm–2(285 mAh·g−1)。与石墨炔最大的理论储锂量(3.42 × 10–5mAh·cm–2)相比,这两个数值均偏大。此结果可以解释为,实际充放电过程中锂在石墨炔表面吸附产生容量外,部分锂的嵌入也产生容量贡献。通过对充放电曲线进行微分的数据显示,电压低于0.4 V时为锂嵌入贡献容量,高于0.4 V为锂吸附容量。GDY-1 的吸附容量为 2.99 × 10–5mAh·cm–2(398 mAh·g−1),GDY-2 的吸附容量为 3.03 × 10–5mAh·cm–2(198 mAh·g−1)。这两个数值都小于形式III的吸附容量,大于I和II两种形式的吸附容量。这表明锂在石墨炔表面的吸附中,形式III占主要地位。石墨炔储锂是一个吸附和嵌入的混合过程,与理论推测的结论基本一致。
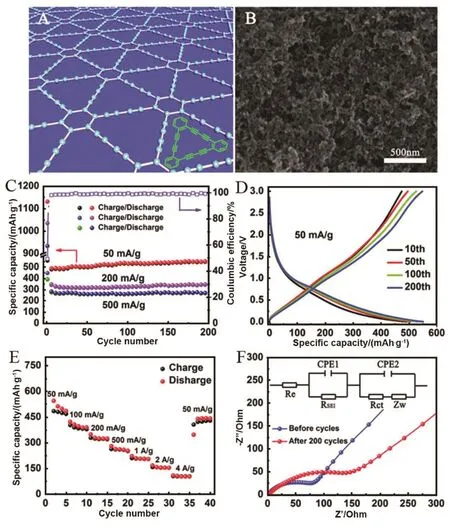
图4 石墨炔在锂离子电池中的应用32Fig. 4 Application of GDY in lithium ion batteries 32.
石墨炔粉末作为负极材料在锂离子电池中的性能也可以从实验中得到32。电池通过锂离子在粉末石墨炔中的嵌入脱出完成充放电过程。从电池的电化学数据分析得出,石墨炔粉末具有较高的容量,良好的循环稳定性。在电流密度为50、200、500 mA·g−1时,循环 200圈,容量均基本保持不变,除前几圈外,其余的库伦效率均接近100% (图4C)。由图4E看出电池在1000、2000、4000 mA·g−1时对应的可逆比容量为 210、158和105 mAh·g−1,表现出极好的倍率性能。循环前、后电池的阻抗变化不大,而且对应的各部分的阻抗都很小,说明石墨炔粉末具有很好的导电性和稳定性(图4F)。
然而,无论是上述的石墨炔薄膜,还是石墨炔粉末,从实验得到储锂容量与理论值相比,仍然有很大的差距,这也反映石墨炔的储锂性能还有很大的提升空间。对此,不同的方法包括石墨炔纳米形貌的制备、对石墨炔进行热处理,以及对石墨炔进行异原子的掺杂等均在后续的研究中被采用。
Zuo等39发展了爆炸法合成石墨炔纳米链,并将石墨炔纳米链作为负极材料也成功应用于锂离子电池。如图 5所示,石墨炔单体直接放入预热(120 °C)的空气中,发生剧烈的爆炸导致体积48倍的提高,制备得到产率为98%的石墨炔纳米链。链状石墨炔的三维孔隙结构和链状形貌有利于电子和离子的迁移,从而有利于Li+的扩散(图5a)。对于Li+的存储,电池在电流密度为50 mA·g−1时的可逆容量为910.8 mAh·g−1,库伦效率达49.34%。首圈容量的部分不可逆归因于固态膜(SEI)的形成。石墨炔纳米链显示出极好的倍率性能(图5b,c),电流密度为 1000和 2500 mA·g−1时,容量仍然分别维持在 410、250 mAh·g−1,优于其他报道的一些碳材料36,40,41。在 500、1000、2500 mA·g−1时,材料具有很好的循环稳定性(图5d)。
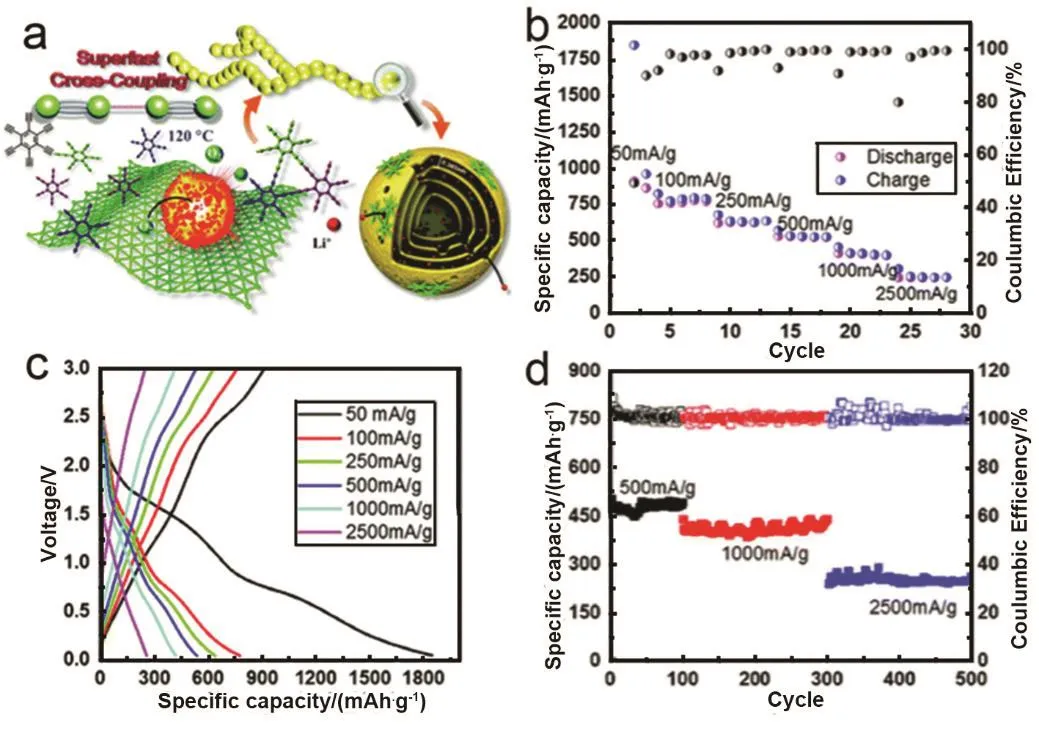
图5 石墨炔纳米链作为锂离子电池负极材料的电化学性能39Fig. 5 Electrochemical performance of GDY nanochain as a lithium ion battery anode 39.
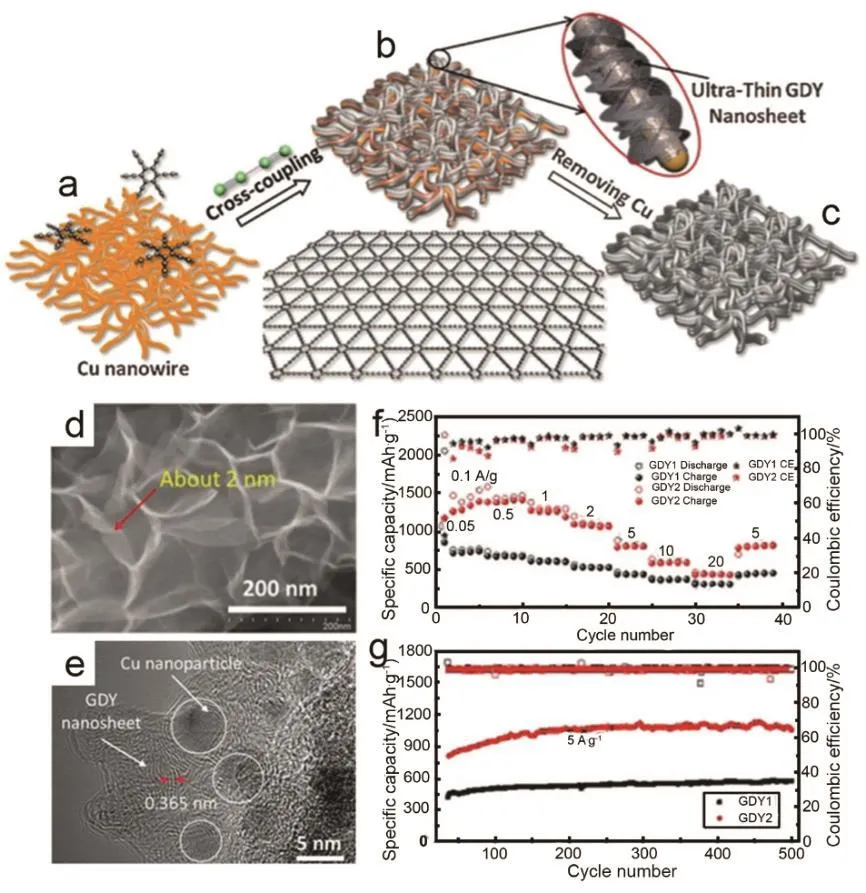
图6 石墨炔纳米片的合成和作为锂离子电池负极材料的电化学性能42Fig. 6 The synthesis of GDY nanosheets and its electrochemical performance as a lithium ion battery anode 42.
Shang等42通过交联反应在铜纳米线上制备出石墨炔纳米管和超薄的石墨炔纳米片(图6a–c)。石墨炔纳米片非常薄,厚度约为2 nm (图6d)。片与片交错排布形成大的孔隙有利于电解液的存储和离子的扩散。石墨炔纳米片的层间距为 0.365 nm,在纳米片里可以清晰的看到一些铜纳米粒子,表明铜纳米粒子和纳米片具有强烈的相互作用(图6e)。Cu@GDY作为锂离子电池的负极材料具有很好的储锂性能。GDY1为1 mg单体制备得到的石墨炔,GDY2是5 mg单体制备得到的石墨炔。GDY1和GDY2首圈的库伦效率分别为 41.7%和51.9%。在 0.1 A·g−1时,GDY2的容量达到 1388 mAh·g−1,高于许多石墨烯基材料和过渡金属43–48,接近GDY理论容量(740 mAh·g−1)的两倍,说明石墨炔的储锂模式是类似于石墨烯片的两面储锂模式。GDY1 在 5,10,20 A·g−1的可逆容量分别为455,372,311 mAh·g−1;GDY2 在 5,10,20 A·g−1对应的可逆比容量为 824,596,449.85 mAh·g−1高于GDY1。GDY优异的倍率性能表明GDY在高功率输出电池中具有很大的应用前景。GDY1和GDY2在5 A·g−1获得的稳定容量分别为513,1043 mAh·g−1。因此 GDY1 和 GDY2 均具有很好的稳定性。
He等49创新性的通过热处理的方法进一步提高了石墨炔的质量,优化了石墨炔薄膜的储锂性能,如图 7所示。在高温条件下,石墨炔纳米颗粒发生交联反应或者随着热处理温度升高而蒸发掉,形成表面平滑的石墨炔膜(图 7a)。热处理温度在400 °C时,石墨炔表面的大部分颗粒被移除,表面变得均一、光滑(图7b)。200_400 °C热处理后的石墨炔随着热处理温度的提高材料的可逆容量不断增大,这主要归因于随着温度的提高,石墨炔的导电性不断增大,同时石墨炔中寡聚物和小分子片段被除去。200和300 °C热处理的石墨炔具有低的可逆容量是因为低聚物未能彻底除去,石墨炔薄膜的导电性依然未得到改善。当热处理温度在500 °C时,尽管500 °C热处理的石墨炔具有很好的导电性,其可逆容量仍然减小。这个现象主要归因于新产生的石墨炔球和堆积的片层不利于Li+的扩散。所有样品都显示很好的循环稳定性(图 7c)。200、300、400、500 °C 热处理的样品在电流密度为100 mA·g−1下循环150圈后的可逆容量分别为 272、689、901、578 mAh·g−1。与通常制备得到的石墨炔相比,通过热处理的方法可以使石墨炔中寡聚物和低聚物得到去除,同时也改善了石墨炔的导电性,从而使其储锂性能得到明显的提高36。
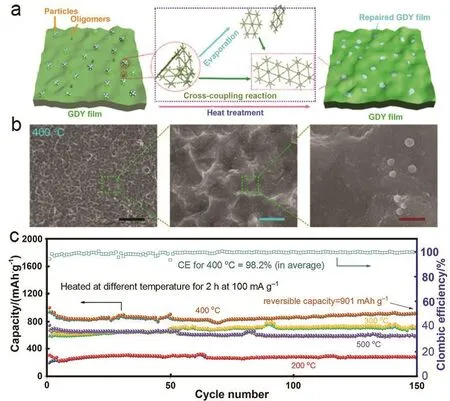
图7 石墨炔薄膜的生长机理和作为锂离子电池负极的循环性能49Fig. 7 The growth mechanism of uniform GDY film and its cycle stability 49.
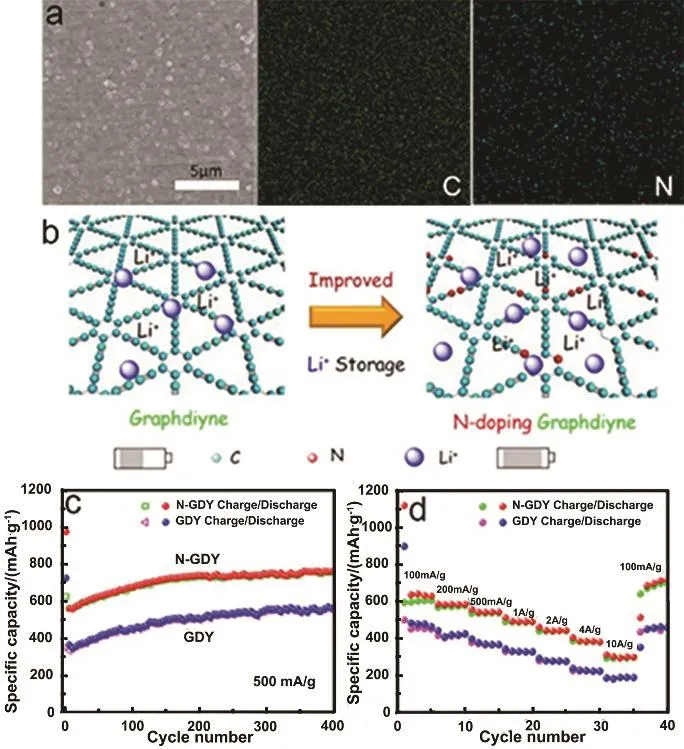
图8 氮掺杂石墨炔作为锂离子电池负极的电化学性能37Fig. 8 The electrochemical performance of nitrogen-doped GDY (N-GDY) 37.
Zhang等37通过氨气条件下的热处理将氮元素成功掺杂到石墨炔中(图8)。氮掺杂之后,石墨炔的导电性得到明显提高,活性位点增多,有利于储锂容量的进一步提高(图 8b)。氮掺杂石墨炔作为锂离子电池的负极材料的电化学性能测试数据表明,与石墨炔相比,氮掺杂石墨炔在不同电流密度下的循环稳定性和倍率性能均得到大幅度的提高(图 8c,d)。
3.1.2 钠离子电池
锂离子电池由于其高的能量密度在能源存储中作为储能电池应用非常广泛50,51。但是由于锂元素在地壳中的分布不均匀和存储量少等原因,导致其不可持续且价格迅速增长52–55。与锂相比,钠是地壳中最丰富的元素之一且分布均匀。钠是原子质量和半径仅次于锂的最小碱金属,是电池中替代锂的理想元素56–59。目前钠离子电池的负极材料主要包括:碳基材料60–62、金属/合金63、钛基复合物64、氧化物65–67和硫化物68,69等。但是,多数材料存在如可逆性和循环稳定性差等固有缺陷,碳材料由其特殊的结构、高导电性、廉价、环保等优点也被广泛用作钠离子电池负极材料。
由离域化的 π共轭体系组成的二维层状碳材料石墨炔,其四个碳原子的sp杂化和六碳原子的苯环连接形成一个18-原子三角形孔,孔隙面积是6-碳原子苯环组成的石墨烯的5.5倍,适合作为钠离子的存储材料。Xu等70通过第一性原理计算对钠存储到石墨炔的能量以及动力学性质进行了研究分析。计算得这种由sp以及sp2杂化碳原子组成的孔隙结构的石墨炔对钠的存储和扩散都是非常有利的。石墨炔与钠可以形成NaC3,优于锂嵌入到石墨形成的 LiC6。对钠离子在石墨炔层间的扩散计算结果表明,钠在石墨炔面内扩散时,钠从B位点迁移到C位点的势垒为0.175 eV,接近从B位点迁移到A位点的势垒(0.18 eV,图9d)。有趣的是,相反方向的钠扩散的能量势垒(A-C-B)为1.089 eV,这是由于A-B的扩散存在较高能量势垒。另外,钠从一个A位点移至相邻的A位点以及从C位点移至相邻C位点的能量势垒分别为0.64和0.39 eV (图9e)。钠在面外的扩散有一个相对较大的能量势垒4.5 eV (图9f)。鉴于Na-GDY能量的稳定性和动力学系统,钠主要在面内迁移。路径A-A和C-C对应的能量势垒为0.39–0.64 eV,与锂在石墨炔中扩散的能量势垒 0.35–0.52 eV,0.1–0.84 eV接近。
与此同时,Niaei等71也釆用密度泛函理论对层状石墨炔的储钠行为进行了计算。他们假定1–12个钠负载在每个单胞(36个C原子)上,挑选了超过25种初始的结构。图10展示了结合不同钠原子数目时,体系的平均结合能以及相应的结构函数。蓝线连接的是几乎没有结构扭曲的构型,绿线连接的是有较大结构扭曲的构型。所有的结合能都要远大于钠原子的内聚能 1.113 eV,因此体系中不含有钠原子团簇结构。虽然这个单胞最多可以负载12个钠原子,但当负载的原子大于7个时,结构就会发生严重扭曲。因此,当结构不发生严重扭曲以及没有层间距扩张时,石墨炔的最大储钠容量为 Na7C36即 NaC5.14,相当于 316 mAh·g−1。单层石墨炔拥有更高的储钠容量(NaC2.57),几乎是块体石墨炔的两倍。当钠的储存位点在石墨炔分子层的上方0.2 nm处时,超过了石墨炔层间距的一半,单层存在更高的钠负载量。石墨炔层间距扩展 28%时,钠的吸附量在块体石墨炔和单层石墨炔中是一样的(NaC2.57,497 mAh·g−1)。表明石墨炔作为负极材料在钠离子电池中也是有发展潜力的。
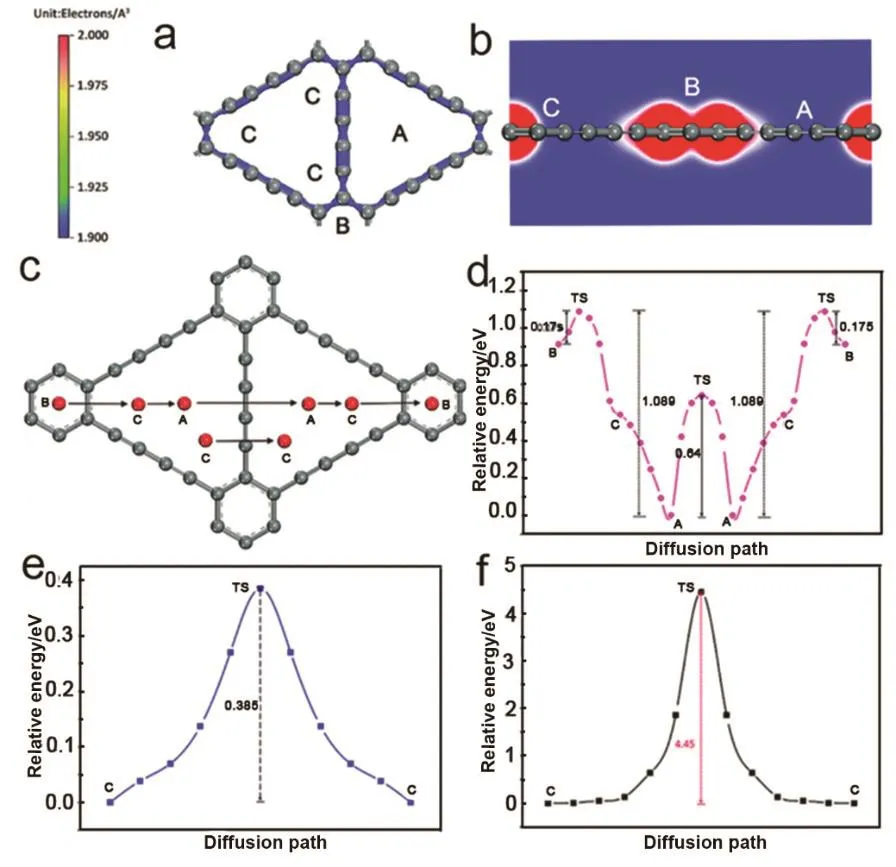
图9 石墨炔的电荷密度和钠离子在石墨炔中的传输路径图70 Fig. 9 Charge density of GDY and schematic plots of diffusion paths of Na on GDY monolayers 70.
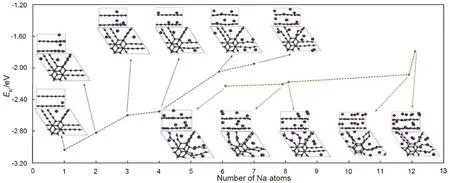
图10 钠离子嵌入到石墨炔中的数目的结合能函数71Fig. 10 Binding energy as a function of the number of Na atoms intercalated in bulk GDY 71.
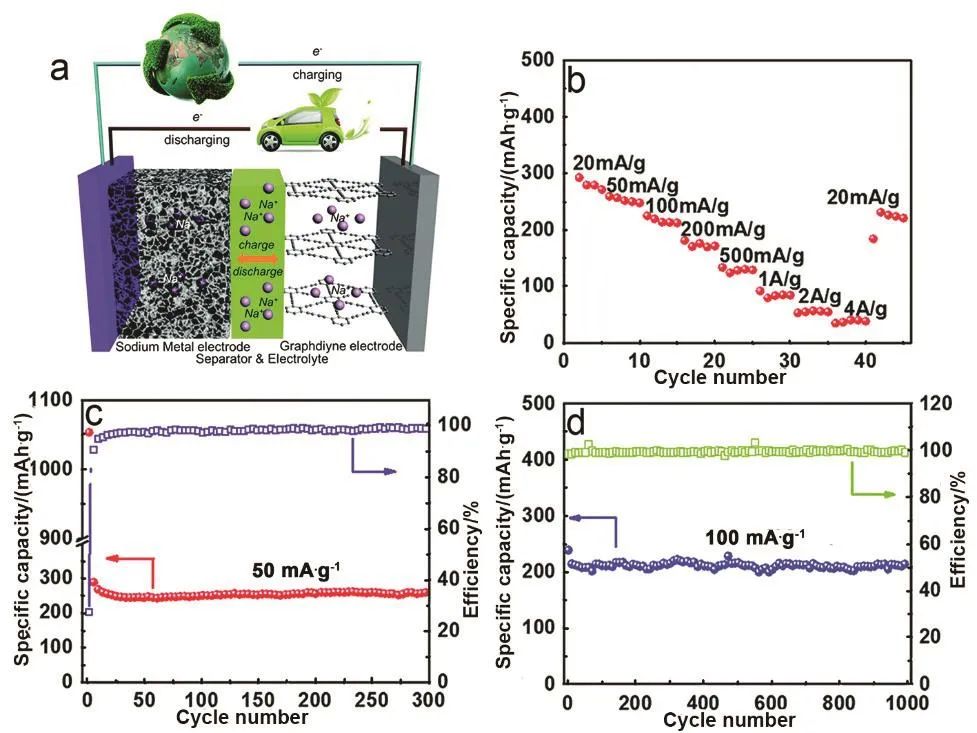
图11 石墨炔为负极的钠离子电池性质72Fig. 11 The characterization of sodium ion battery(SIB) with GDY as an anode electrode 72.
Zhang等72率先报道了多孔石墨炔在钠离子电池中的应用,他们首先合成了多孔的石墨炔,其比表面积为287.7 m2·g−1,具有介孔和微孔的尺寸分布,这种孔隙分布有利于钠离子在石墨炔中的快速扩散,获得小的传输阻抗,实现有效的钠离子存储。石墨炔作为钠离子电池的负极材料,通过钠离子的嵌入脱出来完成电池的充放电行为(图11a)。石墨炔钠离子电池在不同电流密度下都能稳定充放电,其倍率性能如图11b,在电流密度回复至小电流后,容量仍能得到有效保持。电池在50 mA·g−1电流密度下,循环300圈后容量仍高达 261 mAh·g−1;电流密度提高到 100 mA·g−1,石墨炔电极在循环 1000圈后容量为 211 mAh·g−1,且在两电流密度下循环前后容量基本保持不变,说明电池具有很好的循环稳定性(图 11c,d)。实验结果充分证明了石墨炔具有优良的储钠行为。Zuo等39利用爆炸法制备的石墨炔纳米链也表现出了很好的储钠性能(图 12)。从材料的扫描图中可以看出石墨炔纳米链交错呈多孔的三维立体结构,有利于 Na+的传输扩散(图 12a)。石墨炔纳米链的首圈充电比容量为614 mAh·g−1,库伦效率为52.8%。石墨炔纳米链具有非常好的倍率性能,在2500 mA·g−1时容量保持率为初始容量的 62.3%(380 mAh·g−1,图 12b,c)。400 圈循环后,石墨炔纳米链的容量基本保持不变,表现出了较好的稳定性(图12d)。

图12 石墨炔纳米链作为钠离子电池负极材料的电化学性能39Fig. 12 Electrochemical performance of GDY nanochain as a sodium ion battery anode 39.
3.1.3 锂/镁-硫电池
金属-硫电池由于硫正极和金属负极的高容量,使其有希望成为下一代高能量存储系统73。硫正极具有高的理论比容量(1672 mAh·g−1)和高的理论体积比容量(3459 mAh·cm–3),优于传统的锂离子电池正极如LiCoO2和LiFePO474。值得注意的是作为地球上储量最丰富的元素之一,硫价格低廉,有利于在能源系统中商品化大规模的使用75–77。但是,硫的电子和离子电导率很低,将极大地限制了其电化学行为78。科研工作者在制备硫正极结构尤其是锂–硫电池方面付出了许多努力,其中一个重要的工作就是用具有极好导电性、大表面积、强吸附能力的碳材料负载硫成功应用于锂硫电池正极79–81。新型碳材料石墨炔作为一种平面层状多孔材料,其独特的结构使其具有许多有趣的性质。前面的一系列实验也证明石墨炔是一个具有高锂离子迁移率的导电碳骨架32,36,82;而与石墨烯相比,石墨炔的炔基和苯环连接产生分子平面内的孔隙和更低的原子密度非常有利于硫的负载。同时第一性原理计算得石墨炔独特的原子排布和电子结构有利于锂离子在其面内和面外的扩散(能量势垒为0.53–0.57 eV),使石墨炔具有高的锂离子迁移率83。
基于以上,Du等84设计了一种新型的以石墨炔为基础的硫正极材料。石墨炔具有大的有序孔隙分布(0.542 nm),宽的层间距(0.365 nm),对于小硫分子(S2–4)是一个很好的存储介质。小硫分子作为能量存储单元通过共价键和物理吸附进入具有高的锂离子迁移率的导电碳骨架。石墨炔中高活性的―C≡C―C≡C―非常容易与硫自由基发生反应。通过热处理,S8分解产生的小硫分子单元将和石墨炔中高活性的―C≡C―C≡C―反应,同时也能直接进入石墨炔二维平面的三角形孔隙,从而抑制硫的穿梭效应(图 13a,b)。这样可以将硫掺杂石墨炔作为正极材料应用于锂硫和镁硫电池,两种电池均表现出了优异的电化学性能。这一巧妙的应用为碳负载的硫正极的制备开辟了一个新的途径。图13为硫掺杂石墨炔作为正极材料在锂-硫电池中的电化学性能表征,电位窗口为1–3 V。图13c显示了硫掺杂石墨炔正极的倍率性能。电流密度为 2C (即 3344 mA·g−1)时硫掺杂石墨炔具有高的比容量(503.1 mAh·g−1);当电流密度重新设置为0.1C时,容量重新达到949.2 mAh·g−1,显示出优异的倍率性能。这个优异的倍率性能归因于包含硫的石墨炔导电碳骨架所具有的高锂离子迁移率83。除此之外,硫掺杂石墨炔正极也显示出了出色的循环稳定性(图 13d),电流密度为0.5C和1C时,100圈后可逆比容量分别为821.4和 713.7 mAh·g−1,每圈的库伦效率接近 100%。硫掺杂石墨炔正极在碳酸基电解液中显示出极好的电化学性能。图14显示硫掺杂石墨炔作为正极材料在镁硫电池中的电化学性能表征,电位窗口为0.4–2.1 V。硫掺杂石墨炔为层状结构,同时含有大量微孔,硫、碳均匀分布在材料中。图 14c是硫掺杂石墨炔电池的倍率性能,可以看到随着电流密度的增大,容量轻微衰减,表现出极好的倍率性能。第36圈时放电比容量为458.9 mAh·g−1,对应77.3%的容量保持率(图14e)。从循环寿命和容量比较,硫掺杂石墨炔镁硫电池优于已报道的其他材料(图14d)73,74,85,86。
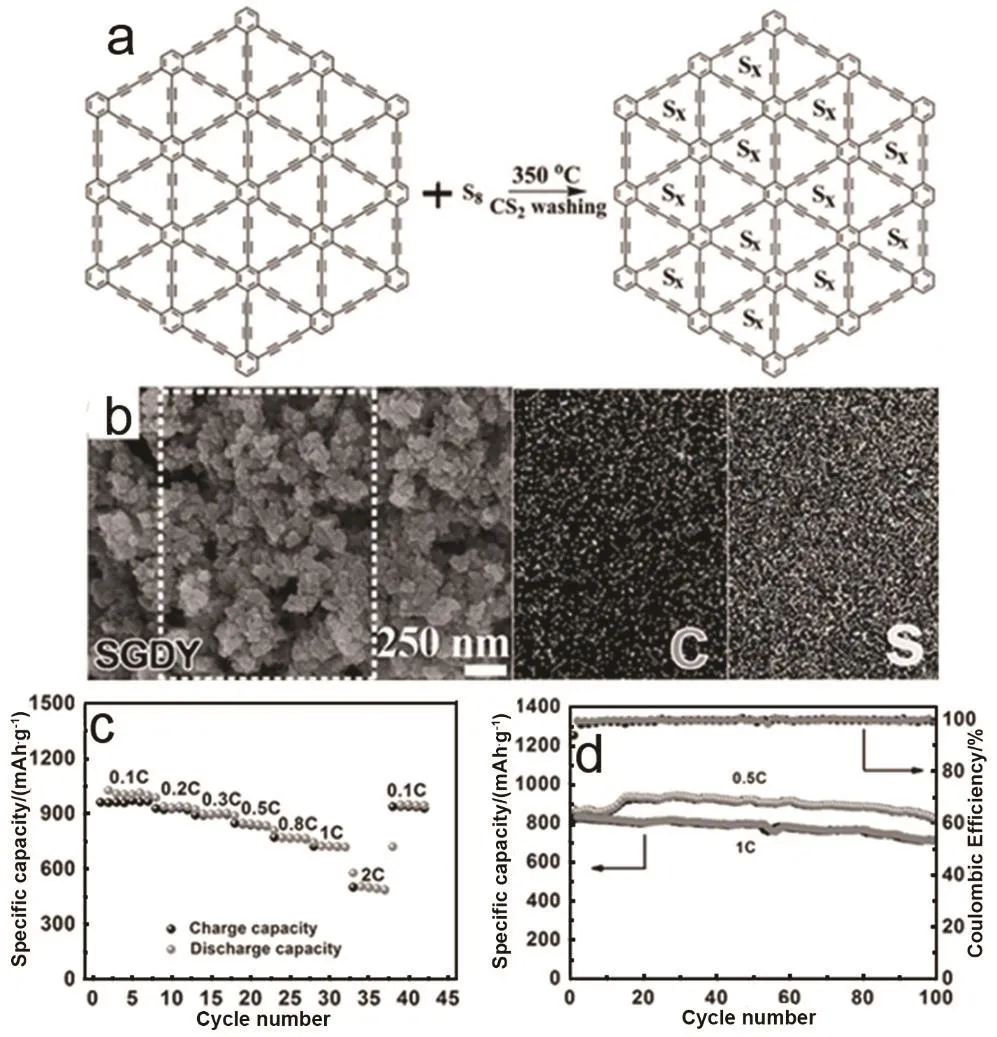
图13 硫化石墨炔的合成和作为正极在锂-硫电池中的电化学性能84Fig. 13 The synthesis of SGDY and its electrochemical performance as compatible cathode for lithium-sulfur batteries 84.
3.2 超级电容器
超级电容器又称为电化学电容器,具有制备简单、循环寿命长和功率密度大等优点87,88。一般来说,根据能量储存原理,超级电容器可以分为两类:一类是电化学双电层电容器,这类电容器主要依赖电荷在电极界面上的电荷累积进行能量存储;另一类是赝电容电容器,主要靠电极表面发生快速的法拉第反应储能89–92。石墨炔大的比表面积、有序的三维孔隙结构、宽的层间距,这均有利于电子和离子在其表面快速的迁移和扩散,适合于快速充放电,因此石墨炔在电容器中是一种非常有前景的电极材料。
3.2.1 双电层和赝电容电容器
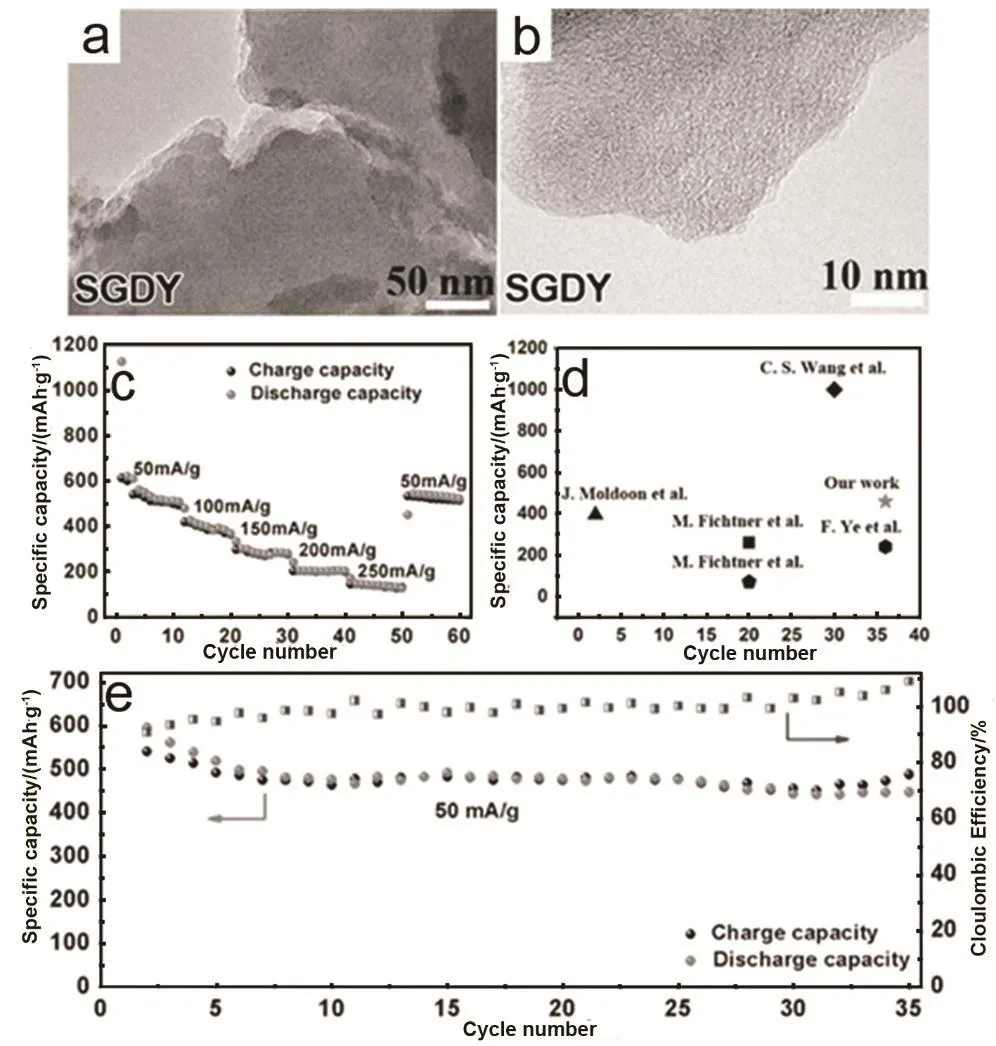
图14 硫化石墨炔作为正极在镁-硫电池中的电化学性能84Fig. 14 The electrochemical performance of SGDY as compatible cathode for magnesium-sulfur batteries 84.

图15 石墨炔电极的电化学性能98Fig. 15 The electrochemical performance of GDY electrodes 98.
在水系电解液Na2SO4中,石墨炔作为电容器的电极材料性能如图15所示。它的CV图(图15a)呈现类矩形结构,表明石墨炔在整个存储过程中的电荷存储机制表现为双电层电容和法拉第反应,类似于其他碳基电极材料,例如氧化石墨、石墨烯。基于石墨炔电极的电容器质量比容量与CV 曲线的关系可用公式:C = [ʃ(I × dV)/(S × ΔV ×m)]来表示,“I”为电流,“S”为扫速,ΔV为电位窗口,m为活性物质的质量。扫速为 5 mV·s−1时,比容量为45 F·g−1。基于石墨炔电极的电容器充放电曲线(图15b)显示出和循环伏安曲线一致的类对称性,电流密度越大,放电时间越短。在充放电曲线中,基于石墨炔电极的电容器质量比容量计算:C = [(IΔt)/mΔV],“I”为放电电流(mA),“Δt”为放电时间(s),“m”活性物质的质量(mg),“ΔV”为电位窗口。由于电解液的扩散限制,随着电流密度的增大电容器的比容量不断减小93。电流密度为 3.5 A·g−1时,基于石墨炔电极的电容器比容量为71.4 F·g−1,高于一些碳基材料包括石墨烯(47.5 F·g−1)94,氧化石墨烯(29.7 F·g−1)等的比容量95,与 g-C3N4(71 和 81 F·g−1)相当96,高于其它二维材料如花状MoS2纳米片(19.1 F·g−1)等97(图15c)。在循环1000圈后,基于石墨炔电极的电容器电容保持率可达到97%。循环1000圈后的阻抗图与未循环时相比,溶液阻抗从 2.6到2.85 Ω和电荷传输阻抗从14.7到19.2 Ω,均增大(图15d)。这些实验结果表明,石墨炔电极在双电层电容器和赝电容电容器中具有巨大的潜在应用价值。
3.2.2 复合型电容器
Du等82首次将石墨炔作为负极材料应用于锂离子电容器。石墨炔的层间距和其独特的孔隙结构可允许大量的锂离子快速嵌入脱出(图16a–c),基于此,石墨炔基锂离子电容器的电化学性能如图16d–i所示。电位窗口为2–4 V时,该电容器不同扫速下的循环伏安曲线图表明,电容器显现良好的电容行为(图16d)。循环伏安曲线的局部变形主要归因于部分法拉第反应(锂离子的嵌入脱出)。可以看到电容器的充放电曲线具有很好的对称性,因此石墨炔在电压区间范围内是理想的电容行为,且是以双电层电容为主的(图16e)。通过充放电曲线计算,可以得到电流密度为 50 mA·g−1时,电容器的比容量可以达到204.91 F·g−1。值得关注的是,电流密度为500 mA·g−1时,电容器比容量仍可以达到178.34 F·g−1,表明该电容器具有很好的倍率性能(图16f)。计算得到的电容器的能量图(图16g)显示,石墨炔基电容器在功率密度为100.3 W·kg−1时,电容器的能量密度可以达到110.7 Wh·kg−1;当功率密度为 1000.4 W·kg−1时,其能量密度仍能达到95.1 Wh·kg−1。这一能量密度和功率密度要远大于石墨和石墨烯为负极的电容器的功率密度和能量密度99。显示石墨炔电容器可以展现出兼具高功率密度和高能量密度。石墨炔电容器在200 mA·g−1电流密度下,循环1000圈后电容器的能量密度仍为106.2 Wh·kg−1,容量保持率为 94.7%,表现出了很好的循环稳定性(图16h)。从电容器的阻抗图中可以看出,循环前后材料均具有较好的导电性(图16i)。
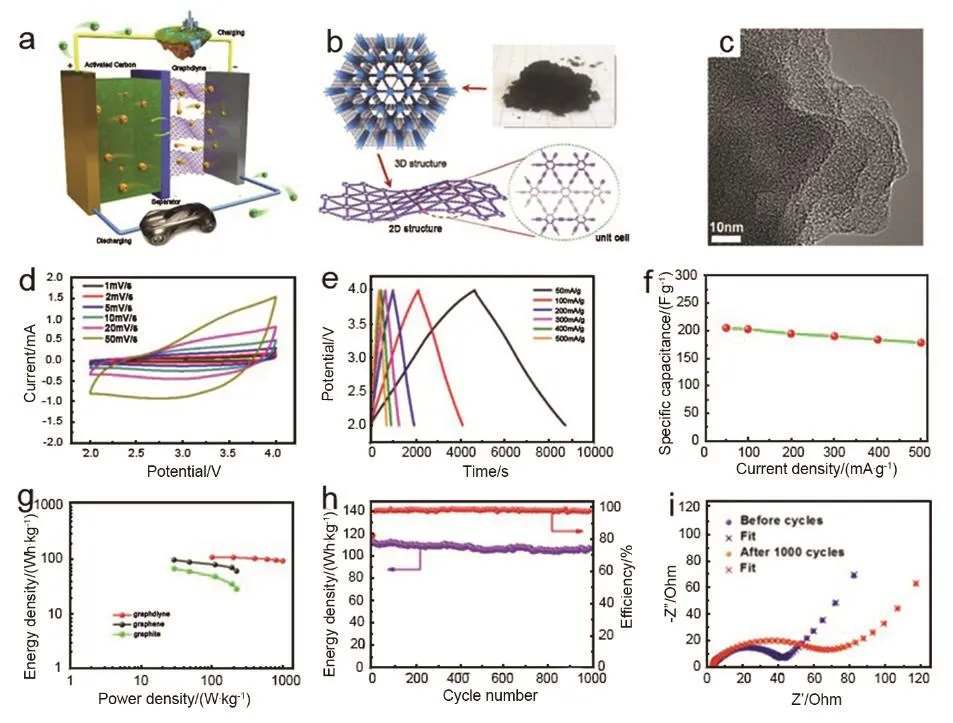
图16 GDY/AC LICs的电化学性能82Fig. 16 The electrochemical performance of GDY/AC LICs 82.
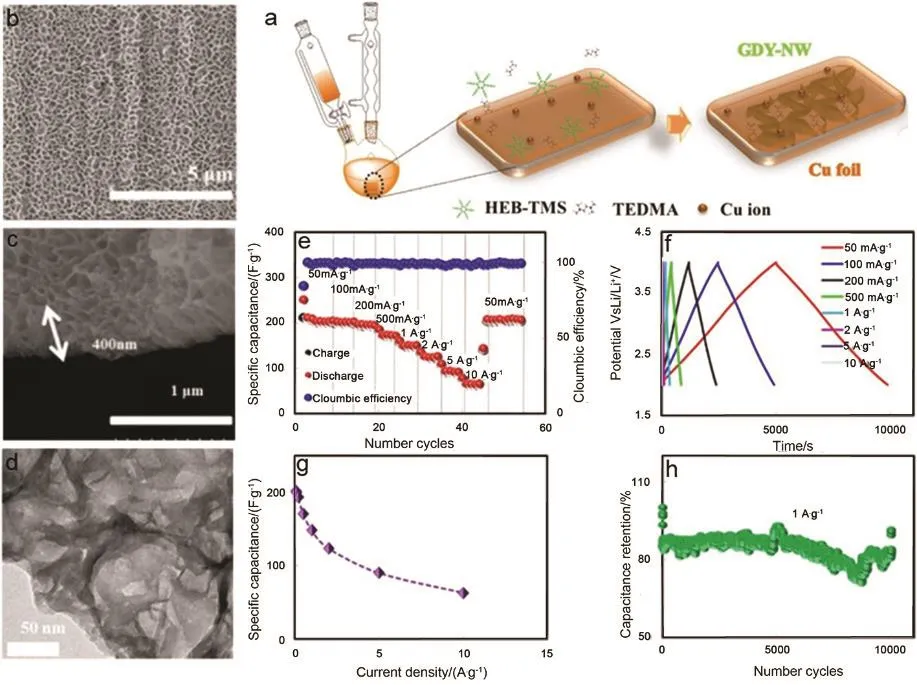
图17 GDY NW的合成和GDY NW/AC LICs的电化学性能101Fig. 17 The synthesis of GDY NW and the electrochemical performance of GDY NW/AC LICs 101.
通过调节溶液中的有机碱与单体的含量可以制备纳米墙形状的石墨炔100。在此基础上,Wang等101将纳米墙状的石墨炔(GDY NW)作为负极材料、活性碳为正极材料组装了锂离子电容器。石墨炔纳米墙大的比表面积、有序的多孔结构,使由其组成的锂离子电容器具有很好的性能(图17b–d)。如图 17e,f显示了电容器在不同电流密度下的充放电曲线。电位窗口为2–4 V,电流密度为 0.05–10 A·g−1。充放电曲线具有很好的线性对称性,表明电容器具有理想的电容行为,无氧化还原峰,近似于GDY/AC LICs82(图17f)。当电流密度从 0.05上升到 10 A·g−1,可逆比容量从 208到67.8 F·g−1的下降。当电流密度重新设置为0.05 A·g−1时,容量又回到 210 F·g−1,显示出好的比容量性能。电容器的比容量在大的电流密度下明显下降(图17g)。图17h显示了该电容器具有极好的循环性能,电流密度为1 A·g−1时,10000圈后电容器的比容量仍可达到189 F·g−1,前5圈后的库伦效率均大于 90%。这表明石墨炔纳米墙结构能够有效的提高锂离子电容器的存储容量、循环性,增强扩散机制。石墨炔纳米墙作为负极材料同时被组装成钠离子电容器。如图18c,d所示,钠离子电容器的构造及其用于给灯泡供电。图 18e显示电容器在不同电流密度(0.05–5 A·g−1)下的充放电性能。电流密度从 0.05 A·g−1上升到 5 A·g−1时,可逆比容量从 270 F·g−1下降到 186 F·g−1,当电流密度重新设定为 0.05 A·g−1时比容量仍可以达到216 F·g−1,显示出极好的倍率性能。功率密度在300、15000 W·kg−1时,电容器对应的能量密度分别为 182.3、166 Wh·kg−1,表现出很大的钠离子存储和传输优势(图18f)。这主要归因于纳米墙的三维多孔结构使石墨炔具有多的钠离子存储位点和极好的化学稳定性。电流密度1 A·g−1下,循环3000圈容量保持在200 F·g−1,从第5圈到第3000圈库伦效率> 90% (图18g)。这表明三维多孔结构的纳米墙能有效的提高钠离子存储容量、循环性,改善钠离子的扩散机制,结果表明石墨炔纳米墙是一个非常有潜力的用于电容器的储锂储钠负极材料。
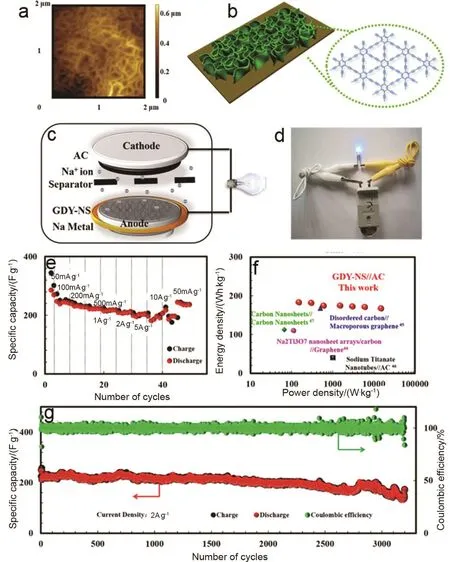
图18 GDY-NS/AC钠离子电容器的电化学性能102Fig. 18 The electrochemical performance of GDY-NS/AC NICs 102.
4 结论与展望
作为一种新型的二维平面全碳材料,石墨炔宽的层间距、大的比表面积、独特的三维孔隙结构和好的导电性等优点使其在能源存储器件电极材料应用中具有巨大的潜力。基于石墨炔基材料的制备与独特的结构特征,本文通过综述石墨炔在能源存储器件应用中的理论和实验进展,也揭示了石墨炔在电极材料应用中的几点优势:石墨炔分子中苯环的存在使石墨炔中含sp2杂化碳,sp2杂化碳的存在使其具有大的 π–π共轭平面有利于电子的迁移,炔键sp杂化碳的存在使其具有很好的导电性;石墨炔分子中苯环和炔键连接形成的三角形孔隙结构和苯环的孔隙均有利于分子和离子的吸附;同样,多层石墨炔堆积形成独特的三维孔道结构,也有利于小分子或离子的吸脱附和嵌入脱出。从计算和实验两方面均可表明,石墨炔作为电极材料在二次电池如锂离子电池、钠离子电池、锂/镁硫电池和超级电容器等能源存储器件中具有巨大的应用前景。与此同时,尽管石墨炔作为电极材料在电化学储能器件中表现出了大的功率密度和能量密度,但是与石墨炔材料的理论容量相比,仍然有较大的差距,这还需依靠对石墨炔材料形貌以及缺陷等的调控去改善。在另一方面,由于在实际应用中对电极材料的量要求巨大,因此需要实现高质量石墨炔材料的宏量制备,以满足今后在实用型器件中的需求。此外,在器件结构方面,目前石墨炔作为电极材料主要用于储锂储钠等器件中,而在其它新型能源器件中的应用比较少。因此在后续的科研工作中还需要加大探索,使石墨炔在电化学领域中的应用面向多样化新型储能器件。
石墨炔自成功合成以来引起了研究者极大的兴趣和关注。目前为止,石墨炔的研究仍然处于初始阶段,其性质和应用方面的研究还有巨大广阔的空间。石墨炔新的合成方法、石墨炔的一些结构表征、更适宜于储能应用的石墨炔的可控制备(单层或者少层、多孔和纳米结构石墨炔的制备等)、理论预测的其他石墨炔拓扑结构的合成等仍然需要不断去探索。另外,石墨炔类材料在电子、能源、信息技术等方面的应用也同样值得期待。
- 物理化学学报的其它文章
- ZnO Ultraviolet Photodetector Modified with Graphdiyne
- Synthesis of Hydrogen Substituted Graphyne through Mechanochemistry and Its Electrocatalytic Properties
- Preparation of Graphdiyne-Organic Conjugated Molecular Composite Materials for Lithium Ion Batteries
- Modulation of Molecular Sensing Properties of Graphdiyne Based on 3d Impurities
- Graphdiyne with Enhanced Ability for Electron Transfer
- Structure Characterization and Application of Graphdiyne in Photocatalytic and Electrocatalytic Reactions

